En los primeros días de la química orgánica, los alquenos fueron descritos como «insaturados» porque, en contraste con los alcanos «saturados», se encontró que reaccionaban fácilmente con sustancias tales como halógenos, haluros de hidrógeno, agentes oxidantes, etc. Por lo tanto, la «afinidad química» de los alquenos se consideraba insatisfecha o «insaturada». (Véase también la sección 1-1I.)
Una de las razones por las que los alquenos y alquinos reaccionan más fácilmente que los alcanos es porque los enlaces carbono-carbono de un enlace múltiple son individualmente más débiles que los enlaces simples carbono-carbono normales. Considere las energías de enlace involucradas. Según la Tabla 4-3, las fuerzas de los enlaces simples, dobles y triples carbono-carbono son \(83\), \(146\), y \(200 \: \text{kcal}\), respectivamente. A partir de estos valores podemos calcular que la escisión de la mitad de un doble enlace carbono-carbono debería requerir \(63 \: \text{kcal}\) y la escisión de un tercio de un triple enlace carbono-carbono debería requerir \(54 \: \text{kcal}\):

En consecuencia, se espera que las reacciones de adición a los enlaces múltiples sean de aproximadamente \(20\)-(30 \: \text{kcal}\} más exotérmicas que las correspondientes reacciones de escisión de los enlaces simples carbono-carbono, como se estima aquí para la reacción con el bromo:
La diferencia sustancial en los calores de reacción del etano, el eteno y el eteno con el bromo se refleja en una consideración práctica muy importante en el manejo del eteno (acetileno), a saber, su estabilidad termodinámica en relación con el carbono sólido y el gas hidrógeno. A diferencia del etano, tanto el eteno como el etileno pueden demostrar, a partir de las energías de enlace, que son inestables con respecto a la formación de carbono sólido e hidrógeno gaseoso:
Aunque esto no parece ofrecer problemas particulares con el eteno, puede producirse una descomposición explosiva del eteno en carbono e hidrógeno si el gas se comprime a \(10\)-\ (20 \: \text{kg cm}^{-2}\). Incluso el etileno líquido (bp \\text{o}} 83) debe manipularse con cuidado. El eteno no se utiliza comercialmente a presión a menos que se mezcle con un gas inerte y se manipule en equipos resistentes. El eteno arde con oxígeno puro para dar una llama muy caliente que se utiliza ampliamente para la soldadura. Para ello, el gas se disuelve bajo aproximadamente \(15 \text{kg cm}^{-2}\) en 2-propanona (acetona, 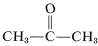 , bp \(56,5^\text{o})) y se contiene en cilindros envasados con tierra de diatomeas.
, bp \(56,5^\text{o})) y se contiene en cilindros envasados con tierra de diatomeas.
¿Por qué el eteno es mucho menos estable que el eteno o el etano? En primer lugar, los enlaces \ce{C-C}} no son tan fuertes como los enlaces \ce{C-H}}. Por lo tanto, es de esperar que se gane en estabilidad cuando los enlaces \ce{C-H}} se hacen a expensas de los enlaces \ce{C-C}}; el eteno y el etano tienen cada uno más enlaces \ce{C-H}} que el eteno. En segundo lugar, el eteno tiene seis electrones entre los dos carbonos y estos electrones experimentan una considerable repulsión interelectrónica mutua. Esto explica el hecho de que la fuerza media del enlace \ce{C-C}\ para el triple enlace de un alquino es \(200/3 = 67 \text{kcal}\), en comparación con \(146/2 = 73 \text{kcal}\ para el doble enlace de un alqueno y \(83 \text{kcal}\ para un enlace simple normal de un alcano.
- John D. Robert y Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Este contenido está protegido por derechos de autor bajo las siguientes condiciones: «Se le concede permiso para la reproducción individual, educativa, de investigación y no comercial, la distribución, la exhibición y la ejecución de esta obra en cualquier formato.»