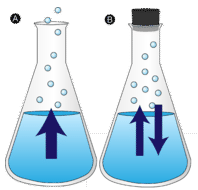
Evaporación
Un charco de agua que se deja sin perturbar acaba desapareciendo. Las moléculas del líquido escapan a la fase gaseosa, convirtiéndose en vapor de agua. La vaporización es el proceso en el que un líquido se convierte en gas. La evaporación es la conversión de un líquido en vapor por debajo de la temperatura de ebullición del líquido. En cambio, si el agua se mantiene en un recipiente cerrado, las moléculas de vapor de agua no tienen la posibilidad de escapar a los alrededores, por lo que el nivel de agua no cambia. Cuando algunas moléculas de agua se convierten en vapor, un número igual de moléculas de vapor de agua se condensan de nuevo en el estado líquido. La condensación es el cambio de estado de un gas a un líquido.
Para que una molécula líquida escape al estado gaseoso, la molécula debe tener suficiente energía cinética para superar las fuerzas de atracción intermoleculares en el líquido. Recordemos que una muestra líquida dada tendrá moléculas con una amplia gama de energías cinéticas. Las moléculas líquidas que tienen este umbral de energía cinética escapan de la superficie y se convierten en vapor. Como resultado, las moléculas de líquido que permanecen ahora tienen una energía cinética más baja. Al producirse la evaporación, la temperatura del líquido restante disminuye. Has observado los efectos del enfriamiento por evaporación. En un día caluroso, las moléculas de agua de tu transpiración absorben el calor del cuerpo y se evaporan de la superficie de tu piel. El proceso de evaporación deja la transpiración restante más fría, que a su vez absorbe más calor de su cuerpo.
Un determinado líquido se evapora más rápidamente cuando se calienta. Esto se debe a que el proceso de calentamiento hace que una mayor fracción de las moléculas del líquido tenga la energía cinética necesaria para escapar de la superficie del líquido. La siguiente figura muestra la distribución de la energía cinética de las moléculas del líquido a dos temperaturas. El número de moléculas que tienen la energía cinética necesaria para evaporarse se muestra en el área sombreada bajo la curva de la derecha. El líquido a mayor temperatura \a la izquierda( T_2 \a la derecha)\a tiene más moléculas capaces de escapar a la fase de vapor que el líquido a menor temperatura \a la izquierda( T_1 \a la derecha)\a la derecha).

Con una altura de 29.029 pies (\left( 8848 \: \text{m} \right)\N-, el Monte Everest, en la cordillera del Himalaya, en la frontera entre China y Nepal, es el punto más alto de la Tierra. Su altitud presenta muchos problemas prácticos para los escaladores. El contenido de oxígeno en el aire es mucho menor que a nivel del mar, por lo que es necesario llevar botellas de oxígeno (aunque algunos escaladores han llegado a la cima sin oxígeno). Otro problema es el de hervir el agua para cocinar los alimentos. Aunque a nivel del mar el agua hierve a \\️, el punto de ebullición en la cima del Everest es sólo de \️. Esta diferencia hace que sea muy difícil conseguir una taza de té decente (lo que definitivamente frustró a algunos de los escaladores británicos).