Gases reales e ideales
Un gas ideal es aquel que sigue las leyes de los gases en todas las condiciones de temperatura y presión. Para ello, el gas tendría que cumplir completamente la teoría cinético-molecular. Las partículas del gas tendrían que ocupar un volumen cero y no deberían presentar ninguna fuerza de atracción entre sí. Como ninguna de estas condiciones puede cumplirse, no existe un gas ideal. Un gas real es un gas que no se comporta según los supuestos de la teoría cinético-molecular. Afortunadamente, en las condiciones de temperatura y presión que se dan normalmente en un laboratorio, los gases reales tienden a comportarse de forma muy parecida a los gases ideales.
¿En qué condiciones entonces, los gases se comportan de forma menos ideal? Cuando un gas se somete a una presión elevada, sus moléculas se ven forzadas a acercarse entre sí, ya que el espacio vacío entre las partículas disminuye. Una disminución del espacio vacío significa que la suposición de que el volumen de las propias partículas es despreciable es menos válida. Cuando un gas se enfría, la disminución de la energía cinética de las partículas hace que se ralenticen. Si las partículas se mueven a menor velocidad, las fuerzas de atracción entre ellas son más prominentes. Otra forma de verlo es que el enfriamiento continuado del gas acabará convirtiéndolo en un líquido y un líquido ya no es ciertamente un gas ideal (véase el nitrógeno líquido en la figura siguiente). En resumen, un gas real se desvía más de un gas ideal a bajas temperaturas y altas presiones. Los gases son más ideales a alta temperatura y baja presión.

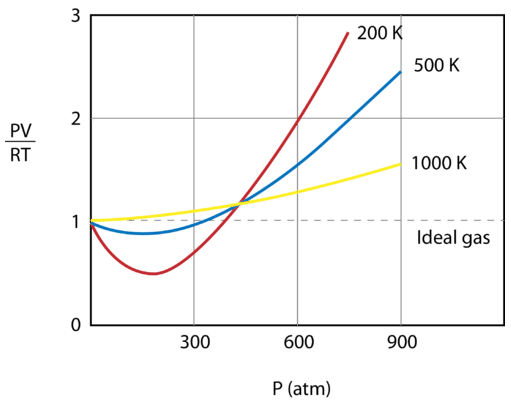
La figura de abajo muestra un gráfico de \(\frac{PV}{RT}\) trazado contra la presión para \(1 \: \text{mol}\) de un gas a tres temperaturas diferentes – \(200 \text{K}\), \(500 \: \text{K}\), y 1000 \: \text{K}\️). Un gas ideal tendría un valor de 1 para esa relación a todas las temperaturas y presiones y el gráfico sería simplemente una línea horizontal. Como se puede ver, se producen desviaciones de un gas ideal. A medida que la presión comienza a aumentar, las fuerzas de atracción hacen que el volumen del gas sea menor de lo esperado y el valor de \frac{PV}{RT}\) cae por debajo de 1. El aumento continuado de la presión hace que el volumen de las partículas sea significativo y el valor de \frac{PV}{RT}\ se eleva a más de 1. Obsérvese que la magnitud de las desviaciones de la idealidad es mayor para el gas a \(200 \: \text{K}\) y menor para el gas a \(1000 \: \text{K}\).
La idealidad de un gas también depende de la fuerza y el tipo de fuerzas atractivas intermoleculares que existen entre las partículas. Los gases cuyas fuerzas de atracción son débiles son más ideales que los que tienen fuerzas de atracción fuertes. A la misma temperatura y presión, el neón es más ideal que el vapor de agua porque los átomos del neón sólo se atraen por fuerzas de dispersión débiles, mientras que las moléculas del vapor de agua se atraen por enlaces de hidrógeno relativamente más fuertes. El helio es un gas más ideal que el neón porque su menor número de electrones hace que las fuerzas de dispersión del helio sean aún más débiles que las del neón.