Fuerza de enlace: Enlaces covalentes
Las moléculas estables existen porque los enlaces covalentes mantienen los átomos unidos. Medimos la fuerza de un enlace covalente por la energía necesaria para romperlo, es decir, la energía necesaria para separar los átomos enlazados. Separar cualquier par de átomos enlazados requiere energía; cuanto más fuerte sea un enlace, mayor será la energía necesaria para romperlo. La energía necesaria para romper un enlace covalente específico en un mol de moléculas gaseosas se denomina energía de enlace o energía de disociación del enlace. La energía de enlace para una molécula diatómica, \(D_{X-Y}\), se define como el cambio de entalpía estándar para la reacción endotérmica:
Por ejemplo, la energía de enlace del enlace covalente puro H-H, \(\Delta_{H-H}\), es de 436 kJ por mol de enlaces H-H rotos:
Romper un enlace siempre requiere añadir energía a la molécula. Por el contrario, la creación de un enlace siempre libera energía.
Las moléculas con tres o más átomos tienen dos o más enlaces. La suma de todas las energías de enlace en tal molécula es igual al cambio de entalpía estándar para la reacción endotérmica que rompe todos los enlaces en la molécula. Por ejemplo, la suma de las energías de los cuatro enlaces C-H en el CH4, 1660 kJ, es igual al cambio de entalpía estándar de la reacción:
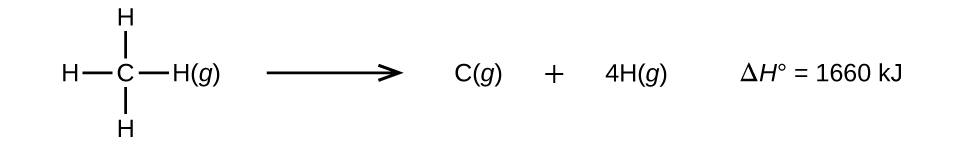
La energía media del enlace C-H, \(D_{C-H}\), es 1660/4 = 415 kJ/mol porque hay cuatro moles de enlaces C-H rotos por mol de la reacción. Aunque los cuatro enlaces C-H son equivalentes en la molécula original, cada uno no requiere la misma energía para romperse; una vez que se rompe el primer enlace (que requiere 439 kJ/mol), los enlaces restantes son más fáciles de romper. El valor de 415 kJ/mol es el promedio, no el valor exacto requerido para romper cualquier enlace.
La fuerza de un enlace entre dos átomos aumenta a medida que aumenta el número de pares de electrones en el enlace. Generalmente, a medida que la fuerza del enlace aumenta, la longitud del enlace disminuye. Así, encontramos que los enlaces triples son más fuertes y más cortos que los enlaces dobles entre los mismos dos átomos; del mismo modo, los enlaces dobles son más fuertes y más cortos que los enlaces simples entre los mismos dos átomos. Las energías de enlace promedio para algunos enlaces comunes aparecen en la tabla (Índice de página 2), y una comparación de las longitudes y fuerzas de enlace para algunos enlaces comunes aparece en la tabla (Índice de página 2). Cuando un átomo se une a varios átomos de un grupo, la fuerza de enlace suele disminuir a medida que descendemos en el grupo. Por ejemplo, C-F es 439 kJ/mol, C-Cl es 330 kJ/mol, y C-Br es 275 kJ/mol.
| Enlace | Energía de enlace | Enlace | Energía de enlace | Energía de enlace | |||
|---|---|---|---|---|---|---|---|
| H-H | 436 | C-S | 260 | F-Cl | 255 | ||
| H-C | 415 | C-Cl | 330 | F-Br | 235 | ||
| H-N | 390 | C-Br | 275 | Si-Si | 230 | ||
| H-O | 464 | C-I | 240 | Si-P | 215 | ||
| H-F | 569 | N-N | 160 | Si-S | 225 | ||
| H-Si | 395 | \N(\mathrm{N=N}) | 418 | Si-Cl | 359 | ||
| H-P | 320 | (\mathrm{N≡N}) | 946 | Si-Br | 290 | ||
| H-S | 340 | N-O | 200 | Si-I | 215 | ||
| H-Cl | 432 | N-F | 270 | P-P | 215 | ||
| H-Br | 370 | N-P | 210 | P-S | 230 | ||
| H-I | 295 | N-Cl | 200 | P-Cl | 330 | ||
| C-C | 345 | N-Br | 245 | P-Br | 270 | ||
| \N(\mathrm{C=C}\) | 611 | O-O | 140 | P-I | 215 | ||
| (\mathrm{C≡C}) | 837 | (\mathrm{O=O}) | 498 | S-S | 215 | ||
| C-N | 290 | O-F | 160 | S-Cl | 250 | ||
| (\mathrm{C=N}) | 615 | O-Si | 370 | S-Br | 215 | ||
| (\mathrm{C≡N}) | 891 | O-P | 350 | Cl-Cl | 243 | ||
| C-O | 350 | O-Cl | 5 | Cl-Br | 220 | ||
| \N(\Nmathrm{C=O}\N) | 741 | O-I | 200 | Cl-I | 210 | ||
| (\mathrm{C≡O}) | 1080 | F-F | 160 | Br-Br | 190 | ||
| C-F | 439 | F-Si | 540 | Br-I | 180 | ||
| C-Si | 360 | F-P | 489 | I-I | 150 | ||
| C-P | 265 | F-S | 285 |
| Enlace | Longitud de enlace (Å) | Energía de enlace (kJ/mol) |
|---|---|---|
| C-C | 1.54 | 345 |
| (\mathrm{C=C}\) | 1.34 | 611 |
| (\mathrm{C≡C}) | 1.20 | 837 |
| C-N | 1,43 | 290 |
| (\mathrm{C=N}) | 1.38 | 615 |
| (\mathrm{C≡N}) | 1.16 | 891 |
| C-O | 1,43 | 350 |
| (\mathrm{C=O}) | 1.23 | 741 |
| (\mathrm{C≡O}) | 1,13 | 1080 |
Podemos utilizar las energías de enlace para calcular los cambios de entalpía aproximados para las reacciones en las que no se dispone de entalpías de formación. Los cálculos de este tipo también nos dirán si una reacción es exotérmica o endotérmica.
- Una reacción exotérmica (ΔH negativo, calor producido) resulta cuando los enlaces en los productos son más fuertes que los enlaces en los reactivos.
- Una reacción endotérmica (ΔH positivo, calor absorbido) resulta cuando los enlaces en los productos son más débiles que los de los reactivos.
El cambio de entalpía, ΔH, para una reacción química es aproximadamente igual a la suma de la energía necesaria para romper todos los enlaces en los reactantes (energía «in», signo positivo) más la energía liberada cuando se forman todos los enlaces en los productos (energía «out», signo negativo). Esto se puede expresar matemáticamente de la siguiente manera:
\8683>
En esta expresión, el símbolo \(\Sigma\) significa «la suma de» y D representa la energía de enlace en kilojulios por mol, que siempre es un número positivo. La energía de enlace se obtiene de una tabla y dependerá de si el enlace concreto es simple, doble o triple. Por lo tanto, al calcular las entalpías de esta manera, es importante que consideremos el enlace en todos los reactivos y productos. Debido a que los valores de D son típicamente promedios para un tipo de enlace en muchas moléculas diferentes, este cálculo proporciona una estimación aproximada, no un valor exacto, para la entalpía de reacción.
Considere la siguiente reacción:
o
Para formar dos moles de HCl, se debe romper un mol de enlaces H-H y un mol de enlaces Cl-Cl. La energía necesaria para romper estos enlaces es la suma de la energía de enlace del enlace H-H (436 kJ/mol) y del enlace Cl-Cl (243 kJ/mol). Durante la reacción, se forman dos moles de enlaces H-Cl (energía de enlace = 432 kJ/mol), liberando 2 × 432 kJ; o 864 kJ. Dado que los enlaces de los productos son más fuertes que los de los reactivos, la reacción libera más energía de la que consume:
-2D_{H-Cl}\
&=mathrm{-2(432)=-185\:kJ}
end {align*}]
Este exceso de energía se libera en forma de calor, por lo que la reacción es exotérmica. La tabla T2 da un valor para la entalpía molar estándar de formación del HCl(g), \(ΔH^\c_\ce f\), de -92,307 kJ/mol. El doble de ese valor es -184,6 kJ, lo que coincide con la respuesta obtenida anteriormente para la formación de dos moles de HCl.
Ejemplo \(\PageIndex{1}\): Uso de las energías de enlace para aproximar los cambios de entalpía
El metanol, CH3OH, puede ser un excelente combustible alternativo. La reacción a alta temperatura del vapor y el carbono produce una mezcla de los gases monóxido de carbono, CO, e hidrógeno, H2, a partir de la cual se puede producir metanol. Utilizando las energías de enlace de la Tabla \(\PageIndex{2}), calcule el cambio aproximado de entalpía, ΔH, para la reacción aquí:
\
Solución
Primero, necesitamos escribir las estructuras de Lewis de los reactantes y los productos:
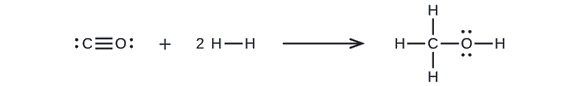
A partir de esto, vemos que el ΔH para esta reacción implica la energía requerida para romper un triple enlace C-O y dos enlaces simples H-H, así como la energía producida por la formación de tres enlaces simples C-H, un enlace simple C-O y un enlace simple O-H. Podemos expresar esto de la siguiente manera (a través de la Ecuación \ref{EQ3}):
\-}
\end {align*}]
Usando los valores de energía de enlace en la Tabla \(\PageIndex{2}\), obtenemos:
&=\ce{-107\\}:kJ}
\pend {align*}]
Podemos comparar este valor con el valor calculado en base a los datos de \(ΔH^\c_\ce f\) del Apéndice G:
&=-\
&=\mathrm{-90.5\:kJ}
\end {align*}]
Nota que hay una diferencia bastante significativa entre los valores calculados con los dos métodos diferentes. Esto se debe a que los valores D son la media de diferentes fuerzas de enlace; por lo tanto, a menudo sólo dan un acuerdo aproximado con otros datos.
Ejercicio \ {{PageIndex{1}})
El alcohol etílico, CH3CH2OH, fue uno de los primeros productos químicos orgánicos sintetizados deliberadamente por los seres humanos. Tiene muchos usos en la industria y es el alcohol que contienen las bebidas alcohólicas. Puede obtenerse por la fermentación del azúcar o sintetizarse por la hidratación del etileno en la siguiente reacción:

Usando las energías de enlace en la Tabla \(\PageIndex{2}\), calcule un cambio de entalpía aproximado, ΔH, para esta reacción.
Video \(\PageIndex{2}\): Un repaso al enlace atómico.
Los enlaces covalentes se forman cuando los electrones se comparten entre átomos y son atraídos por los núcleos de ambos átomos. En los enlaces covalentes puros, los electrones se comparten por igual. En los enlaces covalentes polares, los electrones se comparten de forma desigual, ya que un átomo ejerce una fuerza de atracción más fuerte sobre los electrones que el otro.
La fuerza de un enlace covalente se mide por su energía de disociación del enlace, es decir, la cantidad de energía necesaria para romper ese enlace concreto en un mol de moléculas. Los enlaces múltiples son más fuertes que los enlaces simples entre los mismos átomos. La entalpía de una reacción puede estimarse basándose en el aporte de energía necesario para romper los enlaces y la energía liberada cuando se forman nuevos enlaces.
Ecuaciones clave
- Energía de enlace para una molécula diatómica: \(\ce{XY}(g)⟶\ce{X}(g)+\ce{Y}(g)\hspace{20px}\ce{D_{X–Y}}=ΔH°\)
- Enthalpy change: ΔH = ƩBonos rotos – ƩBonos formados
Notas a pie de página
- Esta pregunta está tomada del Chemistry Advanced Placement Examination y se utiliza con el permiso del Educational Testing Service.
Glosario
energía de enlace (también, energía de disociación de enlace) energía requerida para romper un enlace covalente en una sustancia gaseosa
Contribuidores
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) y Richard Langley (Stephen F. Austin State University) con autores colaboradores. El contenido del libro de texto producido por OpenStax College se encuentra bajo una licencia Creative Commons Attribution License 4.0. Descárgalo gratuitamente en http://cnx.org/contents/85abf193-2bd…[email protected]).
- Adelaide Clark, Oregon Institute of Technology
- Fuse School, Open Educational Resource free of charge, under a Creative Commons License: Attribution-NonCommercial CC BY-NC (Ver Escritura de Licencia: https://creativecommons.org/licenses/by-nc/4.0/)
- Curso Crash de Química: Crash Course es una división de Complexly y los vídeos son gratuitos para su transmisión con fines educativos.
Comentarios
¿Tienes comentarios que dar sobre este texto? Haga clic aquí.
¿Ha encontrado una errata y quiere un crédito extra? Haga clic aquí.