Qué es el Cobalto
El cobalto (pronunciación: KO-bolt) es un elemento duro, de color azul plateado brillante, perteneciente al grupo de los metales de transición, y está representado por el símbolo químico Co . Es químicamente activo y puede formar muchos compuestos. Es un metal ferromagnético que puede ser magnetizado y se alea con níquel y aluminio para producir potentes imanes .

Símbolo del cobalto
Isótopos
Tiene un isótopo natural estable, el 59Co, y 28 radioisótopos, de los cuales los más estables son el 60Co, el 57Co, el 56Co y el 58Co, con periodos de semidesintegración de 5,2714 años, 271,8 días, 77,27 días y 70,86 días respectivamente. Los periodos de semidesintegración de sus otros radioisótopos son inferiores a 18 horas.
¿Dónde se encuentra el cobalto
El cobalto se encuentra naturalmente en combinación con otros elementos en los minerales como la cobaltita (un sulfuro que contiene cobalto, arsénico, hierro y níquel), la eritrita (arseniato de cobalto hidratado) y la skutterudita (arseniato de cobalto) . Generalmente se obtiene como subproducto de la minería del cobre y del níquel.
Los nódulos de manganeso que se encuentran en los fondos marinos son enormes reservas de metales de transición, que contienen toneladas de cobalto . Los tres principales países poseedores de reservas de cobalto son la República Democrática del Congo (RDC), Australia y Cuba, mientras que los tres principales productores son la RDC, China y Zambia.

Cobalto
Historia
Origen de su nombre: El nombre deriva de ‘kobald’, «duende» en alemán, y de ‘cobalos’, palabra griega que significa «mina» .
Quién lo descubrió: El elemento fue encontrado por el químico y mineralogista sueco Georg Brandt .
Cuándo y cómo se descubrió
La tumba de Tutankamón, el antiguo faraón egipcio que gobernó durante los años 1361-1352 a.C., tenía un objeto de vidrio de color azul intenso que estaba hecho de cobalto . En China, el azul de cobalto se utilizaba para hacer esmaltes de cerámica.
Además de sus antiguos orígenes, su descubrimiento en los últimos tiempos se remonta a la década de 1730, cuando Georg Brandt se interesó por un mineral azul de algunas de las minas locales . Finalmente, logró demostrar que el mineral azul contenía un nuevo metal . Describió sus propiedades y publicó los resultados en 1739.
Su descubrimiento fue controvertido, ya que otros químicos discutieron sus hallazgos durante muchos años. Sin embargo, su colega químico sueco Torbern Bergman realizó nuevos estudios y confirmó el descubrimiento de Georg Brandt en 1780 .
Identificación del cobalto |
|||
| Número atómico | 27 | ||
| Número CAS | 7440-48-4 | ||
| Posición en la tabla periódica | Grupo | Período | Bloque |
| 9 | 4 | d | |
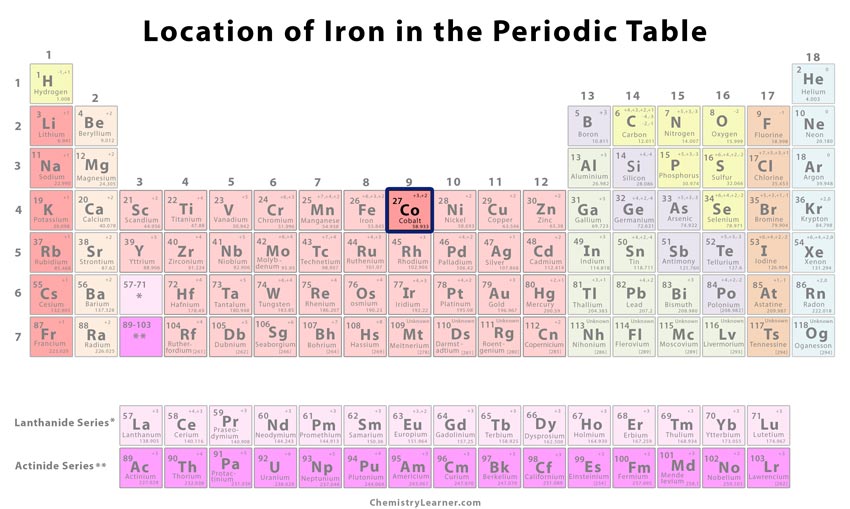
¿Dónde se encuentra el cobalto en la tabla periódica
Propiedades y características del cobalto
Propiedades generales |
||||||||||||||||
| Masa atómica relativa | 58.933 | |||||||||||||||
| Masa atómica | 58,933 amu | |||||||||||||||
| Masa molecular | 58,9331950 ± 0,0000050 g/mol | |||||||||||||||
| Peso molecular | 58.933 g/mol | |||||||||||||||
Propiedades físicas |
||||||||||||||||
| Color | Azul plateado, blanco azulado | |||||||||||||||
| 1495 °C, 2723 °F | ||||||||||||||||
| Punto de ebullición | 2927 °C, 5301 °F | |||||||||||||||
| Densidad | 8.86 g cm-3 | |||||||||||||||
| Estado de la materia a temperatura ambiente (sólido/líquido/gas) | Sólido | |||||||||||||||
| Dureza | ||||||||||||||||
| – Brinell | 700 MPa | |||||||||||||||
| – Mohs | 5 | |||||||||||||||
| – Vickers | 1043 MPa | |||||||||||||||
| Conductividad eléctrica | 1.7 X 107 S/m | |||||||||||||||
| Carga iónica | 3+ | |||||||||||||||
| Conductividad térmica | 100 W/(m K) | |||||||||||||||
| Calor específico | 421 J kg-1 K-1 | |||||||||||||||
| Módulo de masa | Desconocido | |||||||||||||||
| Módulo de corte | Desconocido | |||||||||||||||
| Módulo de Young | Desconocido | |||||||||||||||
| Presión de vapor | ||||||||||||||||
| 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | ||||||
| – Presión (Pa) | – | – | – | 2.09 X 10-10 | 1,00 X 10-6 | 4,19 X 10-4 | 0,0379 | 1.15 | 16 | – | – | |||||
Propiedades químicas |
||||||||||||||||
| Estados de oxidación | 3, 2, 0, -1 | |||||||||||||||
| Isótopos | Isótopo | Masa | Abundancia (%) | Vida media | Modo de desintegración | |||||||||||
| 59Co | 58.933 | 100 | – | – | ||||||||||||
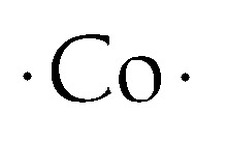
Estructura de puntos de Lewis del cobalto
Datos atómicos del cobalto (elemento 27)
| 9 | ||||||||
| Números cuánticos | ||||||||
| – n | 3 | |||||||
| – ℓ | 2 | |||||||
| – mℓ | -1 | |||||||
| – ms | -1/2 | |||||||
| Configuración de electrones (configuración de gas noble) | 3d74s2 | |||||||
| Estructura atómica | ||||||||
| – Número de electrones | 27 | |||||||
| – Número de neutrones | 32 | |||||||
| – Número de protones | 27 | |||||||
| Radio del átomo | ||||||||
| – Radio atómico | 2.00 Å | |||||||
| – Radio covalente | 1,18 Å | |||||||
| Electronegatividad (escala de Pauling) | 1,88 | |||||||
| Afinidad de los electrones | 63.873 kJ mol-1 | |||||||
| Energía de ionización (kJ mol-1) | 1ª | 2ª | 3ª | 4ª | 5ª | 6ª | 7ª | 8ª |
| 760.402 | 1648.356 | 3232.3 | 4949.7 | 7670.6 | 9842 | 12437 | 15225.4 | |
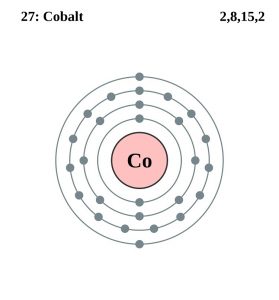
Configuración de los electrones del cobalto (modelo de Bohr)
¿Para qué se utiliza el cobalto
- El cobalto se alea para su uso en generadores de turbinas de gas y turbinas de reacción debido a su fuerza de alta temperatura y resistencia a la corrosión .
- El cobalto se utiliza ocasionalmente en galvanoplastia debido a su dureza y a su atractiva apariencia.
- Se utiliza comúnmente como material catódico en las baterías de iones de litio .
- Las sales de cobalto se utilizan para impartir colores azules intensos en el vidrio, la porcelana, la cerámica, los esmaltes y la pintura.
- El 60Co radiactivo se utiliza para el tratamiento del cáncer y en la irradiación de alimentos para controlar los patógenos y prolongar su vida útil.
- Las superaleaciones de estelita, compuestas de cromo, cobalto y tungsteno, se utilizan para fabricar herramientas de corte resistentes a altas temperaturas y al desgaste .
Toxicidad del cobalto y efectos sobre la salud
La intoxicación por cobalto puede producirse al ingerirlo accidentalmente, respirarlo o tenerlo en contacto con la piel en grandes cantidades . En grandes cantidades, el cobalto puede ser cancerígeno en los seres humanos y en algunos animales .
Se encuentra en cantidades mínimas en los seres humanos y es un componente esencial de la vitamina B12 . También se administran pequeñas dosis de cobalto a algunos animales para prevenir deficiencias minerales en ellos .

Mineral de cobalto (cobaltita)
Hechos interesantes
- El cobalto está representado gráficamente por un «kobold» o duende (considerado molesto por los mineros alemanes medievales) con un poco de porcelana china en el fondo, en referencia a su uso como esmalte de cerámica en la antigua China .
- El cobalto puede conservar sus propiedades magnéticas hasta una temperatura (punto Curie) de 1.121 °C (2049.8 °F), el más alto de todos los elementos ferromagnéticos.
- En 2010, científicos alemanes utilizaron un átomo de cobalto para capturar las primeras imágenes del cambio de espín.
Precio del cobalto
El coste del cobalto puro es de unos 0,21 dólares por gramo, y a granel, cuesta unos 0.044 por gramo .
- http://www.rsc.org/periodic-table/element/27/cobalt
- https://education.jlab.org/itselemental/ele027.html
- https://www.livescience.com/29275-cobalt.html
- https://www.chemicool.com/elements/cobalt.html
- https://education.jlab.org/itselemental/iso027.html
- https://www.webqc.org/molecular-weight-of-Co%28cobalt%29.html
- https://pubchem.ncbi.nlm.nih.gov/compound/cobalt#section=Top
- http://periodictable.com/Elements/027/data.html
- http://www.gpb.org/files/pdfs/gpbclassroom/chemistry/ionicChargesChart.pdf
- http://dwb4.unl.edu/Chem/CHEM869B/CHEM869BLinks/learn.chem.vt.edu/tutorials/bonding/valence.html
- http://chemistry-reference.com/q_elements.asp?Symbol=Co&language=en
- https://medlineplus.gov/ency/article/002495.htm