I begyndelsen af den organiske kemi blev alkener beskrevet som “umættede”, fordi de i modsætning til de “mættede” alkaner reagerede let med stoffer som halogener, hydrogenhalogenider, oxidationsmidler og så videre. Derfor blev alkenernes “kemiske affinitet” anset for at være utilfredsstillende eller “umættet”. (Se også afsnit 1-1I.)
En af grundene til, at alkener og alkyner reagerer lettere end alkaner, er, at kulstof-kulstof-bindingerne i en flerbinding individuelt set er svagere end normale kulstof-kulstof-enkelbindinger. Overvej de involverede bindingsenergier. Ifølge tabel 4-3 er styrken af kulstof-kulstof enkelt-, dobbelt- og trippelbindinger henholdsvis \(83\), \(146\) og \(200 \: \text{kcal}\). Ud fra disse værdier kan vi beregne, at spaltning af halvdelen af en kulstof-kulstof-dobbeltbinding bør kræve \(63 \: \text{kcal}\) og spaltning af en tredjedel af en kulstof-kulstof-dobbeltbinding bør kræve \(54 \: \text{kcal}\):

Som følge heraf forventes additionsreaktioner til flere bindinger at være omkring \(20\\)-\(30 \: \text{kcal}\) mere eksoterme end de tilsvarende spaltningsreaktioner af kulstof-kulstof enkeltbindinger, som anslået her for reaktion med brom:
Den betydelige forskel i reaktionsvarme for ethan, ethen og ethen med brom afspejles i et meget vigtigt praktisk hensyn ved håndtering af ethen (acetylen), nemlig dets termodynamiske stabilitet i forhold til fast kulstof og brintgas. I modsætning til ethan kan både ethen og ethen påvises ud fra bindingsenergier at være ustabile med hensyn til dannelse af fast kulstof og gasformigt brint:
Selv om dette ikke synes at give særlige problemer med ethen, kan der ske en eksplosiv nedbrydning af ethen til kulstof og brint, hvis gassen komprimeres til \(10\)-\(20 \: \text{kg cm}^{-2}\). Selv flydende ethin (bp \sim 83^^\text{o}\)) skal håndteres med forsigtighed. Ethyn anvendes ikke kommercielt under tryk, medmindre det er blandet med en inert gas og håndteres i robust udstyr. Ethyn brænder sammen med ren ilt og giver en meget varm flamme, som i vid udstrækning anvendes til svejsning. Til dette formål opløses gassen under ca. \(15 \(15 \text: \text{kg cm}^{-2}\) i 2-propanon (acetone, 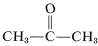 , bp \(56,5^\text{o}\)) og opbevares i flasker pakket med diatoméjord.
, bp \(56,5^\text{o}\)) og opbevares i flasker pakket med diatoméjord.
Hvorfor er ethin så meget mindre stabilt end ethen eller ethan? For det første er \(\ce{C-C}\) bindinger ikke så stærke som \(\ce{C-H}\) bindinger. Derfor kan man normalt forvente en gevinst i stabilitet, når \(\ce{C-H}\) bindinger laves på bekostning af \(\ce{C-C}\) bindinger; ethen og ethan har hver især flere \(\ce{C-H}\) bindinger end ethen har. For det andet har ethin seks elektroner mellem de to kulstofatomer, og disse elektroner oplever en betydelig gensidig interelektronisk frastødning. Dette forklarer, at den gennemsnitlige \(\ce{C-C}\) bindingsstyrke for tripelbindingen i et alkyn er \(200/3 = 67 \text{kcal}\), sammenlignet med \(146/2 = 73 \text{kcal}\) for dobbeltbindingen i et alken og \(83 \text{kcal}\) for en normal enkeltbinding i en alkan.
- John D. Robert og Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, anden udgave. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Dette indhold er ophavsretligt beskyttet på følgende betingelser: “Der gives tilladelse til individuel, uddannelsesmæssig, forskningsmæssig og ikke-kommerciel reproduktion, distribution, visning og fremførelse af dette værk i ethvert format.”