Reelle og ideelle gasser
En ideel gas er en gas, der følger gaslovene ved alle temperatur- og trykforhold. For at gøre det skal gassen fuldstændig overholde den kinetisk-molekylære teori. Gaspartiklerne skal have et volumen på nul, og de skal ikke udvise nogen som helst tiltrækningskraft over for hinanden. Da ingen af disse betingelser kan være opfyldt, findes der ikke nogen ideel gas. En rigtig gas er en gas, der ikke opfører sig i overensstemmelse med antagelserne i den kinetisk-molekylære teori. Heldigvis har virkelige gasser ved de temperatur- og trykforhold, som man normalt møder i et laboratorium, en tendens til at opføre sig meget lig ideelle gasser.
Under hvilke forhold opfører gasser sig så mindst ideelt? Når en gas udsættes for et højt tryk, tvinges dens molekyler tættere sammen, da det tomme rum mellem partiklerne mindskes. Et fald i tomrummet betyder, at antagelsen om, at volumenet af selve partiklerne er ubetydeligt, er mindre gyldig. Når en gas afkøles, medfører faldet i partiklernes kinetiske energi, at de bliver langsommere. Hvis partiklerne bevæger sig med lavere hastigheder, er de tiltrækkende kræfter mellem dem mere fremtrædende. En anden måde at se det på er, at fortsat afkøling af gassen til sidst vil forvandle den til en væske, og en væske er bestemt ikke længere en ideel gas (se flydende nitrogen i figuren nedenfor). Sammenfattende kan man sige, at en rigtig gas afviger mest fra en idealgas ved lave temperaturer og høje tryk. Gasser er mest ideelle ved høj temperatur og lavt tryk.

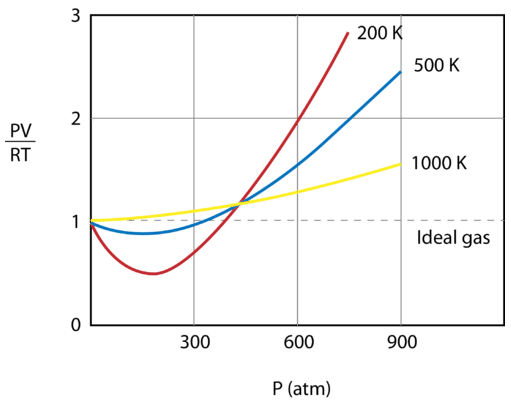
Figuren nedenfor viser en graf over \(\(\frac{PV}{RT}\) plottet mod trykket for \(1 \: \text{mol}\) af en gas ved tre forskellige temperaturer – \(200 \: \text{K}}\), \(500 \: \text{K}}\), og 1000 \: \text{K}}\). En ideel gas ville have en værdi på 1 for dette forhold ved alle temperaturer og tryk, og grafen ville blot være en vandret linje. Som det kan ses, forekommer der afvigelser fra en ideal gas. Når trykket begynder at stige, medfører tiltrækningskræfterne, at gassens volumen bliver mindre end forventet, og værdien af \(\frac{PV}{RT}\) falder til under 1. Fortsat trykforøgelse medfører, at partiklernes volumen bliver betydeligt, og værdien af \(\frac{PV}{RT}}\) stiger til over 1. Bemærk, at størrelsen af afvigelserne fra idealiteten er størst for gassen ved \(200 \: \text{K}}\) og mindst for gassen ved \(1000 \: \text{K}}\).
En gasses idealitet afhænger også af styrken og typen af de intermolekylære tiltrækningskræfter, der eksisterer mellem partiklerne. Gasser, hvis tiltrækningskræfter er svage, er mere ideelle end gasser med stærke tiltrækningskræfter. Ved samme temperatur og tryk er neon mere ideelt end vanddamp, fordi neonens atomer kun tiltrækkes af svage dispersionskræfter, mens vanddampens molekyler tiltrækkes af relativt stærkere hydrogenbindinger. Helium er en mere ideel gas end neon, fordi dets mindre antal elektroner betyder, at heliums dispersionskræfter er endnu svagere end neons.