Bindingsstyrke: Kovalente bindinger
Stable molekyler eksisterer, fordi kovalente bindinger holder atomerne sammen. Vi måler styrken af en kovalent binding ved den energi, der kræves for at bryde den, dvs. den energi, der er nødvendig for at adskille de bundne atomer. Det kræver energi at adskille ethvert par af bundne atomer; jo stærkere en binding er, jo større er den energi, der kræves for at bryde den. Den energi, der kræves for at bryde en bestemt kovalent binding i et mol gasformige molekyler, kaldes bindingsenergien eller bindingsdissociationsenergien. Bindingsenergien for et toatomigt molekyle, \(D_{X-Y}\), er defineret som standard enthalpiforandringen for den endoterme reaktion:
\
For eksempel er bindingsenergien for den rene kovalente H-H-binding, \(\Delta_{H-H-H}\), 436 kJ pr. mol af brudte H-H-bindinger:
\
Brudning af en binding kræver altid, at der tilføres energi til molekylet. Tilsvarende frigøres der altid energi ved at lave en binding.
Molekyler med tre eller flere atomer har to eller flere bindinger. Summen af alle bindingsenergier i et sådant molekyle er lig med standard enthalpiforandringen for den endoterme reaktion, der bryder alle bindinger i molekylet. F.eks. er summen af de fire C-H-bindingsenergier i CH4, 1660 kJ, lig med standard enthalpiforandringen for reaktionen:
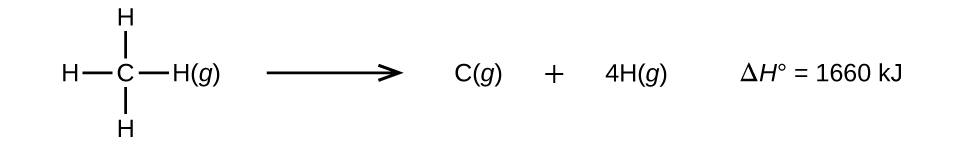
Den gennemsnitlige C-H-bindingsenergi, \(D_{C-H}\), er 1660/4 = 415 kJ/mol, fordi der er fire mol C-H-bindinger, der brydes pr. mol af reaktionen. Selv om de fire C-H-bindinger er ækvivalente i det oprindelige molekyle, kræver de ikke hver især den samme energi at bryde; når først den første binding er brudt (hvilket kræver 439 kJ/mol), er de resterende bindinger lettere at bryde. Værdien 415 kJ/mol er gennemsnitsværdien, ikke den nøjagtige værdi, der kræves for at bryde en enkelt binding.
Styrken af en binding mellem to atomer stiger, når antallet af elektronpar i bindingen stiger. Generelt gælder det, at når bindingsstyrken stiger, falder bindingslængden. Således finder vi, at tripelbindinger er stærkere og kortere end dobbeltbindinger mellem de samme to atomer; på samme måde er dobbeltbindinger stærkere og kortere end enkeltbindinger mellem de samme to atomer. Gennemsnitlige bindingsenergier for nogle almindelige bindinger er vist i tabel \(\PageIndex{2}\), og en sammenligning af bindingslængder og bindingsstyrker for nogle almindelige bindinger er vist i tabel \(\PageIndex{2}\). Når et atom binder sig til forskellige atomer i en gruppe, falder bindingsstyrken typisk, efterhånden som man bevæger sig nedad i gruppen. For eksempel er C-F 439 kJ/mol, C-Cl er 330 kJ/mol og C-Br er 275 kJ/mol.
| Binding | Bindelingsenergi | Binding | Bindelingsenergi | Binding | Bindelingsenergi | Bindelingsenergi | ||
|---|---|---|---|---|---|---|---|---|
| H-H | 436 | C-S | 260 | F-Cl | 255 | |||
| H-C | 415 | C-Cl | 330 | F-Br | 235 | |||
| H-N | 390 | C-Br | 275 | Si-Si | Si-Si | 230 | ||
| H-O | 464 | C-I | 240 | Si-P | 215 | |||
| H-F | 569 | N-N | N-N | 160 | Si-S | 225 | ||
| H-Si | 395 | \(\mathrm{N=N}\) | 418 | Si-Cl | 359 | |||
| H-P | 320 | \(\mathrm{N≡N}\) | 946 | Si-Br | 290 | |||
| H-S | 340 | N-O | 200 | 200 | Si-I | 215 | ||
| H-Cl | 432 | N-F | 270 | P-P | 215 | |||
| H-Br | H-Br | 370 | N-P | 210 | P-S | 230 | ||
| H-I | 295 | N-Cl | 200 | P-Cl | 330 | 330 | ||
| C-C | 345 | N-Br | 245 | P-Br | 270 | |||
| \(\mathrm{C=C}\) | 611 | O-O | 140 | P-I | 215 | |||
| \(\mathrm{C≡C}\) | 837 | \(\mathrm{O=O}\) | 498 | S-S | 215 | 215 | ||
| C-N | 290 | O-F | 160 | S-Cl | 250 | |||
| \(\mathrm{C=N}\) | 615 | O-Si | 370 | S-Br | 215 | |||
| \(\mathrm{C≡N}}\) | 891 | O-P | 350 | Cl-Cl | 243 | |||
| C-O | 350 | O-Cl | 205 | Cl-Br | 220 | |||
| \(\mathrm{C=O}\) | 741 | O-I | 200 | 200 | Cl-I | 210 | ||
| \(\mathrm{C≡O}\) | 1080 | F-F | 160 | Br-Br | 190 | |||
| C-F | 439 | F-Si | 540 | Br-I | 180 | |||
| C-Si | 360 | F-P | 489 | I-I | ||||
| C-Si | 360 | F-P | 489 | I-I | 150 | |||
| C-P | 265 | F-S | 285 |
| Binding | Bindelængde (Å) | Bindelingsenergi (kJ/mol) | |
|---|---|---|---|
| C-C | 1.54 | 345 | |
| \(\mathrm{C=C}\) | 1.34 | 611 | |
| \(\mathrm{C≡C}\) | 1.20 | 837 | |
| C-N | 1.43 | 290 | |
| \(\mathrm{C=N}}\) | 1.38 | 615 | |
| \(\mathrm{C≡N}\) | 1.16 | 891 | |
| C-O | 1.43 | 350 | |
| \(\mathrm{C=O}\) | 1.23 | 741 | |
| \(\mathrm{C≡O}\) | 1.13 | 1080 |
Vi kan bruge bindingsenergier til at beregne omtrentlige enthalpiforandringer for reaktioner, hvor dannelsesenthalpier ikke er tilgængelige. Beregninger af denne type vil også fortælle os, om en reaktion er exotermisk eller endotermisk.
- En exotermisk reaktion (ΔH negativ, varme produceret) opstår, når bindingerne i produkterne er stærkere end bindingerne i reaktanterne.
- En endotermisk reaktion (ΔH positiv, varme optaget) opstår, når bindingerne i produkterne er svagere end bindingerne i reaktanterne.
Enthalpiændringen, ΔH, for en kemisk reaktion er omtrent lig med summen af den energi, der kræves for at bryde alle bindinger i reaktanterne (energi “ind”, positivt fortegn) plus den energi, der frigives, når alle bindinger dannes i produkterne (energi “ud”, negativt fortegn). Dette kan udtrykkes matematisk på følgende måde:
\
I dette udtryk betyder symbolet \(\Sigma\) “summen af”, og D repræsenterer bindingsenergien i kilojoule pr. mol, som altid er et positivt tal. Bindingsenergien fås fra en tabel og vil afhænge af, om den pågældende binding er en enkelt-, dobbelt- eller trippelbinding. Ved beregning af enthalpier på denne måde er det således vigtigt, at vi tager hensyn til bindingerne i alle reaktanter og produkter. Da D-værdier typisk er gennemsnitsværdier for en bindingstype i mange forskellige molekyler, giver denne beregning et groft skøn, ikke en nøjagtig værdi, for reaktionsenthalpiens størrelse.
Omgå følgende reaktion:
eller
\
For at danne to mol HCl skal der brydes et mol H-H-bindinger og et mol Cl-Cl-bindinger. Den energi, der kræves for at bryde disse bindinger, er summen af bindingsenergien for H-H-bindingen (436 kJ/mol) og Cl-Cl-bindingen (243 kJ/mol). Under reaktionen dannes der to mol H-Cl-bindinger (bindingsenergi = 432 kJ/mol), hvorved der frigives 2 × 432 kJ, dvs. 864 kJ. Da bindingerne i produkterne er stærkere end i reaktanterne, frigiver reaktionen mere energi, end den forbruger:
\-2D_{H-Cl}}}\\\
&=\mathrm{-2(432)=-185\:kJ}
\end {align*}\]
Denne overskydende energi frigives som varme, så reaktionen er eksoterm. Tabel T2 giver en værdi for standardmolær enthalpi for dannelse af HCl(g), \(ΔH^\circ_\ce f\ce f\), på -92,307 kJ/mol. Det dobbelte af denne værdi er -184,6 kJ, hvilket stemmer godt overens med det svar, der tidligere er opnået for dannelsen af to mol HCl.
Eksempel \(\PageIndex{1}\): Brug af bindingsenergier til at tilnærme enthalpijændringer
Methanol, CH3OH, kan være et glimrende alternativt brændstof. Ved reaktion af damp og kulstof ved høj temperatur opstår der en blanding af gasserne carbonmonoxid, CO, og hydrogen, H2, hvoraf methanol kan fremstilles. Ved hjælp af bindingsenergierne i tabel \(\PageIndex{2}\) beregnes den omtrentlige enthalpiforandring, ΔH, for reaktionen her:
\
Løsning
Først skal vi skrive Lewis-strukturerne for reaktanterne og produkterne:
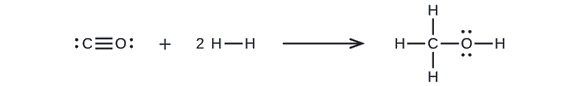
Deraf kan vi se, at ΔH for denne reaktion omfatter den energi, der kræves for at bryde en C-O trippelbinding og to H-H enkeltbindinger, samt den energi, der produceres ved dannelsen af tre C-H enkeltbindinger, en C-O enkeltbinding og en O-H enkeltbinding. Vi kan udtrykke dette på følgende måde (via ligning \ref{EQ3}):
\-}
\end {align*}\]
Hvis vi anvender bindingsenergiværdierne i tabel \(\PageIndex{2}\), får vi:
&=\ce{-107\:kJ}
\end {align*}\]
Vi kan sammenligne denne værdi med den værdi, der er beregnet på grundlag af \(ΔH^\circ_\ce f\ce) data fra bilag G:
&=-\\\\
&=\mathrm{-90.5\:kJ}
\end {align*}\]
Bemærk, at der er en ret betydelig forskel mellem de værdier, der er beregnet ved hjælp af de to forskellige metoder. Dette skyldes, at D-værdierne er gennemsnittet af forskellige bindingsstyrker; derfor giver de ofte kun en grov overensstemmelse med andre data.
Øvelse \(\PageIndex{1}\)
Ethylalkohol, CH3CH2OH, var et af de første organiske kemikalier, der bevidst blev syntetiseret af mennesker. Det har mange anvendelsesmuligheder i industrien, og det er den alkohol, der er indeholdt i alkoholiske drikkevarer. Den kan fremstilles ved gæring af sukker eller syntetiseres ved hydrering af ethylen i følgende reaktion:

Beregn ved hjælp af bindingsenergierne i tabel \(\PageIndex{2}\) en tilnærmet enthalpiforandring, ΔH, for denne reaktion.
Summary
Video \(\PageIndex{2}\): En gennemgang af atomare bindinger.
Kovalente bindinger dannes, når elektroner deles mellem atomer og tiltrækkes af begge atomers kerner. I rene kovalente bindinger er elektronerne delt ligeligt. I polære kovalente bindinger deles elektronerne ulige, da det ene atom udøver en stærkere tiltrækningskraft på elektronerne end det andet.
Styrken af en kovalent binding måles ved dens bindingsdissociationsenergi, dvs. den energimængde, der kræves for at bryde den pågældende binding i et mol molekyler. Flere bindinger er stærkere end enkeltbindinger mellem de samme atomer. En reaktionens enthalpi kan estimeres ud fra den energi, der skal tilføres for at bryde bindinger, og den energi, der frigives, når der dannes nye bindinger.
Nøgleligninger
- Bindelingsenergi for et toatomigt molekyle: \(\ce{XY}(g)⟶\ce{X}(g)+\ce{Y}(g)\hspace{20px}\ce{D_{X–Y}}=ΔH°\)
- Enthalpy change: ΔH = ƩDbindinger brudt – ƩDbindinger dannet
Fodnoter
- Dette spørgsmål er taget fra Chemistry Advanced Placement Examination og er brugt med tilladelse fra Educational Testing Service.
Glossar
bindingsenergi (også, bindingsdissociationsenergi) energi, der kræves for at bryde en kovalent binding i et gasformigt stof
Medarbejdere
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) og Richard Langley (Stephen F. Austin State University) med medvirkende forfattere. Lærebogsindhold produceret af OpenStax College er licenseret under en Creative Commons Attribution License 4.0-licens. Download gratis på http://cnx.org/contents/85abf193-2bd…[email protected]).
- Adelaide Clark, Oregon Institute of Technology
- Fuse School, Open Educational Resource free of charge, under en Creative Commons-licens: Attribution-NonCommercial CC BY-NC (Se licensdokumentet: https://creativecommons.org/licenses/by-nc/4.0/)
- Crash Course Chemistry: Crash Course: Crash Course er en afdeling af Complexly and videos are free to stream for educational purposes.
Feedback
Har du feedback at give om denne tekst? Klik her.
Fandt du en slåfejl og vil have ekstra point? Klik her.