Brintbinding Definition
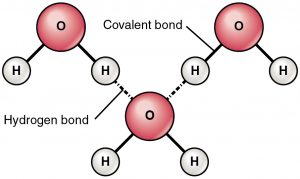
Brintbinding er en tiltrækningskraft mellem et delvist positivt ladet brint og et delvist negativt ladet atom (ilt og kvælstof). Dette er en meget svag binding, og styrken af hydrogenbindingen (5-10 Kcal pr. binding) er meget mindre end styrken af kovalente bindinger. Brintbindinger er normalt vist som stiplede linjer mellem to atomer. For eksempel er hydrogenbindingen mellem to vandmolekyler vist nedenfor:
Grund for hydrogenbinding
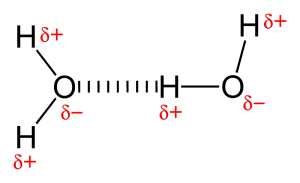
På grund af tilstedeværelsen af et meget elektronegativt atom som ilt eller nitrogen, trækkes det fælles elektronpar mellem ilt og brint mod det mere elektronegative atom. Denne ulige fordeling af elektronpar fører til dannelsen af to partielle dipoler. Det delvist positivt ladede hydrogen tiltrækkes derefter af det andet delvist negativt ladede oxygen eller nitrogen er kendt som hydrogenbinding.
Typer af hydrogenbinding
Hydrogenbinding kan forekomme mellem to atomer i samme molekyle eller mellem to atomer i forskellige molekyler. Afhængigt af det er der to typer hydrogenbindinger:
- Intermolekylær hydrogenbinding
- Intramolekylær hydrogenbinding
Intermolekylær hydrogenbinding
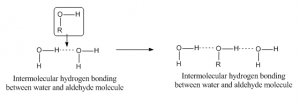
Når hydrogenbinding opstår mellem to atomer i forskellige molekyler, kaldes det intermolekylær hydrogenbinding. For at opnå en sådan binding skal et molekyle have et delvist positivt hydrogenatom som acceptoratom, og et andet molekyle skal have et delvist negativt eller donoratom. Som eksempel er hydrogenbinding mellem aldehyd- og vandmolekylet angivet nedenfor:
2. Intramolekylær hydrogenbinding
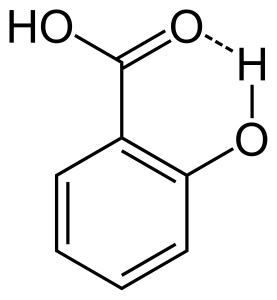
Når hydrogenbinding opstår mellem to delvist ladede atomer i samme molekyle, kaldes det intramolekylær hydrogenbinding. Dette sker, når to funktionelle grupper er til stede i samme molekyle, og de er på en sådan måde, at de kan tiltrække hinanden og danne hydrogenbindinger. F.eks. har salicylsyre to funktionelle grupper, alkohol og carboxylsyre. Her opstår der intramolekylær hydrogenbinding mellem alkoholgruppens hydrogenatom og carboxylsyregruppens oxygenatom.
Virkninger af hydrogenbinding
På kogepunktet
Det forventes, at kogepunktet for stoffer med samme eller lignende molekylvægt bør have samme eller lignende kogepunkt. Kogepunktet for ether og alkan med samme molekylvægt er ikke langt fra hinanden. Men kogepunktet for alkoholer er meget højere end for ether med samme molekylvægt. Dette kan forklares ved hjælp af hydrogenbindinger. På grund af hydrogenbindinger i alkohol stiger kogepunktet. Der skal ekstra energi til at bryde brintbindingen, før alkoholen koger. Da der ikke er nogen hydrogenbindinger, har alkan og ether et lavt kogepunkt.

Om opløselighed
Alkoholer er opløselige i vand, men det er alkaner ikke. Dette skyldes, at intermolekylære hydrogenbundne forbindelser kan opløses i intermolekylære hydrogenbundne opløsningsmidler. Et polært molekyle som alkohol kan indgå i to vandmolekyler for at danne hydrogenbindinger, mens et ikke-polært stof som alkaner ikke kan det. Men med stigningen i kulstofkæden i alkoholer falder opløseligheden, da den lange kæde kommer i vejen for dannelsen af hydrogenbindinger.
Summarum
- Væstofbinding er en tiltrækningskraft mellem et delvist positivt ladet hydrogen og et delvist negativt ladet atom.
- Når hydrogenbinding opstår mellem til atomer i forskellige molekyler, kaldes det intermolekylær hydrogenbinding.
- Når hydrogenbinding opstår mellem to delvist ladede atomer i samme molekyle, kaldes det intramolekylær hydrogenbinding.
- På grund af intermolekylær hydrogenbinding er kogepunktet for polære forbindelser højere end for ikke-polære forbindelser med samme a.
- På grund af hydrogenbinding mellem organisk forbindelse og vand er opløseligheden mulig i et vist omfang.