Hovedredaktør: C. Michael Gibson, M.S., M.D. ; Medansvarlig(e) medredaktør(er): C. Michael Gibson, M.S., M.D. ; Medansvarlig(e) medredaktør(er): Aparna Vuppala, M.B.B.S.
Disclaimer
WikiDoc GIVER INGEN GARANTI FOR GYLDIGHED. WikiDoc er ikke en professionel sundhedsplejerske og er heller ikke en egnet erstatning for en autoriseret sundhedsplejerske. WikiDoc er beregnet til at være et uddannelsesværktøj og ikke et redskab til nogen form for levering af sundhedsydelser. Det pædagogiske indhold på WikiDocs lægemiddelsider er baseret på FDA’s indlægsseddel, National Library of Medicine-indhold og retningslinjer for praksis/konsensusudtalelser. WikiDoc fremmer ikke indgivelse af medicin eller udstyr, som ikke er i overensstemmelse med etiketten. Læs venligst vores fulde ansvarsfraskrivelse her.
Overblik
Butalbital er en kombination, der er FDA-godkendt til behandling af til lindring af symptomkomplekset spændingshovedpine (eller muskelkontraktion). Almindelige bivirkninger omfatter svimmelhed og gastrointestinale forstyrrelser, herunder kvalme, opkastninger og flatulens, toksisk epidermal nekrolyse og erythema multiforme.
Voksne indikationer og dosering
FDA-mærkede indikationer og dosering (voksne)
Hovedpine
- Butalbital, aspirin og koffeintabletter er indiceret til lindring af symptomkomplekset af spændingshovedpine (eller muskelkontraktion).
- Der foreligger ikke dokumentation, der understøtter effekten og sikkerheden af butalbital, aspirin og koffein til behandling af multiple tilbagevendende hovedpine. Forsigtighed i denne henseende er påkrævet, da butalbital er vanedannende og potentielt kan misbruges.
Anvendelse uden for etiketten og dosering (voksne)
Guideline-støttet anvendelse
Der er begrænsede oplysninger om off-label guideline-støttet anvendelse af butalbital hos voksne patienter.
Ikke-vejledningsstøttet brug
Der er begrænsede oplysninger om off-label ikke-vejledningsstøttet brug af Butalbital hos voksne patienter.
Pædiatriske indikationer og dosering
FDA-mærkede indikationer og dosering (pædiatrisk)
Der er begrænsede oplysninger om FDA-mærket brug af Butalbital hos pædiatriske patienter.
Ikke-mærket brug og dosering (pædiatrisk)
Vejledningsstøttet brug
Der er begrænsede oplysninger om ikke-mærket vejledningsstøttet brug af Butalbital hos pædiatriske patienter.
Ikke-vejledningsstøttet brug
Der er begrænset information vedrørende Off-Label Ikke-vejledningsstøttet brug af Butalbital hos pædiatriske patienter.
Kontraindikationer
- Overfølsomhed over for aspirin, koffein eller barbiturater. Patienter med porfyri.
Advarsler
Medicinafhængighed:
- Langvarig brug af barbiturater kan medføre medicinafhængighed, karakteriseret ved psykisk afhængighed og sjældnere fysisk afhængighed og tolerance. Misbrugsansvaret for butalbital, aspirin og koffein svarer til misbrugsansvaret for andre barbituratholdige lægemiddelkombinationer. Der bør udvises forsigtighed ved ordination af medicin til patienter med en kendt tilbøjelighed til at tage for store mængder medicin, hvilket ikke er ualmindeligt hos patienter med kronisk spændingshovedpine.
Anvendelse hos ambulante patienter:
- Butalbital, aspirin og koffein kan nedsætte de mentale og/eller fysiske evner, der er nødvendige for udførelsen af potentielt farlige opgaver, som f.eks. at køre bil eller betjene maskiner. Patienten skal advares i overensstemmelse hermed. Centralnervesystemdepressive virkninger af butalbital kan være additive med virkningerne af andre CNS-depressive midler. Samtidig brug sammen med andre sedativ-hypnotika eller alkohol bør undgås. Når en sådan kombineret behandling er nødvendig, kan det være nødvendigt at reducere dosis af et eller flere midler.
Forsigtighedsregler
- Salicylater bør anvendes med stor forsigtighed i tilfælde af peptisk ulcus eller koagulationsanomalier.
Bivirkninger
Erfaringer fra kliniske forsøg
- De hyppigste bivirkninger er døsighed og svimmelhed. Mindre hyppige bivirkninger er svimmelhed og gastrointestinale forstyrrelser, herunder kvalme, opkastninger og flatulens. En enkelt forekomst af knoglemarvsundertrykkelse er blevet rapporteret ved brug af butalbital, aspirin og koffein. Der er rapporteret flere tilfælde af dermatologiske reaktioner, herunder toksisk epidermal nekrolyse og erythema multiforme.
Erfaring efter markedsføring
Der er begrænset information vedrørende erfaring efter markedsføring af butalbital i lægemidlets etiket.
Lægemiddelinteraktioner
Der er begrænset information vedrørende Butalbital lægemiddelinteraktioner i lægemiddelsetiketten.
Anvendelse hos specifikke befolkningsgrupper
Graviditet
Graviditetskategori (FDA): C
- Der er ikke udført tilstrækkelige undersøgelser på dyr til at afgøre, om dette lægemiddel påvirker fertiliteten hos hanner eller hunner, har teratogent potentiale eller har andre skadelige virkninger på fosteret. Der findes ingen velkontrollerede undersøgelser hos gravide kvinder, men over tyve års markedsføring og klinisk erfaring omfatter ingen positive beviser for skadelige virkninger på fosteret. Selv om der ikke er nogen klart defineret risiko, kan sådanne erfaringer ikke udelukke muligheden af sjældne eller subtile skader på det menneskelige foster. Butalbital, aspirin og koffein bør kun anvendes til gravide kvinder, når det er klart nødvendigt.
Graviditetskategori (AUS): Der findes ingen vejledning fra Australian Drug Evaluation Committee (ADEC) om brug af butalbital til gravide kvinder.
Arbejde og fødsel
Der findes ingen FDA-vejledning om brug af butalbital under fødsel og fødsel.
Af ammende mødre
- Virkningerne af butalbital, aspirin og koffein på spædbørn af ammende mødre er ikke kendt. Salicylater og barbiturater udskilles i modermælken hos ammende mødre. Serumniveauerne hos spædbørn menes at være ubetydelige ved terapeutiske doser.
Pædiatrisk brug
- Sikkerheden og effektiviteten hos pædiatriske patienter under 12 år er ikke blevet fastslået.
Geriatrisk brug
Der findes ingen FDA-vejledning om brugen af Butalbital med hensyn til geriatriske patienter.
Køn
Der findes ingen FDA-vejledning om brugen af Butalbital med hensyn til specifikke kønspopulationer.
Race
Der findes ingen FDA-vejledning om brugen af Butalbital med hensyn til specifikke racepopulationer.
Renal Impairment
Der findes ingen FDA-vejledning om brugen af Butalbital hos patienter med nedsat nyrefunktion.
Hepatisk svækkelse
Der findes ingen FDA-vejledning om brugen af Butalbital hos patienter med nedsat leverfunktion.
Kvinder med reproduktiv potentiale og mænd
Der findes ingen FDA-vejledning om brugen af Butalbital hos kvinder med reproduktiv potentiale og mænd.
Immunokompromitterede patienter
Der findes ingen FDA-vejledning om brugen af Butalbital hos patienter, der er immunsupprimerede.
Administration og overvågning
Administration
- Oral
Overvågning
Der er begrænset information vedrørende Overvågning af Butalbital i lægemidlets etiket.
IV-kompatibilitet
Der er begrænset information vedrørende IV-kompatibilitet af butalbital i lægemidlets etiket.
Overdosering
- De toksiske virkninger af akut overdosering af butalbital, aspirin og koffein kan hovedsageligt tilskrives dets barbituratkomponent og i mindre grad aspirin. Da de toksiske virkninger af koffein kun forekommer i meget høje doser, er det usandsynligt, at der er mulighed for betydelig koffein-toksicitet ved overdosering af butalbital, aspirin og koffein. Symptomer, der kan tilskrives akut barbituratforgiftning, omfatter døsighed, forvirring og koma, respirationsdepression, hypotension og chok. Symptomer, der kan tilskrives akut aspirinforgiftning, omfatter hyperpnø; syre-baseforstyrrelser med udvikling af metabolisk acidose; opkastning og mavesmerter; tinnitus; hypertermi; hypoprothrombinæmi; rastløshed; delirium; konvulsioner. Akut koffeinforgiftning kan forårsage søvnløshed, rastløshed, rysten og delirium; takykardi og ekstrasystoler. Behandlingen består primært i håndtering af barbituratforgiftning og korrektion af syre-base ubalancen som følge af salicylisme. Opkastning bør fremkaldes mekanisk eller med brækmidler hos den bevidste patient. Gastrisk skylning kan anvendes, hvis de pharyngeale og laryngeale reflekser er til stede, og hvis der er gået mindre end 4 timer siden indtagelsen. Der bør indsættes en endotracheal tube med manchet før gastrisk lavage af den bevidstløse patient, og når det er nødvendigt for at sikre assisteret respiration. Diurese, alkalinisering af urinen og korrektion af elektrolytforstyrrelser bør opnås ved administration af intravenøse væsker som f.eks. 1% natriumbicarbonat i 5% dextrose i vand. Man skal være omhyggelig med at opretholde en tilstrækkelig lungevation. Korrektion af hypotension kan kræve indgivelse af levartherenolbitartrat eller phenylephrinhydrochlorid ved intravenøs infusion . I alvorlige tilfælde af forgiftning kan peritonealdialyse, hæmodialyse eller udskiftningstransfusion være livreddende. Hypoprothrombinæmi bør behandles med K-vitamin, intravenøst.
Der er begrænset information om kronisk overdosering af Butalbital i lægemidlets etiket.
Farmakologi
Der er begrænset information om Butalbital Farmakologi i lægemidlets etiket.
Virkningsmekanisme
- Farmakologisk set kombinerer butalbital, aspirin og koffein de smertestillende egenskaber fra aspirin med de anxiolytiske og muskelafslappende egenskaber fra butalbital.
Den kliniske effektivitet af butalbital, aspirin og koffein ved spændingshovedpine er blevet fastslået i dobbeltblindede, placebokontrollerede, kliniske forsøg på flere klinikker. I en undersøgelse med faktorielt design blev butalbital, aspirin og koffein sammenlignet med hver af deres hovedkomponenter. Denne undersøgelse viste, at hver enkelt komponent bidrager til effekten af butalbital, aspirin og koffein i behandlingen af målsymptomerne ved spændingshovedpine (hovedpine-smerter, psykiske spændinger og muskelkontraktioner i hoved-, nakke- og skulderregionen). For hvert symptom og symptomkomplekset som helhed viste det sig, at butalbital, aspirin og koffein havde signifikant bedre kliniske virkninger end en af komponenterne alene.
Struktur
- De enkelte komponenters opførsel er beskrevet nedenfor.
- Den systemiske tilgængelighed af aspirin efter en oral dosis er stærkt afhængig af doseringsformen, tilstedeværelsen af mad, den gastriske tømningstid, gastrisk pH, antacida, buffermidler og partikelstørrelse. Disse faktorer påvirker ikke nødvendigvis omfanget af absorptionen af de samlede salicylater, men mere aspirins stabilitet før absorptionen.
- Under absorptionsprocessen og efter absorptionen hydrolyseres aspirin hovedsageligt til salicylsyre og distribueres til alle kropsvæv og -væsker, herunder fostervæv, modermælk og centralnervesystemet (CNS). De højeste koncentrationer findes i plasma, lever, nyrebark, hjerte og lunge. I plasma er ca. 50-80 % af salicylsyren og dens metabolitter løst bundet til plasmaproteiner.
- Clearance af totale salicylater er underlagt en mættelig kinetik; første ordens elimineringskinetik er dog stadig en god tilnærmelse for doser op til 650 mg. Plasmahalveringstiden for aspirin er ca. 12 minutter og for salicylsyre og/eller totale salicylater er ca. 3,0 timer.
- Elimineringen af terapeutiske doser sker gennem nyrerne enten som salicylsyre eller andre biotransformationsprodukter. Den renale clearance øges kraftigt af en alkalisk urin, som produceres ved samtidig indgift af natriumbicarbonat eller kaliumcitrat.
- Biotransformationen af aspirin sker primært i hepatocytterne. De vigtigste metabolitter er salicylurinsyre (75 %), phenol- og acylglucuroniderne af salicylat (15 %) og gentisyre- og gentisurinsyre (1 %). Biotilgængeligheden af aspirinkomponenten butalbital, aspirin og koffein svarer til den af en opløsning bortset fra en langsommere absorptionshastighed. En spidskoncentration på 8,80 mcg/mL blev opnået 40 minutter efter en dosis på 650 mg.
- Butalbital absorberes godt fra mave-tarmkanalen og forventes at distribuere sig til de fleste væv i kroppen. Barbiturater kan generelt forekomme i modermælk og passerer let placentabarrieren. De er bundet til plasma- og vævsproteiner i varierende grad, og bindingen øges direkte som en funktion af lipidopløseligheden.
- Eliminering af butalbital sker primært via nyrerne (59 %-88 % af dosis) som uændret lægemiddel eller metabolitter. Plasmahalveringstiden er ca. 35 timer. Urinudskillelsesprodukterne omfattede moderlægemiddel (ca. 3,6 % af dosis), 5-isobutyl-5-(2,3-dihydroxypropyl)-barbitursyre (ca. 24 % af dosis), 5-allyl-5-(3-hydroxy-2-methyl-1-propyl)-barbitursyre (ca. 4,8 % af dosis), produkter med barbitursyreringen hydrolyseret med udskillelse af urea (ca. 14 % af dosis) samt uidentificerede materialer. Af det materiale, der blev udskilt i urinen, var 32 % konjugeret.
- Biotilgængeligheden af butalbitalkomponenten af butalbital, aspirin og koffein svarer til den af en opløsning bortset fra et fald i absorptionshastigheden. En spidskoncentration på 2020 ng/mL opnås ca. 1,5 time efter en 100 mg-dosis.
- Den in vitro plasmaproteinbinding af butalbital er 45 % over koncentrationsområdet fra 0,5 til 20 mcg/mL. Dette falder inden for det område af plasmaproteinbinding (20 % til 45 %), der er rapporteret med andre barbiturater, såsom phenobarbital, pentobarbital og sekobarbitalnatrium. Forholdet mellem plasma- og blodkoncentrationen var næsten ens, hvilket indikerer, at der ikke er nogen præferentiel fordeling af butalbital i hverken plasma eller blodceller. (se OVERDOSERING for oplysninger om toksicitet).
- Som de fleste xantiner optages og distribueres koffein hurtigt i alle kropsvæv og -væsker, herunder CNS, fostervæv og modermælk.
- Koffein udledes hurtigt gennem metabolisme og udskillelse i urinen. Plasmahalveringstiden er ca. 3,0 timer. Hepatisk biotransformation forud for udskillelse resulterer i ca. lige store mængder 1-methyl-xanthin og 1-methylurinsyre. Af de 70 % af den dosis, der er blevet genfundet i urinen, var kun 3 % uændret lægemiddel.
- Biotilgængeligheden af koffeinkomponenten for butalbital, aspirin og koffein svarer til den for en opløsning, bortset fra en lidt længere tid til peak. En peakkoncentration på 1660 ng/mL blev opnået på mindre end en time for en 80 mg-dosis
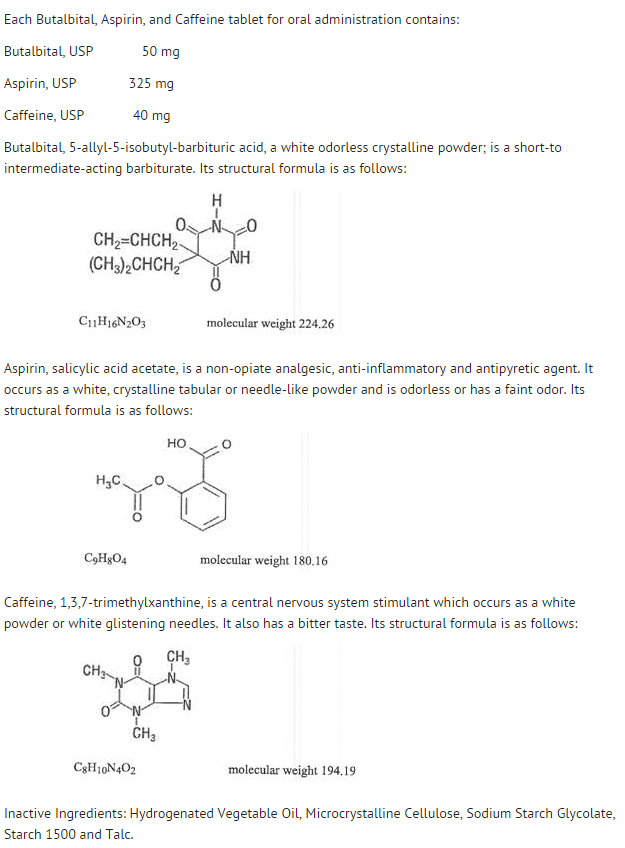
- Butalbital-, aspirin- og koffeintabletter, USP 50 mg/325 mg/40 mg er hvide, runde, uindskårne, komprimerede tabletter med påtrykt “West-ward 785”.
- Lagres ved 20-25oC (68-77oF) . Beskyttes mod lys og fugt.
- Dispensér i tæt, lysbestandig beholder som defineret i USP ved hjælp af en børnesikret lukning.
- Interaktion mellem alkohol og Butalbital er ikke blevet etableret. Tal med din læge om virkningerne af indtagelse af alkohol sammen med denne medicin.
Farmakodynamik
Der er begrænset information om Farmakodynamik for Butalbital i lægemidlets etiket.
Farmakokinetik
Aspirin:
Butalbital:
Koffein:
Nonklinisk toksikologi
Der er begrænset information vedrørende ikke-klinisk toksikologi for Butalbital i lægemidlets etiket.
Kliniske undersøgelser
Der er begrænset information vedrørende kliniske undersøgelser af Butalbital i lægemidlets etiket.
Hvordan leveres
Flasker med 30 tabletterFlasker med 50 tabletterFlasker med 100 tabletterFlasker med 500 tabletterFlasker med 1000 tabletterEnhedsdosis Æsker med 100 tabletter
Lagring
Der er begrænset information om opbevaring af butalbital i lægemiddelmærket.
Billeder
Lægemiddelbilleder
Lægemiddelnavn: Butalbital, acetaminophen og koffein
Ingrediens(er): Butalbital, acetaminophen og koffein
Ingrediens(er): BUTALBITAL, ACETAMINOPHEN, KAFFEIN
Indhold: BUTALBITAL, ACETAMINOPHEN, KAFFEIN
Imprint: West;ward;787
Dosering: West;ward;787
Dosering: 50 mg
Farve(r): Blå
Form: Blå
Form: Rund
Størrelse (mm): 11
Score: 1
NDC:01431787
Lægemiddelmærke Forfatter:
Dette pillebillede er leveret af National Library of Medicine’s PillBox.

Lægemiddelnavn: West-Ward Pharmaceutical Corp
Butalbital, Aspirin og koffein
Ingrediens(er): Butalbital, Aspirin og Koffein
Ingrediens(er): BUTALBITAL, ASPIRIN, KAFFEIN
Indholdsstofferne: BUTALBITAL, ASPIRIN, KAFFEIN
Imprint: Westward;785
Dosering: 50 mg
Farve(r): Hvid
Form: Hvid
Form: Rund
Størrelse (mm): 11
Score: 1
NDC:01431785
Lægemiddelmærke Forfatter: West-ward Pharmaceutical Corp
Dette pillebillede er leveret af National Library of Medicine’s PillBox.

Medicinsk navn:
Medicinsk navn: West-ward Pharmaceutical Corp
Butalbital, Aspirin og koffein
Ingrediens(er): Butalbital, Aspirin og Koffein
Ingrediens(er): BUTALBITAL, ASPIRIN, KAFFEIN
Indholdsstofferne: BUTALBITAL, ASPIRIN, KAFFEIN
Indtryk: WATSON;3219
Dosage: 50 mg
Farve(r): Grøn, Gul
Form: Grøn, Gul
Form: Kapsel
Størrelse (mm): 22
Score: 1
NDC:05913219
Lægemiddelmærke Forfatter: Watson Laboratories, Inc.
Dette pillebillede er leveret af National Library of Medicine’s PillBox.
Medicinsk navn:
Medicinsk navn: Butalbital, aspirin og koffein tabletter
Ingrediens(er): Butalbital, Aspirin og koffein tabletter
Ingrediens(er): ASPIRIN, BUTALBITAL, KAFFEIN
Indhold: ASPIRIN, BUTALBITAL, KAFFEIN
Imprint: West;ward;785
Dosering: 50 mg
Farve(r): Hvid
Form: Hvid
Form: Rund
Størrelse (mm): 7
Score: 1
NDC:06032548
Lægemiddelmærke Forfatter: Qualitest
Dette billede af en pille er leveret af National Library of Medicine’s PillBox.
Package and Label Display Panel
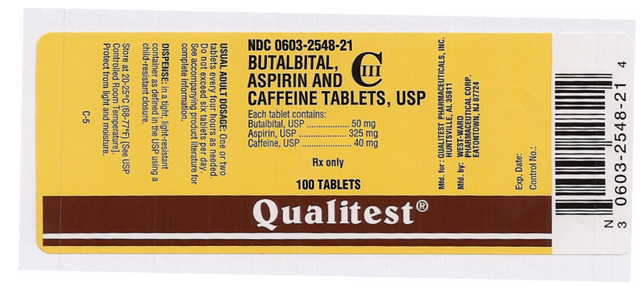
Dette billede af FDA-etiketten er leveret af National Library of Medicine.

Dette billede af FDA-etiketten er leveret af National Library of Medicine.
Patientrådgivningsinformation
Der er begrænset information vedrørende Patientrådgivningsinformation for Butalbital i lægemidlets etiket.
Forsigtighedsregler med alkohol
Mærkenavne
Der er begrænset information vedrørende Butalbital-mærkenavne i lægemiddelsetiketten.
Look-Alike Drug Names
Der er begrænset information vedrørende Butalbital Look-Alike Drug Names i lægemiddelsetiketten.