Chronic Traumatic Encephalopathy (CTE) er en karakteristisk tau-protein-associeret neurodegenerativ sygdom. Der har været en stigning i antallet af CTE-diagnoser hos atleter, især amerikanske fodboldspillere, samt hos militærveteraner i kampsituationer (1, 2). Selv om CTE først er blevet offentligt anerkendt for relativt nylig, blev den først beskrevet som “punch drunk”-syndromet i en klassisk artikel af Martland et al. (3). Rapporten fokuserede på en række boksere, som havde fået gentagne slag mod hovedet i løbet af deres karriere, og som viste både psykiatriske symptomer og alvorlige hukommelses- og neurokognitive underskud, svarende til typiske demenspatienter (3). Sygdomsnomenklaturen udviklede sig til “dementia pugilistica” (4) og endelig CTE i 1949 (5).
CTE har et unikt neuropatologisk kendetegn, der består af ophobning af fosforyleret tau (p-tau) i sulci og peri-vaskulære regioner, mikrogliose og astrocytose. Disse patologiske ændringer fører til progressiv invaliderende neurodegeneration. På grundlag af mønstret for den patologiske progression inddeles CTE i fire respektive stadier (figur 1). I CTE-stadium I ser hjernen groft sagt normal ud, men p-tau findes i et begrænset antal loci, ofte i den laterale og frontale cortex samt i nærheden af små blodkar i dybden af sulci. Der kan være et lille antal neurofibrillære tangles (NFT’er) og neuritter i locus coeruleus. I stadium II kan der konstateres lokaliserede makroskopiske abnormiteter. På grovanatomiske snit og neuroimaging ses en udvidelse af de laterale ventrikler, cavum septum pellucidum pellucidum med eller uden fenestration samt bleghed i locus coeruleus og substantia nigra. Der er flere p-tau-focer i dybden af sulci, og der er et begyndende spredningsmønster. I stadie III viser de fleste bruttopatologiske sektioner makroskopiske abnormiteter. Der er et globalt vægttab i hjernen, let atrofi af frontallappen og temporallappen samt udvidelse af ventriklerne. Halvdelen af CTE-patienterne har septum abnormiteter, herunder cavum septum pellucidum. P-tau-patologien breder sig og omfatter de frontale, temporale, parietale og insulære cortexe. I stadie IV er reduktionen i hjernevægten dramatisk, og der er rapporteret om hjernevægte på 1 000 g (sammenlignet med 1 300-1 400 g i normale hjerner). Der er dybtgående atrofi af de frontale og mediale tidslapper samt af den forreste thalami. Der er også atrofi af de hvide stofbaner. Størstedelen af patienter i stadie fire har septale abnormiteter. Udbredelsen af p-tau påvirker de fleste regioner, herunder den calcarine cortex (7, 8). Abnormiteter i fosforyleret 43 kDa TAR DNA-bindingsprotein (TDP-43) ses også hos de fleste CTE-patienter. Den parenkymale TDP-43-patologi er også progressiv i sin natur i lighed med det anatomiske spredningsmønster for p-tau. TDP-43 immunoreaktivitet findes i næsten alle tilfælde af sygdomsstadium IV (7).

Figur 1. Ovenstående billeder er en skildring af McKee’s fire stadier af CTE .
Den kliniske fænotype af CTE er endnu ikke klart defineret. I de følgende afsnit skitseres forsøg på karakterisering af CTE-symptomer i de forskellige stadier af sygdomsprocessen (tabel 1). I henhold til McKees klassifikation er en typisk CTE-patient i stadium I asymptomatisk eller kan klage over milde korttidshukommelsesunderskud og depressive symptomer. Der kan observeres mild aggression. I stadium II kan humør- og adfærdssymptomerne omfatte adfærdsudbrud og mere alvorlige depressive symptomer. I fase III viser patienterne sig typisk med flere kognitive underskud, herunder hukommelsestab, underskud i den udøvende funktion, visuospatial dysfunktion og apati. I stadie IV præsenterer patienterne sig med avancerede sproglige underskud, psykotiske symptomer, herunder paranoia, motoriske underskud og parkinsonisme.
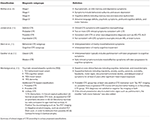
Tabel 1. CTE foreslåede kliniske klassifikationer.
Jordan et al. (10) var en af de første til at karakterisere sygdommen klinisk. De inddelte CTE-kliniske præsentationer i tre domæner: adfærdsmæssige/psykiatriske, kognitive og motoriske. Det adfærdsmæssige og psykiatriske domæne omfattede aggression, depression, apati, impulsivitet, vrangforestillinger, herunder paranoia, og selvmordstanker. Det kognitive område omfattede nedsat opmærksomhed og koncentration, hukommelsesunderskud, underskud i den udøvende funktion, visuospatial dysfunktion, sproglige underskud og demens. Endelig bestod de motoriske træk af dysartri, gangforstyrrelser, ataksi og inkoordinering, spasticitet og parkinsonistiske træk som f.eks. rysten. På grundlag af disse kliniske træk samt eksisterende neuropatologiske oplysninger blev der defineret fire diagnostiske undertyper, nemlig “sikker”, “sandsynlig”, “mulig” og “usandsynlig” CTE.
Stern et al. (11) og relaterede caserapporter (14, 15) var forskellige i deres beskrivelse af en typisk CTE-patient, idet de konceptualiserede den kliniske præsentation i to forskellige undertyper. Den første undertype udviste hovedsagelig adfærds- og humørændringer, og den anden præsenterede hovedsagelig kognitiv svækkelse. Langt størstedelen af subtypen med humør/adfærd udviklede kognitive underskud, efterhånden som sygdommen skred frem. Der var imidlertid relativt få patienter i den kognitive gruppe, der viste humør- eller adfærdsændringer i løbet af deres sygdomsforløb. I undersøgelsen af Stern et al. (11) havde patienterne i den kognitive gruppe en signifikant højere sandsynlighed for at udvikle demens. De var også betydeligt ældre på diagnosetidspunktet sammenlignet med patienterne i humør/adfærdsgruppen. Den adfærdsmæssige undergruppe af CTE-patienter kan ligne patienter, der lider af adfærdsmæssig variant af frontotemporal demens (bvFTD), hvilket gør den kliniske diagnose mere udfordrende. Typiske bvFTD-karakteristiske adfærdsmanifestationer såsom apati og hæmningsløshed ses dog ofte ikke hos CTE-patienter (11, 16). I betragtning af bvFTD’s iboende heterogenitet samt den lignende tauopatiske karakter af begge sygdomme udgør det en diagnostisk udfordring at skelne bvFTD og CTE.
Ud af de adfærdsmæssige symptomer på CTE er forbindelsen mellem selvmord og CTE fortsat et emne, der undersøges i litteraturen. Tidligere undersøgelser, såsom den serie af fem professionelle atleter med en bekræftet diagnose af CTE rapporteret af Omalu et al. (17), havde antydet en stærk sammenhæng mellem CTE og selvmord. Forfatterne foreslog endvidere, at ætiologien for selvmords-/parasuicidal adfærd i CTE-populationen delvis kunne skyldes tauopati i form af neurofibrillære tangles og neuritiske tråde i strategiske limbiske hjernekerner såsom locus ceruleus. Maroon et al. (18) gennemgik 153 patologisk bekræftede tilfælde af CTE, der blev offentliggjort mellem 1954 og 2013. De rapporterede, at selvmordsprævalensen i CTE-populationen og utilsigtede dødsfald var 11,7 % og 17,5 %, hvilket var betydeligt højere end niveauet i den generelle befolkning på henholdsvis 1,5 % og 4,8 % (18). Fortalere for det modsatte synspunkt anfører, at selvmord for det meste er blevet rapporteret i tidligere stadier af CTE, og at sammenhængen mellem sygdomsudvikling og selvmord fortsat er uklar på nuværende tidspunkt (19).
I en metaanalyse af 158 casestudier foretaget af Gardner et al. (12) blev de kliniske CTE-symptomer opdelt i “klassiske” vs. “moderne” CTE-symptomer for at skelne mellem en ældre beskrivelse af CTE-tilfælde centreret mest på boksere sammenlignet med en mere udviklet klinisk beskrivelse, som også gælder for professionelle amerikanske fodboldspillere. Mens de “klassiske” CTE-symptomer typisk omfattede dysartri, bevægelsesvanskeligheder og senere udvikling til hukommelsesproblemer, omfattede det “moderne” CTE-billede også neuropsykiatriske symptomer som f.eks. depressive symptomer, paranoia, social tilbagetrækning og isolation, nedsat dømmekraft og aggressivitet. Kognitive mangler som f.eks. hukommelsestab, eksekutiv dysfunktion, sprog og informationsbehandlingsunderskud opstår senere i sygdomsforløbet (12).
Da definitionen af CTE primært afhænger af patologiske karakteristika, er der foreslået en alternativ klinisk betegnelse traumatisk encephalopati syndrom (TES) af Montenigro et al. (13), som beskriver de kliniske følger af gentagne TBI’er. Forfatterne baserede denne klassifikation på en gennemgang af 202 offentliggjorte tilfælde. TES er en mere omfattende diagnose og kan underopdeles i fire underkategorier, herunder TES adfærds-/stemningsvariant, TES kognitiv variant, TES blandet variant og TES demens. Den foreslåede TES-diagnose var baseret på fem generelle kriterier, tre centrale kliniske træk og ni understøttende træk. Ved hjælp af eksisterende biomarkører* (tabel 1) blev der foreslået yderligere diagnostiske kvalifikationskategorier, som omfattede “sandsynlig”, “mulig” og “usandsynlig” CTE (9, 13). Den foreslåede TES-diagnose indeholdt også tidsmæssige kvalifikationskategorier og omfattede “progressivt forløb”, “stabilt forløb” og “ukendt/inkonsistent forløb”. Hvis den kliniske præsentation også omfattede motoriske tegn såsom parkinsonisme, blev modifikatoren “med motoriske træk” også tilføjet.
I takt med at vores forståelse af CTE vokser, er der en række udfordringer og kritikpunkter, der skal tages op. En hypotese som et alternativ til fænomenet CTE, er en nedsat “kognitiv reserve”-teori. Ifølge denne teori fører gentagne neurotraumer til en reduktion af den kognitive reserve og en fremskyndelse af udviklingen af en underliggende neurodegenerativ sygdom (20, 21). Hvis denne teori holder stik, ville det indebære, at CTE og AD befinder sig på det samme neuropatologiske spektrum. Denne påstand fortjener en nærmere analyse. I lighed med AD består Tau-isoformerne i CTE også af en blanding af tre-repeat- (3R) og fire-repeat- (4R) isoformer. Ifølge en nyere rapport fra Falcon et al. (22) indeholder Tau-filamenterne, der er udtaget fra hjerner fra CTE-patienter, imidlertid også en unik ß-helix-region med et hydrofobt hulrum, som ikke findes i hjerner fra AD-patienter. Hullet indeholder en ekstra cofaktor, som menes at spille en funktionel rolle i tau-formidlingen. Falcon et al. (22) antyder, at placeringen af tau-inklusioner i nærheden af blodkar tyder på, at cofaktorer, der er nødvendige for tau-sammensætningen, kan krydse blod-hjernebarrieren efter hovedtraumer. Forfatterne hævder endvidere, at det forhold, at hjernetraumer kun fører til CTE i en undergruppe af den skadede befolkning, kan være relateret til et højere niveau af cofaktorer hos de mere modtagelige personer. Disse cofaktorer kunne udgøre et terapeutisk mål for forebyggelse af tau-sammensætning og udvikling af CTE efter skade (22).
En alternativ teori foreslår, at de psykiatriske symptomer som depression og vrede, der rapporteres hos CTE-patienter, er uafhængige af CTE-sygdomsprocessen og rapporteres på en medfødt måde. Fortalerne af denne hypotese har citeret tidligere undersøgelser som f.eks. den, der er rapporteret af Weir et al. (23), hvor 1 063 tidligere NFL-spillere blev spurgt, om de har oplevet anfald af vrede. Det blev rapporteret, at 30,7 % af spillerne i alderen 30-49 år og 29,3 % af spillerne i alderen 50 år eller derover rapporterede om anfald af vrede. Forfatterne bemærkede dog også, at de rapporterede mål for vrede faktisk var lavere end de mål, der er rapporteret for den generelle amerikanske befolkning, som var 54,8 % for mænd mellem 30 og 49 år og 47,2 % for mænd over 50 år (23). Selv om argumenterne vedrørende komorbiditet af psykiatriske symptomer og neurodegenerative sygdomme som CTE er vanskelige at verificere på grundlag af neuroimaging og neuropatologiske fund, kan man anvende lignende argumenter på psykiatriske symptomer i forbindelse med enhver neurodegenerativ tilstand som AD, bvFTD, Parkinsons sygdom (PD) eller amyotrofisk lateralsklerose (ALS).
En anden vigtig kilde til diagnostisk forvirring er den kliniske afgrænsning mellem CTE og langvarigt postcommotionelt syndrom (PCS), især i betragtning af tidligere rapporter, der angiver, at ~10-20 % af personer, der lider af hjernerystelser, oplever langvarige symptomer. Kronisk postcommotionelt syndrom (CPCS) henviser til vedvarende PCS-symptomer, der fører til nedsat funktionel og ofte sportslig præstation, der varer længere end et år. CPCS-symptomerne omfatter hovedpine, svimmelhed, nedsat opmærksomhed, hukommelse og underskud i de eksekutive funktioner, depression og irritabilitetssymptomer (10). King og Kirkwilliam opfandt udtrykket “Permanent PCS” for at betegne personer med PCS-symptomer, der fortsætter i gennemsnit 6,9 år efter den første hjernerystelse. Desuden rapporterede de, at et betydeligt antal permanente PCS-patienter (40-59 %) også havde præ- eller postmorbide neuropsykiatriske tilstande som f.eks. depression, angst, PTSD og/eller smerter (24). Som hævdet af Jordan et al. (10) kan CPCS klinisk adskilles fra CTE, baseret på dens tidsmæssige relation til den akutte hjernerystende hændelse. En grundig og præcis tidsmæssig anamnese er fortsat afgørende for den neurologiske vurdering. Desuden er hovedpine et centralt træk ved CPCS, men er ikke almindeligt rapporteret ved CTE. Selv om det kan diskuteres, kan McKee-stadie I og II-patienter præsentere hovedpine, hvilket yderligere øger kompleksiteten af den mulige overlapning af CTE & CPCS (9). CPCS-diagnosen er fortsat kontroversiel, da det ikke er klart, om den er tauopatisk af natur. Derfor er skillelinjerne mellem CPCS og McKee’s stadie I og II kliniske karakteristika ikke helt fastlåste.
Der er ikke rapporteret om klare genetiske prædispositioner for CTE. ApoE4-genet, som er den mest kendte risikofaktor for Alzheimers sygdom (25), er imidlertid blevet forbundet med større kognitive underskud og en mere langvarig genopretningsperiode efter traumatisk hjerneskade (TBI) (11). En undersøgelse af en gruppe boksere har rapporteret om mere alvorlige udfald hos personer, der bærer mindst én ApoE4-allel (26). Omvendt kan ApoE3 give neuroprotektion, selv i tilstedeværelsen af en progressiv CTE-patologi (15). En anden foreslået beskyttelsesfaktor, der er forbundet med en mere gunstig post-TBI-genopretning, er kognitiv reserve, som målt ved præmorbid IQ og samlet intrakraniel volumen (27). Andre genetiske kandidater til yderligere undersøgelse omfatter det mikrotubuli-associerede protein tau (MAPT) gen, progranulin (GRN) genet og kromosom ni open reading frame 72 (C9ORF72) genet (11).
Den patologiske synergisme mellem tauopati og neuroinflammation anerkendes i stigende grad. Ekstracellulær sekretion af hyperfosforyleret tau menes at aktivere mikroglia og astrocytter, hvilket fører til produktion af proinflammatoriske cytokiner såsom IL1ß og TNFa, hvilket igen fører til aktivering af tau-kinaser såsom p38 og cdk5 og yderligere tau-fosforylering. Denne proces skaber en ondartet evig tauopati og neuroinflammationscyklus (28). I betragtning af den stærke sammenhæng mellem gentagne traumatiske hjerneskader og risikoen for CTE (1) kan rettidig behandling af TBI mindske udviklingen af CTE. TBI’s proinflammatoriske karakter er tidligere blevet rapporteret (13), og antiinflammatoriske midler som minocyclin med N-Acetylcystein, en potent antioxidant, der administreres i akutte til subakutte tidsvinduer efter TBI, tilbyder en lovende terapeutisk behandling (29, 30). Udviklingen af en tidsfølsom protokol, der ligner behandlingsalgoritmen for iskæmisk slagtilfælde, vil potentielt kunne måle det langsigtede resultat af genopretning efter TBI og forebyggelse af udvikling af efterfølgende CTE-patologi (29).
Der findes i øjeblikket ingen sygdomsmodificerende medicin til CTE, hvilket gør forebyggelse til den mest effektive måde at bekæmpe denne invaliderende neurodegenerative sygdom på (31). I betragtning af hyppigheden af hovedkollisioner i kontaktsport som f.eks. amerikansk fodbold vil forebyggelse af hovedtraumer kræve et kulturelt skift i den måde, hvorpå sporten undervises og udøves. Træning af sikre træningsteknikker, f.eks. sikre tacklinger og slag, samtidig med at uforsvarlige slag straffes, vil give målbare fordele. Yderligere ændringer skal omfatte skabelse af et miljø med sikkerhed, hvor spillerne opfordres til at rapportere symptomer til dommere, trænere og holdlæger. Desuden kunne en neurokognitiv baselineprofil anvendes som en klinisk referencemarkør til at følge ændringer i spillernes neuropsykiatriske præsentation. Det påhviler holdlægerne at fjerne spillere fra banen, som har fået selv en let ukompliceret TBI, med henblik på yderligere vurdering (32).
Der er en række eksisterende CTE-relaterede udfordringer, der skal tages op. Selv om forekomsten af sportsrelaterede hjernerystelser er blevet rapporteret til at ligge mellem 1,6 millioner og 3,8 millioner, er forekomsten og prævalensen af CTE stadig stort set ukendt (33). En af forklaringerne på denne manglende viden skyldes måske, at sportsfolk, der udsættes for kumulative subkonkussive slag, som udøver tilstrækkelig kraft til at forårsage neuronal skade, men som i første omgang ikke har nogen åbenlyse kliniske symptomer, ofte ikke vurderes eller diagnosticeres i tide (34). Storstilede prospektive undersøgelser, som f.eks. sporing af atleter med flere TBI’er over en foruddefineret periode, ville bidrage til vores forståelse af sygdommens naturlige forløb og fænomenologi. CTE er i stigende grad kommet i offentlighedens søgelys via massemedierne. Der er behov for en kontinuerlig indsats for at diagnosticere, vurdere og behandle denne ødelæggende sygdom. De eksponentielle fremskridt inden for neuroimaging-teknikker og forståelsen af sygdommens neuropatologiske mekanismer vil føre til tidligere diagnosticering og rettidige behandlingsinterventioner.
Author Contributions
Forfatteren bekræfter at være den eneste bidragyder til dette arbejde og har godkendt det til offentliggørelse.
Interessekonflikt erklæring
Forfatteren erklærer, at forskningen blev udført uden kommercielle eller finansielle relationer, der kunne opfattes som en potentiel interessekonflikt.
Akkreditering
Forfatteren anerkender den store støtte, vejledning og mentorskab fra Dr. Stephen Strittmatter.
1. McKee AC, Cantu RC, Nowinski CJ, Hedley-Whyte ET, Gavett BE, Budson AE, et al. Chronic traumatic encephalopathy in athletes: progressive tauopathy after repetitive head injury (kronisk traumatisk encephalopati hos atleter: progressiv tauopati efter gentagne hovedskader). J Neuropathol Exp Neurol. (2009) 68:709-35. doi: 10.1097/NEN.0b013e3181a9d503
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Goldstein LE, Fisher AM, Tagge CA, Zhang XL, Velisek L, Sullivan JA, et al. Chronic traumatic encephalopathy in blast-exposed military veterans and a blast neurotrauma mouse model. Sci Transl Med. (2012) 4:134ra60. doi: 10.1126/scitranslmed.3003716
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Martland H. Dementia pugilistica. JAMA. (1928) 91:364-65. doi: 10.1001/jama.1928.02700150029009
CrossRef Full Text | Google Scholar
4. Millspaugh J. Dementia pugilistica. US Naval Med Bull. (1937) 35:303.
Google Scholar
5. Critchley M. Hommage a Clovis Vincent. Paris: Maloine (1949).
Google Scholar
6. Mez J, Daneshvar DH, Kiernan PT, Abdolmohammadi B, Alvarez VE, Huber BR, et al. Klinisk-patologisk evaluering af kronisk traumatisk encephalopati hos spillere i amerikansk fodbold. JAMA. (2017) 318:360-70. doi: 10.1001/jama.2017.8334
PubMed Abstract | CrossRef Full Text | Google Scholar
7. McKee AC, Stein TD, Kiernan PT, Alvarez VE. Neuropatologi ved kronisk traumatisk encephalopati. Brain Pathol. (2015) 25:350-64. doi: 10.1111/bpa.12248
PubMed Abstract | CrossRef Full Text | Google Scholar
8. McKee AC, Cairns NJ, Dickson DW, Folkerth RD, Keene CD, Litvan I, et al. Det første NINDS/NIBIB konsensusmøde om at definere neuropatologiske kriterier for diagnosticering af kronisk traumatisk encephalopati. Acta Neuropathol. (2016) 131:75-86. doi: 10.1007/s00401-015-1515-z
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McKee AC, Stern RA, Nowinski CJ, Stein TD, Alvarez VE, Daneshvar DH, et al. Sygdomsspektret ved kronisk traumatisk encephalopati. Brain. (2013) 136:43-64. doi: 10.1093/brain/aws307
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Jordan BD. Det kliniske spektrum af sportsrelaterede traumatiske hjerneskader. Nat Rev Neurol. (2013) 9:222-30. doi: 10.1038/nrneurol.2013.33
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Stern RA, Daneshvar DH, Baugh CM, Seichepine DR, Montenigro PH, Riley DO, et al. Klinisk præsentation af kronisk traumatisk encephalopati. Neurology. (2013) 81:1122-9. doi: 10.1212/WNL.0b013e3182a55f7f
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Gardner A, Iverson GL, McCrory P. Chronic traumatic encephalopathy in sport: a systematic review. Br J Sports Med. (2014) 48:84-90. doi: 10.1136/bjsports-2013-092646
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Montenigro PH, Baugh CM, Daneshvar DH, Mez J, Budson AE, Au R, et al. Kliniske undertyper af kronisk traumatisk encephalopati: litteraturgennemgang og foreslåede forskningsdiagnostiske kriterier for traumatisk encephalopati syndrom. Alzheim Res Ther. (2014) 6:68. doi: 10.1186/s13195-014-0068-z
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Mawdsley C, Ferguson F. Neurologiske sygdomme hos boksere. Lancet. (1963) 282:795-801. doi: 10.1016/S0140-6736(63)90498-7
CrossRef Full Text | Google Scholar
15. Omalu BI, DeKosky ST, Minster RL, Kamboh MI, Hamilton RL, Wecht CH. Kronisk traumatisk encephalopati hos en spiller i National Football League. Neurosurgery. (2005) 57:128-34. doi: 10.1227/01.NEU.0000163407.92769.ED
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Rascovsky K, Hodges JR, Knopman D, Mendez MF, Kramer JH, Neuhaus J, et al. Sensitivitet af reviderede diagnostiske kriterier for den adfærdsmæssige variant af frontotemporal demens. Brain. (2011) 134:2456-77. doi: 10.1093/brain/awr179
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Omalu BI, Bailes J, Bailes J, Hammers JL, Fitzsimmons RP. Kronisk traumatisk encephalopati, selvmord og parasuicid hos professionelle amerikanske atleter: den retsmedicinske patologs rolle. Am J Forensic Med Pathol. (2010) 31:130-2. doi: 10.1097/PAF.0b013e3181ca7f35
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Maroon JC, Winkelman R, Bost J, Amos A, Mathyssek C, Mathyssek C, Miele V. Kronisk traumatisk encephalopati i kontaktsport: en systematisk gennemgang af alle rapporterede patologiske tilfælde. PLoS ONE. (2015) 10:e0117338. doi: 10.1371/journal.pone.0117338
CrossRef Full Text | Google Scholar
19. Iverson GL. Kronisk traumatisk encephalopati og risiko for selvmord hos tidligere atleter. Br J Sports Med. (2014) 48:162-4. doi: 10.1136/bjsports-2013-092935
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Iverson GL, Gardner AJ, McCrory P, Zafonte R, Castellani RJ.Iverson En kritisk gennemgang af kronisk traumatisk encephalopati. Neurosci Biobehav Rev. (2015) 56:276-93. doi: 10.1016/j.neubiorev.2015.05.008
CrossRef Full Text | Google Scholar
21. Randolph C. Kronisk traumatisk encephalopati er ikke en rigtig sygdom. Arch Clin Neuropsychol. (2018) 33:644-8. doi: 10.1093/arclin/acy063
CrossRef Full Text | Google Scholar
22. Falcon B, Zivanov J, Zhang W, Murzin AG, Garringer HJ, Vidal R, et al. Ny tau-filamentfold i kronisk traumatisk encephalopati omslutter hydrofobiske molekyler. Nature. (2019) 568:420-3. doi: 10.1038/s41586-019-1026-5
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Weir DR, Jackson JS, Sonnega A, et al. National Football League Player Care Foundation Study of Retired NFL Players (undersøgelse af pensionerede NFL-spillere). Ann Arbor: University of Michigan Institute for Social Research (2009).
Google Scholar
24. King NS, Kirwilliam S. Permanente symptomer efter hjernerystelse efter en mild hovedskade. Brain Inj. (2011) 25:462-70. doi: 10.3109/02699052.2011.558042
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Ward A, Crean S, Mercaldi CJ, Collins JM, Boyd D, Cook MN, et al. Prævalens af apolipoprotein E4-genotype og homozygoter (APOE e4/4) blandt patienter diagnosticeret med Alzheimers sygdom: en systematisk gennemgang og metaanalyse. Neuroepidemiologi. (2012) 38:1-17. doi: 10.1159/000334607
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Jordan BD, Relkin NR, Ravdin LD, Jacobs AR, Bennett A, Gandy S. Apolipoprotein Eε4 forbundet med kronisk traumatisk hjerneskade i boksning. (1997) 278:136-40. doi: 10.1001/jama.278.2.136
CrossRef Full Text | Google Scholar
27. Stern Y. Kognitiv reserve i aldring og Alzheimers sygdom. Lancet Neurol. (2012) 11:1006-12. doi: 10.1016/S1474-4422(12)70191-6
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Laurent CL, Buée L, Blum D. Tau og neuroinflammation: Hvilken betydning for Alzheimers sygdom og Tauopatier? Biomed J. (2018) 41:21-33. doi: 10.1016/j.bj.2018.01.003
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Sangobowale MA, Grin’kina NM, Whitney K, Nikulina E, St., Laurent-Ariot K, Ho JS, et al. Minocyclin plus N-acetylcystein reducerer adfærdsunderskud og forbedrer histologi med et klinisk nyttigt tidsvindue. J Neurotrauma. (2018) 35:907-17. doi: 10.1089/neu.2017.5348
CrossRef Full Text | Google Scholar
30. Haber M, James J, Kim J, Sangobowale M, Irizarry R, Ho J, et al. Minocyclin plus N-acteylcystein inducerer remyelinisering, beskytter oligodendrocytter synergistisk og modificerer neuroinflammation i en rottemodel af mild traumatisk hjerneskade. J Cereb Blood Flow Metab. (2018) 38:1312-6. doi: 10.1177/0271678X17718106
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Livingston G, Sommerlad A, Orgeta V, Costafreda SG, Huntley J, Ames D, et al. Demensforebyggelse, -intervention og -pleje. Lancet. (2017) 390: 2673-734. doi: 10.1016/S0140-6736(17)31363-6
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Saulle M, Greenwald BD. Kronisk traumatisk encephalopati: en gennemgang. Rehabil Res Pract. (2012). 2012: 816069. doi: 10.1155/2012/816069
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Langlois JA, Rutland-Brown W, Wald MM. Epidemiologi og konsekvenser af traumatisk hjerneskade. J Head Trauma Rehabil. (2006) 21:375-8. doi: 10.1097/00001199-200609000-00001
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Martini D, Eckner J, Eckner J, Kutcher J, Broglio SP. Biomechanik ved subkonkussive hovedstød: sammenligning af forskellige offensive ordninger. Med Sci Sports Exerc. (2013) 45:755-61. doi: 10.1249/MSS.0b013e3182798758
PubMed Abstract | CrossRef Full Text | Google Scholar