Introduktion
Meningiomer er den mest almindelige primære neoplasma i centralnervesystemet (CNS) og udgør over 37 % af alle primære hjernetumorer (1). Behandlingsmulighederne for meningiomer omfatter observation, kirurgi og strålebehandling (2, 3). Mens et mindretal af meningiomer er aggressive, herunder Verdenssundhedsorganisationens (WHO) grad II og III, er over 80 % WHO-grad I og kaldes ofte “benigne” (4). Men selv meningiomer af WHO-grad I kan dog recidivere, og tidligere undersøgelser har vist en recidivfrekvens på op til 47 % ved langtidsopfølgning (4, 5). Meningeomrecidiv kræver ofte behandling med yderligere kirurgi eller genoprettende strålebehandling, hvilket fører til potentiel morbiditet (6, 7). Som følge heraf er evnen til at forudsige recidiv en afgørende komponent i WHO grade I-meningeombehandlingen for at kunne fremsætte anbefalinger vedrørende hyppigheden af overvågningsbilleder eller brugen af adjuverende strålebehandling.
Ud over den Simpson-grad, der opnås ved resektion, er en række tumorkarakteristika blevet evalueret som mulige prædiktorer for recidiv, med fokus på histopatologiske fund (8). Disse omfatter MIB-1-indekset (en markør for celleproliferation), hjerneinvasion og tilstedeværelsen af atypiske histologiske træk, herunder øget cellularitet, sheeting, foci af spontan nekrose og nukleær atypi (9-13). Faktisk anvender WHO’s klassifikationer fra 2016 udelukkende patologiske fund til at bestemme tumorgrad med grad II defineret ved hjerneinvasion og øget mitose over 4/10 high powered field (HPF) (4). Desuden resulterer tre atypiske træk tilsammen i en øget tumorgrad (4). Fremadrettet er meningiomers molekylære karakteristika for nylig blevet forbundet med risiko for recidiv og vil sandsynligvis blive anvendt i meningiomgradering i fremtiden (14-16).
Mens WHO-klassifikationerne syntetiserer den tilgængelige litteratur for at skabe klare afgrænsere mellem tumorgrader, er litteraturen omkring WHO-grad I-meningeomrecidiv fortsat blandet. For eksempel kan hjerneinvasion alene resultere i en forøgelse af tumorgraden fra WHO-grad I-II, men en række efterfølgende undersøgelser har ikke fundet en sammenhæng mellem hjerneinvasion og recidiv, hvilket understreger behovet for yderligere forskning i prædiktorer for recidiv (10, 17, 18). Nytteværdien af MIB-1-indekset til at forudsige meningiomrecidiv er også kontroversiel; en undersøgelse af meningiomer af WHO-grad I tydede kun på en højere recidivrisiko ved et MIB-1-indeks på >3 %, men anden litteratur, der omfatter alle WHO-grader, har vist en højere recidivincidens ved >5 % eller >10 % (9-11). Tidligere undersøgelser har også foreslået en MIB-1 cutoff på >3% kun hos patienter med en Simpson II- eller III-resektion, hvilket yderligere demonstrerer forskelligheden i MIB-1 cutoffs og deres anvendelse (13). Til sammenligning har et begrænset antal undersøgelser undersøgt virkningen af atypiske træk i WHO grade I meningiomrecidiv; selv om de har antydet en højere risiko for recidiv i WHO grade I tumorer, der viser atypiske træk ved patologisk analyse (9).
Derfor var målet med denne undersøgelse at undersøge kliniske, radiografiske og patologiske prædiktorer for recidiv i WHO grade I meningiomer. I betragtning af den manglende konsensus om brugen af MIB-1 i WHO grade I-meningeomer anvender vi også rekursiv partitioneringsanalyse til at identificere en klinisk relevant grænseværdi for MIB-1-indekset. Vi identificerer derefter prædiktorer for tidlig og postmedian recidiv i WHO grad I tumorer.
Metoder
Patientpopulation
Patienter, der gennemgik behandling for et WHO grad I meningiom fra 2007 til 2017, blev retrospektivt identificeret ved hjælp af en institutionel database. Denne undersøgelse blev formelt godkendt af University of California, San Francisco Institutional Review Board (IRB#13-12587). Patienter uden MIB-1-indeksværdier, der var tilgængelige i den elektroniske patientjournal, blev udelukket. Tidligt i undersøgelsesperioden blev MIB-1 indhentet efter den behandlende neuropatologs skøn, men efterhånden som tiden skred frem, blev MIB-1 indhentet på alle WHO grade I-meningeom-patienter.
Kliniske data
Patienternes demografiske data, kliniske og behandlingsmæssige karakteristika, histopatologiske data og kliniske resultater blev retrospektivt gennemgået og indsamlet. De indsamlede kliniske data omfattede patientens alder, køn, Karnofsky Performance Status (KPS) på behandlingstidspunktet, klinisk præsentation og tidligere historie af meningiombehandling. Histopatologiske data omfattede MIB-1-indeks, skifer/tab af arkitektur, øget cellularitet, nekrose, nukleær atypi og tilstedeværelsen af knogleinvasion. Progesteronreceptor (PR), Epithelial Membrane Antigen (EMA), CD34, S100, glial fibrillært og surt protein (GFAP) farvningsresultater blev indsamlet, når de var tilgængelige. Patologiske data blev uddraget fra den patologirapport, der blev udarbejdet på tidspunktet for det kirurgiske indgreb. Tumorens placering, størrelse og tilstedeværelsen af præoperativt peritumoralt ødem blev bestemt ved hjælp af præoperativ MRI-billeddannelse. Anterior-posterior (AP), superior-inferior (SI) og tværgående (TV) diametre blev indsamlet. Det præoperative tumorvolumen blev beregnet ved hjælp af ligningen for ikke-sfærisk tumorvolumen. Behandlingstypen blev ligeledes indsamlet. Simpson-graden blev bestemt på grundlag af operationsrapporten. Bruttototal (GTR) og Subtotal resektion (STR) blev bestemt ved hjælp af postoperative MR-scanninger (magnetisk resonansbilleddannelse).
De primære resultater af interesse var tumorrecidiv og tid til recidiv. Recidiv blev bestemt på postoperativ røntgenfotografering som et lokalt recidiv eller progression af resttumor. Tiden til recidiv blev bestemt fra patientens behandlingsdato. Længden af opfølgningen blev beregnet fra behandlingsdatoen til det sidste besøg på den neurokirurgiske klinik. Sekundære resultater omfattede tidlig og postmedicinsk recidiv. Tidligt recidiv blev defineret som inden for 2 år efter den første behandling (19). Post-median recidiv blev defineret som opstået >2 år efter den første behandling.
Statistisk analyse
Chi-square og Student’s t-test blev anvendt til sammenligning af henholdsvis kategoriske og kontinuerlige variabler. En multivariat backward likelihood Cox-regressionsmodel for recidiv blev konstrueret ved hjælp af variabler med p < 0,200 på univariat analyse. Tilsvarende blev der konstrueret multivariate backward likelihood binære logistiske modeller til at forudsige tidlig og postmedian recidiv ved hjælp af variabler med p < 0,200 ved univariat analyse. Recursive partitioning analysis (RPA) blev anvendt til yderligere at identificere centrale risikofaktorer for samlet, tidlig og postmedian meningiomrecidiv. En p < 0,050 blev anvendt som tærskel for statistisk signifikans. Alle statistiske analyser blev udført med SPSS 26.
Resultater
Gennemsnitlige patientdemografier og kliniske resultater
Gennemsnitlige patientdemografier, histopatologiske karakteristika og kliniske resultater kan ses i tabel 1. I alt 239 patienter med WHO grade I meningiomer blev inkluderet i undersøgelsen. Gennemsnitsalderen var 60,0 år, og 69,5 % af patienterne var kvinder. Det mest almindelige symptom var hovedpine (30,5 %), efterfulgt af et fokalt neurologisk underskud (27,6 %). Størstedelen af patienterne blev opereret alene (98,3 %), mens 2 patienter hver fik adjuverende strålebehandling (0,8 %) eller behandling med gammakniv (0,8 %). Peritumoralt ødem var til stede på de præoperative MR-scanninger hos 38,1 % af patienterne. Det gennemsnitlige beregnede tumorvolumen var 30,6 cm3 (interval = 0,23-215,73 cm3), og den gennemsnitlige største tumordimension var 3,8 cm (interval = 0,6-11,3 cm). Samlet set var 91 (38,1 %) tumorer placeret på kraniebasen, 57 (23,8 %) var konveksitetstumorer, 43 (18,0 %) havde en falx/parasagittal placering, og 55 (23,0 %) havde en anden placering. De fleste patienter fik en bruttototal resektion (63,6 %). Forekomsten af Simpson I-, II-, III- og IV-resektion var henholdsvis 31,4, 29,7, 2,5 og 35,6 %. Atypiske træk var til stede hos en række patienter; de hyppigste atypiske træk var knogleinvasion (18,0 %) og skifer/tab af arkitektur (8,4 %). Den gennemsnitlige opfølgning var 41,1 måneder (interval: 0-147 måneder).
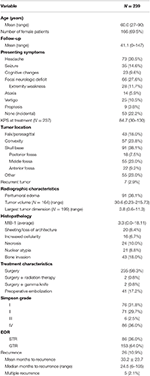
Tabel 1. Patientkarakteristika, histopatologiske træk, radiografi og resultater.
Prædiktorer for WHO Grade I Meningiom Recidiv
I alt 26 patienter recidiverede med en mediantid til recidiv på 24,5 måneder (Tabel 1). En sammenligning mellem patienter med et recidiv og patienter uden recidiv findes i tabel 2. Der var ingen forskel i alder (60,2 vs. 58,8, p = 0,582) eller kvindeligt køn (61,5 vs. 70,4 %, p = 0,353) mellem patienter med tumorer, der recidiverede, og patienter, der ikke recidiverede. Behandlingskarakteristika var ens mellem grupperne, idet de fleste patienter i hver gruppe fik kirurgi alene (100,0 vs. 98,1 %, p = 1,000). Patienter med tilbagevendende tumorer havde dog en højere forekomst af STR (61,5 vs. 32,7 %, p = 0,004) og en lavere forekomst af Simpson grade I-resektion (11,5 vs. 34,1 %, p = 0,019). Forekomsten af peritumoralt ødem, tumorstørrelse og tumorvolumen var ens mellem grupperne. Ved histopatologisk analyse var der en tendens til øget nukleær atypi hos patienter med recidiv (19,2 vs. 7,5 %, p = 0,061). Patienter med recidiv havde også en højere gennemsnitlig opfølgning (68,9 vs. 37,7 måneder, p = 0,001).
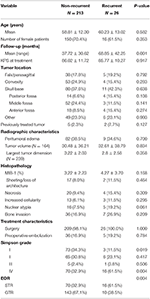
Tabel 2. Sammenligning af patienter med recidiverende meningiomer vs. ikke-recidiverende meningiomer.
En efterfølgende backward likelihood cox-regressionsanalyse fremhævede en uafhængig sammenhæng mellem recidiv og tumorplacering i posterior fossa (HR = 5.25, CI 1.71-16.17, p = 0.004), MIB-1-indeks (HR = 1.18, CI 1.05-1.34, p = 0.008), nukleær atypi (HR = 5.24, CI 1.73-15.92, p = 0.003) og STR (HR = 5.66, CI 1.30-13.92, p < 0.001; tabel 3). Kaplan-Meier-kurver, der fremhæver recidivfri overlevelse for placering i posterior fossa (p = 0,007), nukleær atypi (p = 0,137), resektionsomfang (p = 0,001) og MIB-1 >4,5 % (p = 0,001), er vist i figur 1A-D.
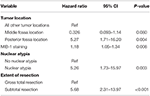
Tabel 3. Cox-regressionsanalyse for recidiv.

Figur 1. Kaplan Meier-kurver for risikofaktorer for recidiv af WHO grade I-meningeom. (A) Kerneatypi (blå linje) vs. ingen kerneatypi (rød linje) (X2 = 2,21, p = 0,137). (B) Placering af tumor i posterior-fossa (blå linje) vs. andre placeringer (rød linje) (X2 = 10,36, p = 0,001). (C) MIB-1-indeks >4,5 % (blå linje) vs. ≤4,5 % (rød linje) (X2 = 6,17, p = 0,013). (D) STR (blå linje) vs. GTR (rød linje) (X2 = 10,46, p = 0,001).
Prediktorer for tidlig vs. postmedian WHO Grade I Meningiomrecidiv
En sammenligning mellem ikke-recidiverende patienter og patienter med tumorer, der recidiverede tidligt eller postmedian, er præsenteret i tabel 4. Patienter med et tidligt recidiv havde en højere forekomst af subtotal resektion (76,9 vs. 32,7 %, p = 0,001). De havde også en tendens til en højere forekomst af nukleær atypi (23,1 vs. 7,5 %, p = 0,084) på histopatologi (Tabel 4). Patienter med et postmediært recidiv havde en tendens til en øget forekomst af tumorplacering i posterior fossa (23,1 vs. 6,6 %, p = 0,063) og en højere forekomst af knogleinvasion (38,5 vs. 16,9 %, p = 0,064) samt et højere MIB-1-indeks (5,55 vs. 3,22 %, p = 0,098). Der var ingen signifikant forskel mellem Simpson-gradering eller GTR-rater hos patienter med postmedianrecidiv i forhold til patienter uden recidiv (tabel 4).
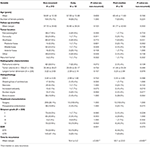
Tabel 4. Tidlig vs. postmedianrecidiv.
To multivariate backward likelihood binære logistiske modeller blev anvendt til at identificere prædiktorer for tidlig vs. postmedianrecidiv (tabel 5). Uafhængige prædiktorer for tidlig tumorrecidiv omfattede nukleær atypi på histopatologi (OR = 6,45, CI 1,34-31,07, p = 0,020) og STR (OR = 8,92, CI 2,18-36,46, p = 0,002). Den eneste uafhængige prædiktor for recidiv efter midterste del var MIB-1-indekset (OR = 1,24, CI 1,05-1,45, p = 0,010), selv om posterior fossa-placering nærmede sig signifikans (OR = 4,42, CI 0,954-20,49, p = 0,058; tabel 5).

Tabel 5. Binær logistisk model for postmedian og tidlig tumorrecidiv.
Recursive Partitioning Analysis of Recurrence
RPA blev udført for at identificere centrale risikofaktorer for meningiomrecidiv (Figur 2). I overensstemmelse med cox-regressionsanalysen var STR den første partition ved forudsigelse af samlet recidiv: 18,6 % af patienterne med en STR-resektion recidiverede sammenlignet med 6,5 % med en GTR. Den næste beslutningsknude inden for kun GTR-patienter involverede en MIB-1 cutoff på 4,5 %, da 18,8 % af patienterne med en MIB-1 >4,5 % recidiverede sammenlignet med 3,3 % af patienterne med en MIB-1 ≤4,5 % (Figur 2A). Med hensyn til specifikt recidiv efter midterste recidiv identificerede RPA det første beslutningsknudepunkt som en MIB-1 cutoff på 5,83 %: 22,2 % af patienterne med MIB-1 >5,83 % recidiverede mod 3,3 % af patienterne med en MIB-1 ≤5,83 %. Det efterfølgende beslutningsknudepunkt anvendte en tumorlokalisering i posterior fossa: 13,3 % af patienterne med en tumor i posterior fossa recidiverede mod 2,5 % af de andre tumorlokaliteter (Figur 2B). RPA for tidlig recidiv identificerede resektionens omfang som det primære beslutningsknudepunkt: 11,6 % af patienterne med STR recidiverede mod 2,0 % af GTR-patienterne. Den følgende beslutningsknude anvendte falx eller parasagittal placering: 36,4 % af falx- eller parasagittale tumorer recidiverede vs. 8,1 % af andre tumorplaceringer (figur 2C).
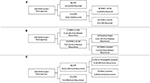
Figur 2. Rekursiv partitioneringsanalyse, der fremhæver de vigtigste risikofaktorer for (A) samlet recidiv, (B) postmedianrecidiv og (C) tidligt recidiv.
Diskussion
Nøgleresultater
WHO grade I meningiomrecidiv er uafhængigt forbundet med MIB-1-indeks, posterior fossa tumorplacering, tilstedeværelsen af nukleær atypi og STR. Mere specifikt blev et MIB-1-indeks på 4,5 % identificeret som en klinisk relevant grænseværdi ved risikostratificering af WHO grade I-meningeom-patienter efter GTR. Patienter med et >4,5 % MIB-1-indeks og GTR af deres WHO-grad I-meningeom havde en lignende risiko for recidiv som de patienter med en STR. Yderligere analyse fremhævede MIB-1 som en kritisk faktor, der var forbundet med recidiv efter midterste genkomst, mens resektionsomfanget var den vigtigste drivkraft for tidlig recidiv.
Prediktorer for recidiv af WHO-grad I-meningeom-recidiv
Forrige undersøgelser har på samme måde vurderet forholdet mellem histopatologiske træk, kliniske karakteristika og recidiv i alle meningiom WHO-grader. I en undersøgelse af 901 patienter (716 af WHO-grad I, 174 af grad II og 11 af grad III) undersøgte Gousias et al. viser en højere risiko for recidiv i meningiomer med et MIB-1-indeks på >10 %, højere WHO-grad, tumorstørrelse >6 cm, petroklivisk placering eller placering i sinus cavernosus og multiplicitet (11). Gousias et al. vurderede imidlertid ikke sammenhængen mellem tilstedeværelsen af atypiske træk på histologi og tumorrecidiv. I WHO grade I-meningeomer specifikt anvendte Marciscano et al. en kohorte på 148 WHO grade I-meningeom-patienter med fuldstændig patologisk analyse til at identificere variabler forbundet med recidiv, med fokus på virkningen af atypiske patologiske træk på recidivrisikoen (9). Interessant nok identificerer de tilstedeværelsen af atypiske træk som en uafhængig risikofaktor ud over MIB-1-indeks >3% og Simpson-resektion. Vores undersøgelse fremhæver på samme måde kirurgisk GTR og nukleær atypi, et atypisk træk, som uafhængige prædiktorer for recidiv (tabel 3), selv om vi vurderede hvert atypisk træk uafhængigt af hinanden. Vi overvejer også tumorplacering i vores cox-regressionsmodel, hvilket yderligere identificerer tumorens placering i posterior fossa som en uafhængig risikofaktor for recidiv. Mens Marciscano et al. ikke medtog tumorplacering i deres analyse af prædiktorer for progression, påviser Gousias et al. på samme måde petroklival tumorplacering som en risikofaktor for recidiv, om end når der tages hensyn til alle WHO-meningeomgrader (9, 11). Den højere risiko for recidiv forbundet med placering i posterior fossa kan skyldes den øgede prævalens af NF2-mutationer i posterior fossa (14, 15, 20), selv om vi ikke er i stand til fuldt ud at undersøge dette, da vi ikke rutinemæssigt udfører genetisk testning af meningiom på vores institution. Uanset er der behov for yderligere undersøgelser med større WHO grade I-meningeom-patientkohorter for at undersøge dette forhold.
MIB-1-indeks og WHO grade I-meningeomrecidiv
I lighed med tidligere undersøgelser (9, 11, 13, 21) evaluerede vi derefter også forholdet mellem MIB-1-indekset for en tumor og dens risiko for recidiv. Vi evaluerede først MIB-1-indekset i en cox-regressionsmodel for samlet recidiv, som tidligere omtalt. I overensstemmelse med tidligere undersøgelser fandt vi, at et højere MIB-1-indeks var uafhængigt forbundet med en samlet øget risiko for recidiv. I betragtning af uoverensstemmelserne i cutoff-værdierne for MIB-1 mellem litteraturen og variationen mellem laboratorierne evaluerede vi i første omgang MIB-1 som en kontinuerlig variabel. Vi søgte derefter at bestemme cutoff-værdien for MIB-1-indekset i vores patientpopulation ved at anvende RPA til at modellere det samlede recidiv, hvilket identificerede en MIB-1 cutoff-værdi på 4,5 % hos patienter med GTR (Figur 2A). Interessant nok havde disse patienter en lignende risiko for recidiv som patienter med en STR, hvilket demonstrerer nytten af MIB-1 hos patienter efter GTR. Perry et al. identificerer på samme måde et MIB-1-indeks på 4,2 % som associeret med recidiv efter GTR på univariat analyse, om end når der tages hensyn til alle meningiomgrader (22).
Recidivraten på 18,8 % hos patienter med en GTR og MIB-1 >4,5 % fremhæver behovet for tæt overvågning af disse patienter eller endda overvejelse af adjuverende strålebehandling, afhængigt af patientens præference. Adjuverende strålebehandling efter resektion for WHO grade I-meningeom har vist sig at reducere recidiv, især efter STR (23-25), selv om observation efter STR fortsat er standardpraksis (8). I en undersøgelse af 92 WHO grade I-meningeomer påviste Soyuer et al. en 91 % progressionsfri overlevelse (PFS) hos patienter, der modtog adjuverende strålebehandling efter STR, hvilket var betydeligt højere end den 38 % PFS hos de patienter, der ikke havde modtaget adjuverende strålebehandling (24). Da patienter i vores undersøgelse med en STR havde en lignende risiko for recidiv som patienter med en GTR og MIB-1 >4,5%, kan adjuverende strålebehandling for begge grupper være rimelig. Der er dog behov for større undersøgelser for yderligere at validere vores MIB-1 cutoff og de tilhørende kliniske implikationer. Der er også behov for prospektive undersøgelser, der undersøger brugen af adjuverende strålebehandling i WHO grade I-meningeomer.
Predictors of Early and Post-median WHO grade I Meningioma Recurrence
Givet tendensen til et senere recidiv hos patienter med en forhøjet MIB >4.5% (Figur 1C), søgte vi derefter at undersøge forskelle i prædiktorer mellem patienter, der recidiverede tidligt (defineret som inden for 2 år efter behandling) eller postmedian (dem, der recidiverede >2 år efter behandling). Kun få undersøgelser i litteraturen har undersøgt prædiktorer for tidlig recidiv i meningiomer. En undersøgelse af Budohoski et al. identificerer parafalcin placering, STR og peritumoralt ødem på radiografisk billeddannelse som prædiktorer for tidlig recidiv i en kohorte af 220 atypiske meningiomer (26). En lignende undersøgelse af Maillo et al. i WHO grade I-meningeomer anvender interfasen fluorescens in situ hybridisering (FISH) og patologiske træk til at identificere risikofaktorer for tidlig recidiv (defineret som 2,5 år efter behandling) og fandt større tumorstørrelse, karyotypeafvigelser, patientens alder og afvigelser på kromosom 10 som værende forbundet med øget risiko for recidiv (19). Forfatterne tog dog ikke hensyn til tilstedeværelsen af atypi på patologi eller MIB-1-indeks. Ved hjælp af en kohorte af WHO grade I meningiom-patienter med mere granulære patologiske og kliniske data identificerede vi omfanget af resektion og nukleær atypi på patologi som uafhængige prædiktorer for tidlig recidiv på binær logistisk regressionsmodellering (tabel 5). RPA afslørede ligeledes betydningen af resektionens omfang ved risikostratificering af patienter for tidlig recidiv (Figur 2C). Interessant nok fremhævede den også den øgede risiko, der er forbundet med falx/parasagittal tumorplacering, hvilket svarer til resultaterne af Budohoski et al. (26). Den eneste signifikante prædiktor for tumorrecidiv efter midterste tumorreducering på binær logistisk regressionsmodellering var MIB-1-indekset, selv om tumorens placering i posterior fossa nærmede sig signifikans. Dette blev yderligere påvist på RPA (figur 2B). Overraskende nok var resektionsomfanget ikke en uafhængig prædiktor for postmedianrecidiv, da størstedelen af postmedianrecidiverne havde gennemgået en GTR. Postmediane recidiv kan fremhæve en kategori af WHO grade I meningiomer, som er molekylært mere aggressive og recidiverer på trods af GTR, i betragtning af deres forhøjede MIB-1 indeks og placering i posterior fossa . Tidlige recidiv er betydeligt mere påvirket af resektionsomfanget og repræsenterer derfor sandsynligvis fortsat vækst af resttumor i modsætning til recidiv af tidligere fuldstændig reseceret tumor, som det ses i postmediane recidiv. Vores resultater repræsenterer således potentielt to forskellige molekylære WHO grade I meningiom-subtyper. Der er imidlertid behov for fremtidige undersøgelser med større patientkohorter og molekylære tumordata for yderligere at undersøge de underliggende forskelle i molekylære ændringer mellem tidlige og postmediane recidiv.
Begrænsninger
Begrænsningerne ved vores undersøgelse omfatter dens retrospektive karakter og den lave recidivincidens. Vores undersøgelse omfatter også patienter, der begynder i 2007, og som følge heraf spænder den over både 2007 og 2016 WHO CNS klassifikationsskemaer. Den eneste væsentlige ændring mellem de to klassifikationer var imidlertid tilføjelsen af hjerneinvasion som et enkeltstående kriterium for WHO-grad II-status. Kun to af de patienter, der indgik i vores kohorte, havde hjerneinvasion konstateret ved patologisk analyse, og ingen af patienterne fik tilbagefald. Vi mener derfor ikke, at medtagelsen af patienter, der blev klassificeret efter 2007-klassifikationsskemaet, havde en væsentlig indvirkning på vores resultater. Desuden er vores undersøgelse baseret på de patologiske rapporter efter den oprindelige resektion uden en central fornyet gennemgang af de patologiske objektglas. Dette kan føre til øget variabilitet i de patologiske variabler, såsom nukleær atypi og andre lignende patologiske fund, som kan vise interobservatørvariabilitet (27, 28). MIB-1 er imidlertid et relativt objektivt mål med lavere interobservatørvariabilitet mellem patologer, der anvender den samme metode inden for et patologisk laboratorium (29). Praksismønstre vedrørende MIB-1-testning ændrede sig også i løbet af undersøgelsesperioden fra individuelle patologers præferencer, som varierede afhængigt af patologen, til testning hos alle patienter. Faktorer, som patologerne overvejede, da de besluttede sig for MIB-1-testning, omfattede de atypiske træk, der indgik i vores undersøgelse, hvilket minimerede deres potentielle indvirkning på vores resultater. Desuden er alle meningiomer, der er inkluderet i vores undersøgelse, WHO-klasse I. Som følge heraf mener vi, at enhver bias, der er indført i undersøgelsen på baggrund af disse ændringer i praksismønstre, er minimal. Endelig, mens vi omfatter detaljerede kliniske og patologiske karakteristika, mangler vores patientkohorte oplysninger om tumorgenetiske og molekylære ændringer, som har vist sig at have en betydelig indvirkning på tumorresultater (15, 30-32). Der er således fortsat behov for yderligere store multi-institutionelle undersøgelser med molekylære/genetiske data ud over traditionelle patologiske og kliniske variabler ved forudsigelse af samlet recidiv af WHO grade I meningiomer. Dette omfatter overvejelse af molekylære/genetiske prognostikere, såsom genomdækkende methyleringsmønstre (33, 34), TERT-promotormutationer (35) og yderligere tumormolekylære data I betragtning af vores resultater er fremtidige undersøgelser af unikke genetiske/molekylære, kliniske og patologiske prædiktorer for tidlige og senere recidiv også berettigede i betragtning af den potentielle indvirkning på lægers terapeutiske beslutningstagning.
Nu giver vores undersøgelse ikke desto mindre detaljeret indsigt i kliniske og histopatologiske prædiktorer for recidiv, specifikt i WHO grade I meningiomer. Desuden identificerer vi patienter med en MIB-1 >4,5 % som værende i høj risiko for recidiv efter GTR. Vi udnytter også vores data til at give indsigt i forskelle mellem tidlige og postmediane WHO grade I-meningeomrecidiv, hvilket potentielt identificerer forskellige WHO grade I-meningeom-molekylære undergrupper. Vores resultater tyder på, at patienter med et forhøjet MIB-1-indeks og nukleær atypi på patologisk analyse, posterior fossa-placering af deres tumor og STR har en højere risiko for recidiv og bør overvejes til nærmere opfølgning eller endda adjuverende strålebehandling. Desuden har patienter med et MIB-1-indeks på over 4,5 % en lignende risiko for recidiv som dem, der har gennemgået STR af deres tumorer, og bør også potentielt overvejes til adjuverende strålebehandling.
Slutning
Der er fortsat en mangel på litteratur om specifikke prædiktorer for recidiv i WHO grade I meningiomer. Resultaterne af denne undersøgelse fremhæver posterior fossa tumorplacering, MIB-1-indeks, nukleær atypi og resektionsomfang som uafhængigt forbundet med recidiv af grad I meningiomer. Vi viser også, at patienter med et MIB-1 >4,5 % og GTR har en lignende risiko for recidiv som patienter med en STR. Endelig afslørede differentiel analyse af tidlige og postmediane recidiv en sammenhæng mellem MIB-1-indeks og posterior fossa-placering i postmediane recidiv, mens tidlige recidiv var mere signifikant påvirket af resektionens omfang. Der er behov for yderligere undersøgelser, der validerer vores resultater og omfatter molekylære/genetiske data, for at identificere yderligere prædiktorer for recidiv i WHO grade I meningiomer. Sådanne undersøgelser kunne give en mere præcis ramme til risikostratificering af patienter og hjælpe med terapeutisk beslutningstagning, herunder potentialet for adjuverende strålebehandling.
Datatilgængelighedserklæring
De rå data, der understøtter konklusionerne i denne artikel, vil blive stillet til rådighed af forfatterne uden unødige forbehold.
Ethisk erklæring
Studierne, der involverer menneskelige deltagere, blev gennemgået og godkendt af UCSF Institutional Review Board. Skriftligt informeret samtykke til deltagelse var ikke påkrævet for denne undersøgelse i overensstemmelse med den nationale lovgivning og de institutionelle krav.
Author Contributions
AH: konceptualisering, metodologi, formel analyse, undersøgelse, skrivning-originalt udkast, skrivning-gennemgang og redigering og visualisering. JY: konceptualisering, metodologi og skrivning-gennemgang og redigering. IK og SS: undersøgelse. J-SC: visualisering og formel analyse. DR og MM: skriftlig gennemgang og redigering. SM: skriftlig gennemgang og redigering, konceptualisering og metodologi. MA: skriftlig gennemgang og redigering samt tilsyn. Alle forfattere bidrog til artiklen og godkendte den indsendte version.
Interessekonflikter
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller økonomiske relationer, der kunne opfattes som en potentiel interessekonflikt.
Revisor BB erklærede et tidligere samforfatterskab med forfatterne DR, MM og SM over for den behandlende redaktør.
1. Ostrom QT, Cioffi G, Gittleman H, Patil N, Waite K, Kruchko C, et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2012-2016. Neuro Oncol. (2019) 21:v1-100. doi: 10.1093/neuonc/noz150
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Karsy M, Guan J, Cohen A, Colman H, Jensen RL. Medicinsk behandling af meningiomer. Nuværende status, fejlslagne behandlinger og lovende fremtidsudsigter. Neurosurg Clin N Am. (2016) 27:249-60. doi: 10.1016/j.nec.2015.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Brastianos PK, Galanis E, Butowski N, Chan JW, Dunn IF, Goldbrunner R, et al. Advances in multidisciplinary therapy for meningiomas. Neuro Oncol. (2019) 21:I18-31. doi: 10.1093/neuonc/noy136
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. Verdenssundhedsorganisationens 2016-klassifikation af tumorer i centralnervesystemet: et resumé. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Pettersson-Segerlind J, Orrego A, Lönn S, Mathiesen T. Long-term 25-year follow-up of surgically treated parasagittal meningiomas. World Neurosurg. (2011) 76:564-71. doi: 10.1016/j.wneu.2011.05.015
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Van Alkemade H, De Leau M, Dieleman EMT, Kardaun JWPF, Van Os R, Vandertop WP, et al. Forringet overlevelse og neurologiske problemer på lang sigt ved benignt meningiom. Neuro Oncol. (2012) 14:658-66. doi: 10.1093/neuonc/nos013
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Buerki RA, Horbinski CM, Kruser T, Horowitz PM, James CD, Lukas RV. En oversigt over meningiomer. Futur Oncol. (2018) 14:2161-77. doi: 10.2217/fon-2018-0006
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Rogers L, Barani I, Chamberlain M, Kaley TJ, McDermott M, Raizer J, et al. Meningiomer: vidensgrundlag, behandlingsresultater og usikkerheder. A RANO review. J Neurosurg. (2015) 122:4-23. doi: 10.3171/2014.7.JNS131644
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Marciscano AE, Stemmer-Rachamimov AO, Niemierko A, Larvie M, Curry WT, Barker FG, et al. Benigne meningiomer (WHO Grade I) med atypiske histologiske træk: korrelation af histopatologiske træk med kliniske resultater. J Neurosurg. (2016) 124:106-14. doi: 10.3171/2015.1.JNS142228
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Baumgarten P, Gessler F, Schittenhelm J, Skardelly M, Tews DS, Senft C, et al. Hjerneinvasion i ellers benigne meningiomer forudsiger ikke tumorrecidiv. Acta Neuropathol. (2016) 132:479-81. doi: 10.1007/s00401-016-1598-1
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gousias K, Schramm J, Simon M. The simpson grading revisited: aggressiv kirurgi og dens plads i moderne meningiombehandling. J Neurosurg. (2016) 125:551-60. doi: 10.3171/2015.9.JNS15754
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Matsuno A, Fujimaki T, Sasaki T, Nagashima T, Ide T, Asai A, et al. Klinisk og histopatologisk analyse af proliferative potentialer af recidiverende og ikke-recidiverende meningiomer. Acta Neuropathol. (1996) 91:504-10. doi: 10.1007/s004010050458
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Oya S, Kawai K, Nakatomi H, Saito N. Betydning af Simpson grading system i moderne meningiom kirurgi: integration af graden med MIB-1 labeling index som en nøgle til at forudsige recidiv af WHO Grade I meningiomer – klinisk artikel. J Neurosurg. (2012) 117:121-8. doi: 10.3171/2012.3.JNS111945
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Yuzawa S, Nishihara H, Tanaka S. Genetisk landskab af meningiom. Brain Tumor Pathol. (2016) 33:237-47. doi: 10.1007/s10014-016-0271-7
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karsy M, Azab MA, Abou-Al-Shaar H, Guan J, Eli I, Jensen RL, et al. Klinisk potentiale ved meningiom genomisk indsigt: en praktisk gennemgang for neurokirurger. Neurosurg Focus. (2018) 44:E10. doi: 10.3171/2018.2.FOCUS1849
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Patel AJ, Wan YW, Al-Ouran R, Revelli JP, Cardenas MF, Oneissi M, et al. Molekylær profilering forudsiger meningiomrecidiv og afslører tab af DREAM-kompleksrepression i aggressive tumorer. Proc Natl Acad Sci USA. (2019) 116:21715-26. doi: 10.1073/pnas.1912858116
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Spille DC, Heß K, Sauerland C, Sanai N, Stummer W, Paulus W, et al. Brain invasion i meningiomer: incidens og korrelationer med kliniske variabler og prognose. World Neurosurg. (2016) 93:346-54. doi: 10.1016/j.wneu.2016.06.055
PubMed Abstract | CrossRef Full Text | Google Scholar
18. PiŽem J, Velnar T, Prestor B, Mlakar J, Popović M. Bedømmeligheden af hjerneinvasion i meningiomer er relateret til meningiomstørrelse og -grad og kan forbedres ved omfattende prøvetagning af den kirurgisk fjernede meningiomprøve. Clin Neuropathol. (2014) 33:354-63. doi: 10.5414/NP300750
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Maillo A, Orfao A, Espinosa AB, Sayagués JM, Merino M, Sousa P, et al. Tidlige recidiv i histologisk godartede/grad I-meningeomer er forbundet med store tumorer og sameksistens af monosomi 14 og del(1p36) i den forfædte tumorcelleklon. Neuro Oncol. (2007) 9:438-46. doi: 10.1215/15228517-2007-026
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Youngblood MW, Duran D, Montejo JD, Li C, Omay SB, Özduman K, Sheth AH, et al. Korrelationer mellem genomisk undergruppe og kliniske træk i en kohorte på mere end 3000 meningiomer. J Neurosurg. (2019). doi: 10.3171/2019.8.jns191266. .
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Chen WC, Magill ST, Wu A, Vasudevan HN, Morin O, Aghi MK, et al. Histopatologiske træk, der forudsiger lokal kontrol af atypiske meningiomer efter operation og adjuverende strålebehandling. J Neurosurg. (2019) 130:443-50. doi: 10.3171/2017.9.JNS171609
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Perry A, Stafford SL, Scheithauer BW, Suman VJ, Lohse CM. Den prognostiske betydning af MIB-1-, p53- og DNA-flowcytometri i fuldstændigt resecerede primære meningiomer. Cancer. (1998) 82:2262-9. doi: 10.1002/(SICI)1097-0142(19980601)82:11<2262::AID-CNCR23>3.0.CO;2-R
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Ohba S, Kobayashi M, Horiguchi T, Onozuka S, Yoshida K, Ohira T, et al. Long-term surgical outcome and biological prognostic factors in patients with skull base meningiomas: clinical article. J Neurosurg. (2011) 114:1278-87. doi: 10.3171/2010.11.JNS10701
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Soyuer S, Chang EL, Selek U, Shi W, Maor MH, DeMonte F. Stråleterapi efter operation for benignt hjernemeningeom. Radiother Oncol. (2004) 71:85-90. doi: 10.1016/j.radonc.2004.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Park S, Cha YJ, Suh SH, Lee IJ, Lee KS, Hong CK, et al. Risikogruppetilpasset adjuverende strålebehandling for WHO grade I og II kraniebasismeningeom. J Cancer Res Clin Oncol. (2019) 145:1351-60. doi: 10.1007/s00432-019-02891-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Budohoski KP, Clerkin J, Millward CP, O’Halloran PJ, Waqar M, Looby S, et al. Prædiktorer for tidlig progression af kirurgisk behandlede atypiske meningiomer. Acta Neurochir. (2018) 160:1813-22. doi: 10.1007/s00701-018-3593-x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. De La Monte SM, Flickinger J, Linggood RM. Histopatologiske træk, der forudsiger recidiv af meningiomer efter subtotal resektion. Am J Surg Pathol. (1986) 10:836-43. doi: 10.1097/00000478-198612000-00002
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Backer-Grøndahl T, Moen BH, Torp SH. Det histopatologiske spektrum af humane meningiomer. Int J Clin Exp Pathol. (2012) 5:231-42.
PubMed Abstract | Google Scholar
29. Rezanko T, Akkalp AK, Tunakan M, Sari AA. Metoder til tælling af MIB-1 i meningiomer og enighed blandt patologer. Anal Quant Cytol Histol. (2008) 30:47-52.
PubMed Abstract | Google Scholar
30. Pérez-Magán E, Campos-Martín Y, Mur P, Fiaño C, Ribalta T, García JF, et al. Genetiske ændringer, der er forbundet med progression og recidiv i meningiomer. J Neuropathol Exp Neurol. (2012) 71:882-93. doi: 10.1097/NEN.0b013e31826bff704
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Linsler S, Kraemer D, Driess C, Oertel J, Kammers K, Rahnenführer J, et al. Molekylærbiologiske bestemmelser af meningiom-progression og -recidiv. PLoS ONE. (2014) 9:e94987. doi: 10.1371/journal.pone.0094987
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Barbera S, Miguel TS, Gil-Benso R, Muñoz-Hidalgo L, Roldan P, Gonzalez-Darder J, et al. Genetiske ændringer med prognostisk værdi i histologisk godartede meningiomer. Clin Neuropathol. (2013) 32:311-7. doi: 10.5414/NP300580
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Gao F, Shi L, Russin J, Zeng L, Chang X, He S, et al. DNA-methylering i den maligne transformation af meningiomer. PLoS ONE. (2013) 8:e54114. doi: 10.1371/journal.pone.0054114
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Vengoechea J, Sloan AE, Chen Y, Guan X, Ostrom QT, Kerstetter A, et al. Methyleringsmarkører for malignt potentiale i meningiomer. J Neurosurg. (2013) 119:899-906. doi: 10.3171/2013.7.JNS13311
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Lu VM, Goyal A, Lee A, Jentoft M, Quinones-Hinojosa A, Chaichana KL. Den prognostiske betydning af TERT-promotermutationer i meningiomer: en systematisk gennemgang og metaanalyse. J Neurooncol. (2019) 142:1-10. doi: 10.1007/s11060-018-03067-x
PubMed Abstract | CrossRef Full Text | Google Scholar