Introduktion
Ris har en kompleks rodarkitektur med en blanding af embryonale og post-embryonale rødder. Radiklen kommer først frem under spiring, efterfulgt kort efter af embryonale koronarrødder (Rebouillat et al., 2009; Coudert et al., 2010). De første adventive post-embryonale rødder, der er et resultat af skud-apikal meristemaktivitet, dukker op nogle få dage efter kimningen af frøplanten. Adventivrødder kaldes også for koronar- eller kronrødder og produceres i hele plantens levetid.
Den indre risrodsanatomi er velbeskrevet, især i kimplantestadiet (Rebouillat et al., 2009). Flere koncentriske væv (fra periferien til stelen) er placeret mellem epidermis og de vaskulære væv (figur 1). Disse væv, der tilsammen kaldes “grundvæv”, omtales undertiden også som “cortex” (Lux et al., 2004). Her bibeholder vi den generiske betegnelse, dvs. grundvæv, for at beskrive de exodermale, sclerenchyma-, kortikale og endodermale væv. Vi henviser til “cortex” som det væv, der er placeret mellem endodermis og sclerenchyma.
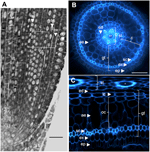
Figur 1. Anatomi af en 6 dage gammel Nipponbare-radikle. (A) Længdesnit af en radikyle fikseret og paraplast indlejret. Bar = 100 μm. (B) Tværsnit af en frisk radikyle observeret under UV-lys. Streg = 50 μm. (C) Polartransformeret billede af B. Vævslagene er mærket som følger: stele (st), grundvæv (gt) bestående af flere cellelag: et lag endodermis (ed), flere lag cortex (c), et lag sclerenchyma (sc) og et lag exodermis (ex). De endodermistiske (ed) og exodermistiske (ex) lag kan let identificeres ved fraværet/reduktionen af fluorescens i disse cellers cellevægscentre. Rodskuddet er beskyttet af et lag epidermis (ep). Der kan identificeres to typer kortikale lag: indre cortex (ic), som ligger ved siden af endodermis (ed), og ydre cortex (oc), som i sidste ende vil danne aerenchyma (ae). I stelen bemærkes tilstedeværelsen af et stort centralt metaxylem (cx) omgivet af 6 metaxylemkar (x).
Grundvæv består af flere lag af væv, der har samme parenkymatøse oprindelse, men forskellige specifikke egenskaber, som spiller forskellige og vigtige strukturelle og funktionelle roller i rødder. F.eks. er exodermis og endodermis apoplastiske barrierer, der kontrollerer den radiale transport af vand og næringsstoffer fra jorden til de fotosyntetiske organer, en funktion, der for det meste leveres af suberinlamellernes aflejring og sekundær cellevægsdifferentiering (Gregory, 2006). Sclerenchyma er lignificerede celler, som udgør en kritisk barriere for nogle metaller og muligvis spiller en mekanisk støttefunktion (Huang et al., 2012). I modsætning til disse tre monolagsvæv er det kortikale væv i risradiklen sammensat af fire eller fem lag. Dette væv, der også kaldes midterkortikalis eller mesodermis, er karakteriseret ved den skizogene dannelse af rum, der fører til dannelsen af aerenchyma i ris (Justin og Armstrong, 1991; Kawai et al., 1998). Aerenchyma spiller en vigtig rolle i tolerancen over for oversvømmelsesforhold og sikrer kontinuerlig iltstrøm fra skuddet til roden, hvilket muliggør rodvækst under anoxiske forhold. Cortex har en vigtig, men variabel funktion i rodfysiologien hos mange arter og er involveret i lagring, oversvømmelsestolerance eller symbiotiske interaktioner (Lux et al., 2004).
Radiklen og kronrødderne producerer tre typer siderødder: små siderødder (SLR) og to typer af store siderødder (Kawata og Shibayama, 1965; Kono et al., 1972; Rebouillat et al., 2009). Denne opdeling er baseret på (i) roddiameter: SLR er de mindste (50-60 μm) og L-LLR er de største (120-150 μm), (ii) forgreninger, som kun observeres på LLR, (iii) tilstedeværelsen af et centralt metaxylemkar kun i LLR og (iv) tilstedeværelsen af et sclerenchyma-lag kun i L-LLR (Kono et al., 1972; Kawata et al., 1977; Rebouillat et al., 2009). På trods af denne klassifikation er identiteten af indre rodvæv i laterale rødder, især SLR’er, fortsat usikker. Rebouillat et al. (2009) og Kawata et al. (1977) hævdede nemlig begge, at SLR-grundvæv bestod af endodermis, sclerenchyma og exodermis (fra indersiden mod ydersiden), mens det i Kono et al. (1972) blev det indre cortex sclerenchymatøse cellelag beskrevet som fraværende i SLR’er og T-LLR’er.
For at løse dette dilemma og for at studere udviklingen og funktionen af bestemte væv generelt er det nødvendigt at anvende identitetsmarkører. De fleste af de vævsmarkører, der hidtil er blevet anvendt, er morfologiske markører eller histokemiske farvestoffer, som har givet en nyttig måde at karakterisere celleidentitet på. Berberin afslører tilstedeværelsen af suberin i cellevægge, som næsten udelukkende findes i de caspariske strimler, der omgiver hver enkelt endodermiscelle, og som således er en god indirekte markør for endodermisidentitet (Brundett et al., 1988). I A. thaliana blev der også udviklet vævsspecifikke markører ved hjælp af vævsspecifikke promotorer, der er fusioneret med reportergener (GUS og/eller GFP) i genetisk modificerede planter. F.eks. anvendes SCARECROW-promotoren som en endodermal identitetsmarkør (Sugimoto et al., 2010). QC25 og QC46 enhancer trap GUS-linjer (Sabatini et al., 2003) og QHB i ris (Kamiya et al., 2003) blev også identificeret som QC-markører (quiescent center (QC)) på grundlag af deres QC-specifikke ekspression. På trods af interessen for disse markører er kun nogle få tilgængelige og næsten udelukkende i A. thaliana. De har også ulemper. For eksempel er det tvivlsomt, om det er hensigtsmæssigt at anvende SCARECROW (SCR)-promotoren (SCR) som en “endodermis”-markør, når specifikke spørgsmål om SCR- og SHORT ROOT (SHR)-roller i differentiering af jordvæv behandles. SCR- og SHR-generne er nemlig i sig selv involveret i endodermis/cortex-dannelse (Wu og Gallagher, 2014). I A. thaliana er de eneste tilgængelige rodcortexmarkører Co2- og Co3-promotorer (Heidstra et al., 2004; Ten Hove et al., 2010). I ris anvendes disse cortexmarkører endnu ikke, fordi der ikke findes nogen klare ortologer for Co2- og Co3-generne. Hidtil er der kun blevet anvendt indirekte morfologiske markører i ris, såsom aerenchyma-dannelse for kortikal identitet (Rebouillat et al., 2009).
En anden klasse af markører er kommercielt tilgængelige antistoffer rettet mod plantecellevægge (http://www.plantprobes.net/index.php). Disse markører er kun blevet anvendt i ringe grad tidligere, men deres effektivitet er blevet påvist. For eksempel blev CCRC-M2- og JIM13-cellevægsantistofferne anvendt i A. thaliana til at vise, at det enkelte lag af indre væv, der er til stede i shr-mutanten, havde kortikal identitet, mens jordvævslaget i scr-mutanten udviste flere identiteter (Di Laurenzio et al., 1996; Helariutta et al., 2000). Disse markører har mange fordele: deres enkelhed og muligheden for at kombinere sekundære antistoffer koblet til forskellige fluorochromer for at begrænse overlapning med autofluorescens, de kræver ikke genetisk transformation, og de kan bruges til at supplere andre klasser af markører.
I denne artikel beskriver vi først en simpel medium-throughput-protokol til immunmærkning af friske vibratomvævssnit. Ved hjælp af denne protokol screenede vi radiale sektioner af risradikler med et stort bibliotek af 174 cellevægsantistoffer. Blandt disse identificerede vi otte cortex-specifikke markører og påviste, at ris har to typer corticalvæv med forskellig identitet. Vi kaldte disse lag for den indre og ydre cortex på baggrund af deres respektive anatomiske placering i rodsektionerne. For at demonstrere nytten af disse cortex-specifikke markører afklarede vi jordvævsidentiteterne af siderødder ved hjælp af tre af disse antistoffer. Især i SLR’er viser vi, at det indre vævslag har en ydre kortikal identitet. Vores protokol er generisk nok til at kunne anvendes til udvikling af vævsmarkører i alle arter uden behov for at generere transgene planter. Denne protokol kan let tilpasses med friske skud, blade, rødder eller andre væv i andre planter og er en enkel og let måde at identificere vævsspecifikke markører på. Desuden kan disse markører anvendes sammen med andre molekylære markører.
Resultater
Immunoprofilering af cellevægsantistoffer i radiale sektioner af risrødder afslører specifikke antistoffer for kortikallagene
Med henblik på at identificere antistofbaserede markører for kortikale celler etablerede vi først en protokol til immunmærkning med medium gennemløb af radiale sektioner af friske risrødder (se materialer og metoder og supplerende figur 1 for detaljer). Derefter foretog vi en screening med monoklonale antistoffer, der er opdrættet mod cellevægskomponenter (fra Complex Carbohydrate Research Center (CarboSource Services, Athens Georgia, USA) og Paul Knox Cell Wall lab (University of Leeds, UK), se materialer og metoder for detaljer)) for at identificere cortexmarkører. Af de 174 testede antistoffer blev kun 12 tilbageholdt som formodentlig cortex-specifikke. Vi testede deres gentagelighed ved at udføre to yderligere eksperimenter og konkluderede, at otte antistoffer viste lignende og robuste profiler blandt de tre gentagelser (figur 2). Fem antistoffer (JIM7, M14, M38, M130 og M131) gav det samme immunmærkningsmønster i cortexen. Kun ikke-tilstødende cellevægge blev mærket, hvilket resulterede i en singulær “diamantformet” mærkning af alle kortikale celler. For de tre andre antistoffer (LM5, M133 og M107) blev mærkningen påvist i cortexen og nogle gange i sclerenchymacellerne, især med LM5- og M107-antistofferne. Signalet var homogent på cortexens cellevæg, men var meget svagere i de indre cortexlag (det lag af cortex, der støder op til det endodermale lag) end i de ydre cortexlag. Alle disse antistoffer med profiler, der er komplementære til kortikale væv, er således specifikke markører, der kan anvendes til at analysere kortikale cellers identitet. Desuden tyder de to forskellige kortikale mærker, der definerer to subkortikale områder, på, at de ydre og indre lag har en særskilt molekylær identitet, som blev afsløret af disse antistoffer.
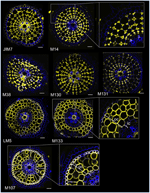
Figur 2. Identifikation af otte specifikke cortex-antistoffer (JIM7, M14, M38, M130, M131, LM5, M133 og M107) blandt de 174 screenede fra det monoklonale cellevægsantistofbibliotek. For hvert antistof blev der opnået sammenføjede billeder af tværsnit under et konfokalt mikroskop efter immunohistologisk mærkning: i gult, antistofmønster ved 561 nm, og i blåt, autofluorescens af cellevæggen under UV-lys. Fem antistoffer (JIM7, M14, M38, M130 og M131) viser en lignende profil inden for alle kortikale cellelag, der er farvet (diamantformede figurer). Tre antistoffer (LM5, M133 og M107) markerede kortikale cellevægge homogent. Bemærk, at for disse antistoffer er de indre kortikale (ic) lag ikke farvet sammenlignet med de ydre kortikale (oc) lag. Indsatse er nærbilleder af de tilsvarende billeder. Bars = 20 μm.
Nogle specifikke træk ved disse to subkortikale lag blev fremhævet, da plugin’et “polar transformer” i ImageJ-softwaren (http://imagej.nih.gov/ij/) blev brugt til at se billederne af rodsektionerne (figur 1B,C; Schneider et al., 2012; Lartaud et al., 2014). De indre celler var karakteriseret ved en tyk cellevæg sammenlignet med de ydre celler, som udviste forskellige luftholdige hulrum som følge af cellevægsfusion. De indre kortikale celler udviste også en fladtrykt form, der lignede endodermale celler, i modsætning til de ydre celler, som var rundere. På dette transformerede billede er den radiale cellevæg, dvs. væggen, der løber fra cellens inderside til ydersiden, autofluorescens af de endodermale og exodermale celler ikke synlig, formentlig på grund af tilstedeværelsen af Casparian-striber. På samme måde, men i mindre grad, var små huller uden autofluorescens også synlige på de radiale cellevægge i de indre kortikale celler.
Alle laterale rodtyper besidder kun ydre kortikalt væv
For at demonstrere kortikalmarkørernes anvendelighed og karakterisere celleidentiteterne mærkede vi de tre ris laterale rodtyper (L-LLR, T-LLR og SLR) med tre af disse antistoffer (M107, M133 og M14). Til dette forsøg blev der, da L-LLR’er ikke ofte udvikles på Petriskåle, indsamlet laterale rødder fra risfrøplanter, der var dyrket under hydroponiske forhold i 2 uger. Vi analyserede først grundvævsorganisationen af hver type lateralrod ved at observere autofluorescensen af cellevæggene i tværgående og polære visninger af rodsektionerne (figur 3). Denne første analyse afslørede en lidt forskellig intern radial anatomi for de tre typer siderødder. I lighed med radikalsektionerne set under UV-lys kan de endodermiske og exodermiske væv identificeres ved fluorescensudslukningen i midten af de radiale cellevægge. Disse to væv var til stede i alle siderødder. Mellem endodermis og exodermis var der flere vævslag til stede i L-LLR’erne og T-LLR’erne, mens SLR’erne kun havde et enkelt (uidentificeret) cellelag. L-LLR’ernes anatomi lignede seminalrødder, og uden for endodermis var flere lag af kortikalt væv let identificerbare, når der blev dannet aerenchymavæv. Desuden blev der også observeret et sclerenchyma-lag dannet af tæt pakkede celler med brede cellevægge. Afhængigt af forsøget var dette cellelag ikke altid fuldt udviklet. I T-LLR-snittene lignede det ydre lag kortikalt væv, og det indre lag lignede det enkelte (uidentificerede) SLR-lag.
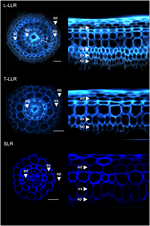
Figur 3. Vævsammensætning af de store lateralrodstyper (Large-LLR og Thin-LLR) og Small Lateral Root (SLR). Frøplanter blev dyrket under hydroponiske forhold i 2 uger. Autofluorescens af cellevæggen i tværsnit og polær transformeret visning under UV-lys. Vævene er mærket som følger: epidermis (ep), exodermis (ex), cortex (c), endodermis (ed). Bemærk, at epidermis (ep) ofte blev fragmenteret i løbet af forsøget. Bars = 20 μm.
For at identificere de cellelag, der er til stede i SLR- og T-LLR-grundvæv og for at bekræfte den kortikale identitet i L-LLR’erne, immunmærkede vi laterale rodsektioner med tre cortex-specifikke antistoffer (M107, M133 og M14; figur 4). M107- og M133-antistofferne mærkede alle cellelag beliggende mellem endodermis og exodermis i alle laterale rødder. Baseret på radikelfarvning for disse antistoffer indikerede denne observation, at disse cellelag kunne have sclerenchyma- eller kortikal identitet. Men det faktum, at M14 også immunmærkede disse lag, især i SLR-sektionerne, viser tydeligt, at disse lag havde ydre kortikal identitet.

Figur 4. Sammenføjede billeder af de store laterale rodtyper (Large-LLR og Thin-LLR) og sektioner af små laterale rødder (SLR) immunmærket med M107, M133 og M14. Frøplanter blev dyrket under hydroponiske forhold i 2 uger. I gult, antistofmærkning ved 561 nm, og i blåt, autofluorescens under UV-lys. Vævene er mærket som følger: epidermis (ep), exodermis (ex), cortex (c), endodermis (ed). Bemærk, at epidermis (ep) ofte blev fragmenteret i løbet af forsøget. Bars = 20 μm.
Variationer i antallet af ydre kortikale cellelag (et i SLR’erne, to i T-LLR’erne, tre i L-LLR’erne og fire til fem i radiklen) spiller en stor rolle for risrodsdiametrene (figur 5).
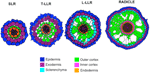
Figur 5. Skematisk fremstilling af siderod- og radikulvæv.
Konklusioner
Der er allerede blevet anvendt forskellige betegnelser for at kvalificere subkortikale områder i planter. For eksempel er tilstedeværelsen af et “indre” lignificeret cortexlag, der kan sammenlignes med det, der er undersøgt her, allerede blevet beskrevet i vild ris (Yang et al., 2014). I majs er de to kortikale domæner defineret anderledes (Baluška et al., 1993). Det “indre” domæne danner aerenchyma, svarende til den ydre cortex her, og den “midterste- yderste” cortex er et lignificeret støttevæv, som kunne være sclerenchyma. I Arabidopsis er der også blevet beskrevet et “midterste cortex”-cellelag, der er placeret mellem det kortikale monolag og endodermis (Baum et al., 2002; Paquette og Benfey, 2005). Nylige resultater tyder på, at dette cortexlag, hvis dannelse reguleres af bl.a. GA, oxidativ stress og SHR og SCR, spiller en rolle i abiotisk tolerance (Paquette og Benfey, 2005; Cui og Benfey, 2009; Pauluzzi et al., 2012; Wu og Gallagher, 2014). Interessant nok er dette lag også beskrevet som et spirallignende lag med en typisk form (Baum et al., 2002). Kunne dette Arabidopsis “midterste cortex” lag være funktionelt og strukturelt svarende til det indre cortexlag i risradiklen? I langsgående og tværgående snit af ris danner det indre kortikallag også normalt en helix, hvilket tyder på, at disse to vævslag kan være sammenlignelige. I Arabidopsis er det “midterste cortex”-lag afledt af en endodermis periklinal division, som fremkommer væk fra QC mellem 7 og 14 dage efter spiring (Paquette og Benfey, 2005). Det vil være nødvendigt med nye værktøjer for at verificere disse vigtige parametre i ris. For eksempel er ingen mutant, der påvirker tidspunktet for dannelsen af dette lag, blevet beskrevet indtil nu. Desuden er der også behov for tekniske fremskridt med hensyn til billeddannelse af risens QC. Ikke desto mindre tilbyder vores cortex-specifikke markører et nyt værktøj til at sammenligne funktionen og det molekylære netværk, der er involveret i dannelsen af den indre cortex (ris) i forhold til “midterste cortex” (Arabidopsis). Arbejdet er i gang i vores laboratorium for at identificere de molekylære determinanter af indre og ydre cortex-dannelse, med SCR og SHR ris ortologer som de første kandidater til regulering af cortex-dannelse i risrødder (Pauluzzi et al, 2012).
Materialer og metoder
Plantmateriale
Seks dage gamle frøplanter
Sæd af Oryza sativa L. ssp. japonica Nipponbare cultivar blev dyrket lodret i sterile petriskåle (Corning, 431301; 20 × 20 cm) under kontrollerede forhold (dag/nat-rytme: 12/12 timer, 28/25 °C, lysintensitet: 500 μE m-2 s-1). Først blev frøene overfladesteriliseret ved at skylle dem i 70 % ethanol i ~1 minut. Derefter blev ethanol erstattet af en opløsning bestående af 40% blegemiddel i destilleret vand indeholdende tre dråber tween 80 (Sigma-Aldrich P4780-500 mL). Frøene blev lagt i blød i denne opløsning i 30 minutter under let omrøring og derefter skyllet mindst fire gange med sterilt destilleret vand. Varmt (~50°C) autoklaversteriliseret halvstærkt Murashige og Skoog (MS/2)-medium (250 mL) hældes i Petriskåle og lader det størkne i ~45 min. Det faste MS/2-medium består af 2,15 g.L-1 af MS-mediets basalsaltblanding (Duchefa Biochemie, M0221), 75 mg.L-1 af MS-vitaminblanding (Duchefa Biochemie, M0409) og 8 g.L-1 agarose type II (Sigma-Aldrich, A6877). Sterile frø skubbes derefter ned i det størknede MS/2-medium med radiklen orienteret nedad. Rødderne blev høstet efter 6 vækstdage.
Fire uger gamle planter
Efter 3 dages spiring i vand blev kimplanterne overført til et hydroponisk system under kontrollerede forhold (dag/nat-rytme: 12/12 h, 28/25°C, lysintensitet: 500 μE m-2 s-1, relativ luftfugtighed: 55%). Det hydroponiske system består af en 50 L plastkasse med 30 L hydroponisk opløsning, hvorpå der er lagt en 1 cm tyk skummadras. Skummadrassen er gennemboret med huller for at bevare kimplanternes stammefødder. Det hydroponiske medium består af (NH4)2SO4 (0,5 mM), MgSO4.7H2O (1,6 mM), Ca(NO3)2.4H2O (1,2 mM), KNO3 (0,7 mM), FeSO4 (0,1 mM), Na2EDTA (0,1 mM), MNSO4 (0,1 mM), MnSO4. H2O (1,7 μM), (NH4)6Mo7O24.4H2O (0,2 μM), ZnSO4.7H2O (0,2 μM), CuSO4.5H2O (0,2 μM), H3BO3 (1,4 μM) og KH2PO4 (0,6 mM). Opløsningen luftes med en pumpe, der er placeret i bunden af plastkassen, og udskiftes hver 10. dag. pH-værdien blev justeret og holdt på 5,4 ± 0,2.
Friske rodsektioner
Toppene af voksende radikler eller siderødder (2 cm) blev skåret af med en skarp kniv og placeret parallelt med hinanden for at tilpasse rodspidserne (Supplerende figurer 1A,B). De blev indlejret i en dråbe 3% smeltet agarose (50°C; Supplerende figur 1C). Patches med rodspidser blev indsat i en 3 × 1 × 1 cm brønd fyldt med 3 % smeltet agarose (Supplerende figur 1D). Efter størkning blev blokkene ændret i størrelse og limet på en vibratomplade for at blive skåret i skiver. Parametrene for vibratomet (Hm650v (Thermo Scientific Microm)) var hastighed 30, frekvens 70, amplitude 0,8 og tykkelse 60 μm (Supplerende figur 1E). Sektionerne blev overført enten på kammerglas (Lab-teak 177402) til immunfarvning (Supplerende figur 1F) eller på glas, der var befugtet med 1X alkalisk fosfatbuffer (PBS, Sigma-Aldrich P3813) til observation.
Immunolokalisering
Sektionerne placeret på kammerglassene (tre pr. kammer) blev først skyllet i 0,1 M glycin suppleret med 1X PBS og derefter to gange i 1X PBS, hver i 10 minutter. Vævene blev derefter nedsænket i en PBS-opløsning indeholdende 5% bovin føtal serum (blokeringsopløsning, Thermo Fisher 37520) ved 4°C natten over under omrøring. Primære antistoffer, fortyndet 1/10 i denne blokeringsopløsning, blev påført natten over ved 4 °C under omrøring. Sektionerne blev derefter skyllet 3 gange i PBS 1X i 10 minutter. Rodsektionerne blev inkuberet i 2 timer med det sekundære antistof fortyndet 500 gange i blokeringsopløsning under omrøring. Disse antistoffer var koblet til en fluorofor, Alexa 546 antirotte-antistof (Invitrogen A11081) eller Alexa 546 anti-mus-antistof (Invitrogen A11060). Derefter blev sektionerne skyllet igen tre gange i 1X PBS under omrøring i 10 minutter hver gang. Kamrene blev fjernet, og der blev tilsat nogle få dråber mowiol-monteringsmedie (Sigma-Aldrich 81381). Der blev anbragt et dækglas på rodsektionerne, som fik lov til at tørre i 36 timer ved 4°C i mørke.
Paraplastfiksering
Radikler, der var dyrket på petriskåle i 6 dage, blev fikseret i 4% paraformaldehyd (i PBS 1X) natten over ved 4°C og skyllet to gange med PBS 1X (Jackson, 1991). De fikserede væv blev dehydreret i ethanol, renset i Histochoice Clearing Agent (HistoClear, Sigma Aldrich) og indlejret i Paraplast (Fisher). Vævene blev snittet (6 μm tykkelse) på et Leica RM2255-mikrotom og monteret på SuperfrostPlus-dias (Fisher).
Mikroskopi
Højfelt- og autofluorescensobservationer blev udført ved hjælp af et Leica DM4500-mikroskop. For autofluorescens blev billederne taget med “A”-filterkuben (excitationsområde: UV; excitationsfilter: A: BP 340-380; undertrykkelsesfilter: A: LP 425). Immunfarvede sektioner blev observeret med konfokale mikroskoper: Zeiss LSM 510 eller Leica SP8. Cellevæggene blev først visualiseret ved hjælp af autofluorescens . Det sekundære antistof blev visualiseret ved hjælp af en Helium/Neon-laser ved henholdsvis 543 eller 561 nm. Billeder blev taget med et Retiga 2000R farvekamera (QIMAGING, Canada) med Volocity billedindsamlingssoftware (Improvision, UK).
Author Contributions
SH, FD, MB, CB: indsamling af data; SH, CP, AD analyse af data; SH, EG, CP, AD: udarbejdelse af manuskriptet.
Interessekonflikterklæring
Forfatterne erklærer, at forskningen blev udført i fravær af kommercielle eller finansielle relationer, der kunne opfattes som en potentiel interessekonflikt.
Anerkendelser
Vi takker MRI (Montpellier RIO Imaging plateform), PHIV og La Gaillarde Plateforms for deres tekniske støtte til immunolokalisering og/eller konfokal og multiphoton billeddannelse. SH er støttet af et CIRAD ph.d.-stipendium.
Supplementært materiale
Det supplerende materiale til denne artikel kan findes online på: https://www.frontiersin.org/article/10.3389/fpls.2015.01139
Abkortelser
ae, aerenchyma; c, cortex; ed, endodermis; ep, epidermis; ex, exodermis; gt, grundvæv; ic, indre cortex; L-LLR, Large-type Large Lateral Root; oc, ydre cortex; sc, sclerenchyma; SLR, Small Lateral Root; st, stele; T-LLR, Thin-type Large Lateral Root; x, xylem.
Baluška, F., Brailsford, R. W., Hauskrecht, M., Jackson, M. B., og Barlow, P. W. (1993). Cellulær dimorphisme i majsens rodcortex: inddragelse af mikrotubuli, ethylen og gibberellin i differentieringen af den cellulære adfærd i postmitotiske vækstzoner. Bot. Acta 106, 394-403. doi: 10.1111/j.1438-8677.1993.tb00766.x
CrossRef Full Text | Google Scholar
Baum, S. F., Dubrovsky, J. G., og Rost, T. L. (2002). Apikal organisation og modning af cortex og vaskulær cylinder i Arabidopsis thaliana (Brassicaceae) rødder. Am. J. Bot. 89, 908-920. doi: 10.3732/ajb.89.6.908
PubMed Abstract | CrossRef Full Text | Google Scholar
Brundett, M. C., Enstone, D. E., og Peterson, C. A. (1988). En berberin-anilinblå fluorescerende farvningsprocedure for suberin, lignin og callose i plantevæv. Protoplasma 146, 133-142. doi: 10.1007/BF01405922
CrossRef Full Text | Google Scholar
Coudert, Y., Périn, C., Courtois, B., Khong, N. G., og Gantet, P. (2010). Genetisk kontrol af rodudvikling i ris, modelkorn. Trends Plant Sci. 15, 219-226. doi: 10.1016/j.tplants.2010.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., og Benfey, P. N. (2009). Samspil mellem SCARECROW, GA og LIKE HETEROCHROMATIN PROTEIN 1 i grundvævsmønsteret i Arabidopsis-roden. Plant J. 58, 1016-1027. doi: 10.1111/j.1365-313X.2009.03839.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Laurenzio, L., Wysocka-Diller, J., Wysocka-Diller, J., Malamy, J. E., Pysh, L., Helariutta, Y., Freshour, G., et al. (1996). SCARECROW-genet regulerer en asymmetrisk celledeling, der er afgørende for at generere den radiale organisation af Arabidopsis-roden. Cell 86, 423-433. doi: 10.1016/S0092-8674(00)8011515-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Gregory, P. J. (2006). Plante rødder: Vækst, aktivitet og interaktion med jordbunden. Oxford; Ames, IA: Blackwell Pub.
Google Scholar
Heidstra, R., Welch, D., og Scheres, B. (2004). Mosaikanalyser ved hjælp af markerede aktiverings- og deletionskloner dissekerer Arabidopsis SCARECROW-aktion i asymmetrisk celledeling. Genes Dev. 18, 1964-1969. doi: 10.1101/gad.305504
PubMed Abstract | CrossRef Full Text | Google Scholar
Helariutta, Y., Fukaki, H., Wysocka-Diller, J., Nakajima, K., Jung, J., Sena, G., et al. (2000). SHORT-ROOT-genet styrer radial mønstring af Arabidopsis-roden gennem radial signalering. Cell 101, 555-567. doi: 10.1016/S0092-8674(00)80865-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, C. F., Yamaji, N., Ono, K., og Ma, J. F. (2012). Et leukinrigt gentagelsesreceptorlignende kinase-gen er involveret i specifikationen af ydre cellelag i risrødder. Plant J. 69, 565-576. doi: 10.1111/j.1365-313X.2011.04824.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, D. (1991). “In-situ hybridisering i planter” i Molekylær plantepatologi: A Practical Approach, eds D. J. Bowles, M. McPherson, and S. J. Gurr (Totowa, NJ: Humana Press), 163-174.
Google Scholar
Justin, S. H. F. W., and Armstrong, W. (1991). Bevis for ethylens inddragelse i aerenchyma-dannelse i adventive rødder af ris (Oryza sativa L.). New Phytol. 118, 49-62. doi: 10.1111/j.1469-8137.1991.tb00564.x
CrossRef Full Text | Google Scholar
Kamiya, N., Nagasaki, H., Morikami, A., Sato, Y., og Matsuoka, M. (2003). Isolering og karakterisering af et homeobox-gen af ris af WUSCHEL-typen, der udtrykkes specifikt i de centrale celler i et hvilende center i det rod-apikale meristem. Plant J. 35, 429-441. doi: 10.1046/j.1365-313X.2003.01816.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kawai, M., Samarajeewa, P. K., Barrero, R. A., Nishiguchi, M., og Uchimiya, H. (1998). Cellulær dissektion af nedbrydningsmønsteret for kortikal celledød under aerenchyma-dannelse i risrødder. Planta 204, 277-287. doi: 10.1007/s004250050257
CrossRef Full Text | Google Scholar
Kawata, S., Sasaki, O., og Yamazaki, K. (1977). Om strukturen af kronrødder og siderødder og karforbindelsen mellem dem hos risplanter. Jpn. J. Crop. Sci. 46, 569-579. doi: 10.1626/jcs.46.569
CrossRef Full Text | Google Scholar
Kawata, S., og Shibayama, B. (1965). Om dannelsen af lateralrodsprimordier i risplantens kronerødder. Proc. Crop Sci. Soc. Jpn. 33, 423-431. doi: 10.1626/jcs.33.423
CrossRef Full Text | Google Scholar
Kono, Y., Igeta, M., og Yamada, N. (1972). Undersøgelser af den udviklingsfysiologiske udvikling af siderødder i risens seminalerødder. Jpn. J. Crop. Sci. 41, 192-204. doi: 10.1626/jcs.41.192
CrossRef Full Text
Lartaud, M., Perin, C., Courtois, B., Thomas, E., Henry, S., Bettembourg, M., et al. (2014). PHIV-RootCell: et overvåget billedanalyseværktøj til kvantificering af anatomiske parametre for risrødder. Front. Plant Sci. 5:790. doi: 10.3389/fpls.2014.00790
PubMed Abstract | CrossRef Full Text | Google Scholar
Lux, A., Luxova, M., Abe, J., og Morita, S. (2004). Rodcortex: strukturel og funktionel variabilitet og reaktioner på miljøstress. Root Res. 13, 117-131. doi: 10.3117/rootres.13.117
CrossRef Full Text | Google Scholar
Paquette, A. J., og Benfey, P. N. (2005). Modning af grundvævet i roden reguleres af gibberellin og SCARECROW og kræver SHORT-ROOT. Plant Physiol. 138, 636-640. doi: 10.1104/pp.104.058362
PubMed Abstract | CrossRef Full Text | Google Scholar
Pauluzzi, G., Divol, F., Puig, J., Guiderdoni, E., Dievart, A., og Périn, C. (2012). Surfing along the root ground tissue gene network. Dev. Biol. 365, 14-22. doi: 10.1016/j.ydbio.2012.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rebouillat, J., Dievart, A., Verdeil, J., Escoute, J., Giese, G., Breitler, J., et al. (2009). Molekylær genetik af risens rodudvikling. Rice 2, 15-34. doi: 10.1007/s12284-008-9016-5
CrossRef Full Text | Google Scholar
Sabatini, S., Heidstra, R., Wildwater, M., og Scheres, B. (2003). SCARECROW er involveret i positionering af stamcellens niche i Arabidopsis rodmeristem. Genes Dev. 17, 354-358. doi: 10.1101/gad.252503
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, C. A., Rasband, W. S., og Eliceiri, K. W. (2012). NIH Image til ImageJ: 25 år med billedanalyse. Nat. Methods 9, 671-675. doi: 10.1038/nmeth.2089
PubMed Abstract | CrossRef Full Text | Google Scholar
Sugimoto, K., Jiao, Y., og Meyerowitz, E. M. (2010). Arabidopsis regenerering fra flere væv sker via en rodudviklingsvej. Dev. Cell 18, 463-471. doi: 10.1016/j.devcel.2010.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Ten Hove, C. A., Willemsen, V., de Vries, W. J., Van Dijken, A., Scheres, B., og Heidstra, R. (2010). SCHIZORIZA koder for en nuklear faktor, der regulerer asymmetri af stamcelledelinger i Arabidopsis-roden. Curr. Biol. 20, 452-457. doi: 10.1016/j.cub.2010.01.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., og Gallagher, K. L. (2014). Bevægelsen af den ikke-celleautonome transkriptionsfaktor, SHORT-ROOT, er afhængig af endomembransystemet. Plant J. 80, 396-409. doi: 10.1111/tpj.12640
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Zhang, X., Li, J., Bao, M., Ni, D., og Seago, J. L. (2014). Anatomi og histokemi af rødder og skud i vild ris (Zizania latifolia Griseb.). J. Bot. 2014, 9. doi: 10.1155/2014/181727
CrossRef Full Text | Google Scholar