Introduktion
Hepatitis B-virus (HBV) infektion er den mest almindelige årsag til levercirrose og hepatocellulært karcinom i de fleste dele af Asien.1,2 Patogenesen af kronisk hepatitis er medieret af interaktionen mellem værtens immunreaktion og hepatocytterne, der præsenterer HBV-antigener.3,4 Tidligere undersøgelser har vist, at ekspressionen af HBV-antigener i hepatocytter har en vigtig sammenhæng med stadiet og aktiviteten af kronisk leversygdom. I immuntolerancefasen findes hepatitis B-kerneantigener (HBcAg) hovedsagelig i kernen og korrelerer med HBV-replikation, mens der i den efterfølgende immunclearingfase sker en intrahepatisk forskydning af HBcAg fra kernen til cytoplasmaet, hvilket er forbundet med den histologiske aktivitet af kronisk hepatitis5,6 . I tilfælde af intrahepatisk ekspression af hepatitis B-overfladeantigen (HBsAg) er der rapporteret om tre mønstre – homogen type, type I ground glass hepatocyte (GGH) og type II GGH. Homogene mønstre i grupperede, diskrete eller svage præsentationer er blevet observeret hos patienter med høj viremi eller aktiv hepatitis. Type I GGH’er er typisk spredt enkeltvis i hepatiske lobuli med inklusionslignende tæt homogen ekspression, mens type II GGH’er udtrykker overfladeantigener i periferien af hepatocytter, som grupperes i grupper, og er generelt til stede i den lave replikationsfase og bliver fremherskende fra aktiv hepatitis til levercirrhose og hepatocellulært karcinom7 .-10 Derfor er både intrahepatiske HBcAg- og HBsAg-ekspressioner tæt forbundet med det naturlige forløb af infektion og HBV-replikation.
Af faserne af kronisk hepatitis B forekommer immunopklaringsfasen eller kaldet HBeAg-positiv kronisk hepatitis B ofte i yngre befolkningsgrupper, udviser mindre alvorlige histologiske aktiviteter og har færre forekomster af precore A1896-mutationer og basal core promoter (BCP) T1762/A1764-mutationer end HBeAg-negativ kronisk hepatitis B.11-14 Forløbet af kronisk hepatitis B er dynamisk som følge af interaktion mellem viral replikation og værtens immunsystem. Derfor observeres der ofte forskellige kliniske træk eller histologiske aktiviteter hos HBeAg-positive patienter. For eksempel udviser 34 til 55 % af patienterne brofibrose eller cirrose i leverhistologi, mens de resterende patienter udviser mild fibrose.15,16 HBsAg-akkumulering i hepatocytter er blevet vist at være forbundet med specifikke virale mutationer og relateret til sygdomsaktivitet.8,9 Det er interessant at undersøge karakteristika for intrahepatisk HBsAg-ekspression hos patienter med forskellig sværhedsgrad af leverhistologi.
Virale mutanter udvikles normalt under pres fra værtens immunovervågning. Blandt naturligt forekommende HBV-mutanter blev BCP T1762/A1764-mutationer udbredt i takt med sygdomsprogressionen og er ofte blevet fundet forbundet med fremskreden leversygdom og hepatocellulært karcinom.17,18 Mønstrene for intrahepatisk HBsAg-ekspression ændrede sig også i løbet af det naturlige forløb af kronisk hepatitis B. Forbindelsen mellem BCP T1762/A1764-mutationer og intrahepatisk HBsAg-ekspression er stadig ukendt og skal undersøges.
Derfor var formålet med denne undersøgelse at evaluere funktionerne af intrahepatisk HBsAg-ekspression og analysere sammenhængen med leverhistologi, virale replikationsmarkører og HBV-mutanter i HBeAg-positiv kronisk hepatitis B.
Materiale og metoderPatienter
I alt 181 behandlingsnaive hepatitis B e antigen (HBeAg)-positive patienter, der opfyldte inklusionskriterierne, blev retrospektivt indskrevet i denne undersøgelse. Inklusionskriterierne var en alder på over 18 år og mindre end 70 år, positiv serum HBsAg i mere end 6 måneder og serum HBV DNA niveau ≥ 100.000 kopier/mL, unormalt serum alaninaminotransferase niveau, ingen anden forklarlig ætiologi af kronisk hepatitis, herunder alkohol, autoimmun hepatitis eller markører for hepatitis C-virus, hepatitis D-virus eller infektion med humant immundefektvirus, og mangel på anti-HBV-behandlingshistorik og leverbiopsiprøver til histologisk vurdering. Serum og leverbiopsi af alle patienterne blev udtaget før antivirale behandlinger, og prøverne blev opbevaret ved -70 oC indtil testning. Denne undersøgelse blev godkendt af Institutional Review Board of National Cheng Kung University Hospital (nr.: ER-99-398). Der blev indhentet informeret samtykke i henhold til Helsinki-erklæringen.
HBV-virologiske analyser
HBV-genotyping blev udført ved multiplex-polymerasekædereaktion, som beskrevet andetsteds.19 HBV-DNA-niveauet i serum blev målt ved hjælp af COBAS Amplicor HBV Monitor-testen (COBAS-AM assay, Roche Diagnostics, Branchburg, NJ). Serum HBsAg-niveauet blev kvantificeret ved Abbott Architect HB-sAg QT (Abbott Diagnostics, Rungis, Frankrig) med et dynamisk område på 0,05-250,0 IU/mL. Prøver med HBsAg-niveauer > 250 IU/mL blev testet igen ved fortyndinger på 1:20 og 1:1000.
Polymerasekædereaktion og sekventering af precore- og BCP-regioner
HBV-DNA blev ekstraheret fra 50 μL serum ved hjælp af Blood and Tissue Genomic Mini Kit (VIOGENE, Taipei, Taiwan). Første runde PCR blev udført under følgende betingelser: 96 oC i 2 min, 94 oC i 1 min, 54 oC i 1 min og 72 oC i 2 min med primere 5′-ACCTCTCTGCACGTAGCATGG (fremad) og 3′-GGATTAAAGACACAGAGGTACAGTACAGTAGAAG (omvendt). Anden runde PCR blev udført under de samme betingelser med primerne 5′-ATGTCTCAACGACACCGACCTTGA (fremad) og 3′-TTCCCACCTTATGAGGAGTCCAAG (omvendt). Rensede PCR-produkter blev derefter direkte sekventeret ved hjælp af en automatiseret DNA-sekventeringsmaskine ABI 310 og ABI PRISM Big Dye Terminator Cycle Sequencing Ready Reaction Kit (Applied Biosystems) med den fremadrettede primer, der blev anvendt under anden runde PCR.
Leverhistologi
Leverhistologi blev vurderet af en enkelt patolog, som ikke kendte patienternes baggrunde. Nekroinflammation og fibrose blev vurderet på grundlag af henholdsvis Knodell-nekroinflammationsgraden (fra 0 til 18)20 og Ishak-fibrosestadiet (fra 0 til 6)21.
Immunohistokemisk farvning blev udført som beskrevet andetsteds.22 Kort fortalt blev deparaffiniserede 5 μm tykke sektioner inkuberet med monoklonalt mus anti-HBsAg (klon 3E7, Dako Corp., Carpinteria,USA) og anti-HBcAg (Novocastra Laboratories, Newcastle, UK) natten over ved 4°C. Den optimale fortynding af anti-HBsAg eller anti-HBcAg blev bestemt ved hjælp af levervæv fra HBV-bærer som positiv kontrol. StrAviGen Super Sensitive MultiLink Kit (BioGenex) blev anvendt til at påvise det resulterende immunkompleks. Peroxidaseaktivitet blev visualiseret ved hjælp af et aminoethylcarbazol-substratkit (Zymed Laboratory, Inc., San Francisco, CA). Endelig blev sektionerne kontrafarvet med hæmatoxylin. Som negativ kontrol blev det primære antistof i inkubationen erstattet af ikke-immunt musemunoglobulin. Mønstre af HBcAg-ekspression i kernen, cytoplasmaet eller begge dele blev registreret. Mønstre af HBsAg-ekspression blev klassificeret som homogene, type I GGH, type II GGH.22 Homogent farvede hepatocytter blev identificeret som hepatocytter med moderat til stærk homogen cytoplasmatisk farvning; type I GGH’er blev identificeret som hepatocytter med tæt globulær eller “inklusionslignende” farvning, og type II GGH’er blev identificeret som hepatocytter med overfladeantigenfarvning ved cellegrænserne eller i periferien.6,22 Type I GGH’er spredes enkeltvis eller grupperer sig i hepatiske lobuli, mens type II GGH’er konsekvent grupperer sig i knuder. Ekspressionsniveauet af HBcAg og HBsAg blev scoret semikvantitativt i henhold til andelen af immunmærkede celler på en skala fra 0 til 4+, svarende til positivitet i 0, 1-10, 11-25, 25-50% og mere end 50% af de undersøgte hepatocytter.
Statistiske analyser
Data blev udtrykt som gennemsnit ± standardafvigelse. Kontinuerlige variabler blev sammenlignet ved hjælp af Mann-Whitney U-test eller Kruskal-Wallis ANOVA for univariat analyse. Kategoriske variabler blev analyseret ved hjælp af χ2-test eller Fisher’s exact-test. Uafhængige faktorer, der var forbundet med niveauer af intrahepatisk HBsAg-ekspression, blev udført ved hjælp af multivariat logistisk regressionsanalyse. Databehandling og statistiske analyser blev udført ved hjælp af SPSS-software til Windows, version 17.0 (SPSS Inc., Chicago, IL).
ResultaterKarakteristik af de tilmeldte patienter
Tabel 1 viser de demografiske karakteristika for de 181 tilmeldte patienter. De fleste af patienterne var mænd (69,1 %), og 63,0 % af dem udviste HBV-genotype C. Precore A1896-mutationen blev påvist hos 20 patienter (11,0 %) og BCP T1762/A1764-mutationerne blev påvist hos 38 patienter (21,0 %). Af de 181 patienter blev der påvist positiv HB-sAg-farvning hos 105 patienter (58,0 %). Patienter med HBsAg-farvning udviste signifikant højere serum HBsAg (P
Kliniske, virologiske og histologiske karakteristika for de 181 patienter.
| Karakteristika | Værdi | |||
|---|---|---|---|---|
| HBsAg-ekspression | P-værdi | |||
| Alle patienter (n = 181) | Negativ (n = 76) | Positiv (n = 105) | ||
| Alder (år) ± SD | 36.4 ± 10.5 | 34.2 ± 9.2 | 38.0 ± 11.2 | 0.009 |
| Genre (mand/kvinde) | 125/56 | 50/26 | 75/30 | 0.418 |
| Middel AST-niveau (U/L) ± SD | 59,7 ± 51,2 | 58,7 ± 42,5 | 60,5 ± 56.8 | 0,634 |
| Middel ALT-niveau (U/L) ± SD | 116,3 ± 124,2 | 120,2 ± 100,8 | 113,5 ± 139.1 | 0,282 |
| HBV-genotype (B/C) | 114/67 | 66/10 | 48/57 | |
| Precore: G1896/A1896 | 20/161 | 13/63 | 7/98 | 0.027 |
| BCP:* mutant/vildt | 38/143 | 12/64 | 26/79 | 0,144 |
| HBV-DNA (log kopier/mL) | 8,4 ± 1.1 | 4,0 ± 0,7 | 4,3 ± 0,7 | |
| HBsAg-niveau ((log IU/mL) | 4,2 ± 0.7 | 8,1 ± 1,0 | 8,6 ± 1,1 | 0,003 |
| Medie Knodell necroinflammationsgrad ± SD | 5.0 ± 3,0 | 5,3 ± 2,8 | 4,7 ± 3,0 | 0,128 |
| Middel Ishak fibrosestadium ± SD | 1,8 ± 1,6 | 1,7 ± 1,2 | 1,9 ± 1,7 | 0.703 |
Mutant, T1762 og A1764; vild, A1762 og T1764. χ2-test blev anvendt til variabler for køn, HBV-genotype, precore- og basal core-promotor-mutationer, mens Mann-Whitney U-test blev anvendt til andre variabler. AST: aspartataminotransferase. ALT: alaninaminotransferase. BCP: basal core promoter. HBV: hepatitis B-virus.
Distributionsmønstre for HBsAg-ekspression
Med hensyn til de 105 patienter, der udviste HBsAg-ekspression, blev der påvist et homogent mønster (figur 1A) hos 34 (32.4%) patienter, type I GGH (Figur 1B) blev påvist hos 50 (47,6%), type II GGH (Figur 1C) blev påvist hos syv (6,7%) patienter, og et blandet mønster blev påvist hos 14 (13,3%) patienter. Som det fremgår af tabel 2, blev der observeret en højere prævalens af BCP T1762/A1764-mutationer i type II GGH (P = 0,001) sammenlignet med andre mønstre. Der var et gensidigt forhold mellem HBsAg-ekspression og virale replikationsmarkører i serum. I figur 1D ses det, at patienter med type II GGH-ekspression havde lavere HBV-DNA-niveauer og HBsAg-titre, men højere intrahepatiske HBsAg-ekspressionsniveauer (figur 1D). Desuden viste leverhistologi viste type II GGH udviste signifikant mere alvorlig levernekroinflammation og fibroseaktiviteter og et højere niveau af intrahepatisk HBsAg-ekspression (figur 1E).
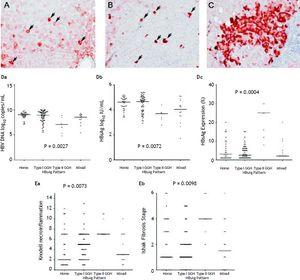
Indholdelsesmønstre af HBsAg. A. Nogle moderat til stærkt homogent cytoplasmafarvede HBsAg-farvede hepatocytter (pile) på en baggrund af svagt farvede hepatocytter. Kernen i hver homogent farvet hepatocyt var placeret i midten af cellen. B. Type I hepatocytter af typen “ground glass hepatocyte” (GGH) med tæt globulær eller “inklusionslignende” HBsAg-farvning (pile) var spredt i leverparenkymet. C. En klynge af type II GGH’er viste HBsAg-farvning ved cellekanten eller i periferien. Korrelationer mellem HBsAg-ekspressionsmønstre og serum HBV DNA-niveau (Da), serum HBsAg-niveau (Db) og intrahepatisk HBsAg-ekspressionsniveau (Dc). Sammenhængen mellem HBsAg-ekspressionsmønstre og Knodell-nekroinflammationsgrad (Ea) og Ishake fibrosestadium (Eb). Sammenligninger mellem grupper blev analyseret ved Kruskal-Wallis ANOVA.
Demografiske karakteristika efter fordelingsmønstre f HBsAg-ekspression.
| HBsAg-mønster (n = 105) | |||||||
|---|---|---|---|---|---|---|---|
| Mixed (n = 14) | Homogent | Type I GGH | Type II GGH | P-værdi | |||
| (n = 34) | (n = 50) | (n = 7) | |||||
| Alder (år) ± SD | 36.3 ± 9.2 | 36.3 ± 10.0 | 39.2 ± 12.7 | 40.0 ± 7.9 | 0.104 | ||
| Køn (mand/kvinde) | 11/3 | 26/11 | 35/15 | 6/1 | 0.720 | ||
| Middel AST-niveau (U/L) ± SD | 64,9 ± 56,5 | 61,1 ± 38,6 | 49,9 ± 28,3 | 122.4 ± 168,7 | 0,474 | ||
| Middel ALT-niveau (U/L) ± SD | 116,7 ± 112,4 | 114,6 ± 91,1 | 91,5 ± 63,8 | 259,1 ± 447.6 | 0,651 | ||
| HBV-genotype (B/C) | 10/4 | 15/19 | 22/28 | 1/6 | 0,085 | ||
| Precore: G1896/A1896 | 0/14 | 3/31 | 4/46 | 0/7 | 0.594 | ||
| BCP:* mutant/wild | 4/10 | 4/30 | 12/38 | 6/1 | 0.001 | ||
| HBV-DNA (log kopier/mL) | 3,9 ± 1,0 | 4.5 ± 0,5 | 4,4 ± 0,7 | 3,6 ± 0,5 | 0,001 | ||
| HBsAg-niveau ((log IU/mL) | 8,2 ± 1.1 | 8,9 ± 0,7 | 8,7 ± 1,1 | 6,9 ± 1,5 | |||
| Knodell nekroinflammationsgrad ± SD | 4.2 ± 2.9 | 4.2 ± 3.3 | 4.7 ± 2.7 | 8.6 ± 2.0 | 0.003 | ||
| Ishak fibrosestadium ± SD | 1,9 ± 1,9 | 1,9 ± 1,9 | 1,5 ± 1,3 | 4,1 ± 1,5 | 0.007 |
Mutant, T1762 og A1764; vild, A1762 og T1764. χ2-test blev anvendt til variabler om køn, HBV-genotype, precore- og basal core-promotormutationer, mens Mann-Whitney U-test blev anvendt til andre variabler. AST: aspartataminotransferase. ALT: alaninaminotransferase. BCP: basal core promoter. HBV: hepatitis B-virus.
HBsAg-ekspressionsniveau
Figur 2A til 2D viser illustrationen af semi-kvantitativ måling af HBsAg-ekspression. Der var ingen patient, der havde skala 4+ for HBsAg-ekspression i denne undersøgelse. Der blev observeret et gensidigt forhold mellem viral replikation og leverhistologi. Patienter med 2+/3+ skalaer af HBsAg-ekspression havde lavere niveauer af HBsAg-titere og HBV-DNA-niveauer, men betydeligt sværere nekroinflammationsgrad og fibrosestadium end patienter med 1+ skala af HBsAg-ekspression og negativ HBsAg-færgning (figur 2E). De patienter, der udviste Knodell nekroinflammationsgrad ≥ 5 score eller Ishake fibrosestadium ≥ 1, havde signifikant højere procentdele af HBsAg-ekspression (Figur 3).
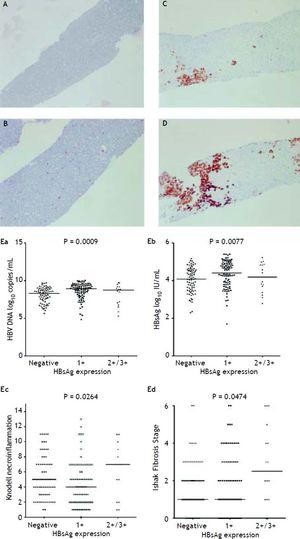
HBsAg-ekspression målt semikvantitativt i henhold til andelen af immunmærkede celler på en skala fra 0 til 3+, svarende til positivitet i (A) 0% (0), (B) 1-10% (C) 11-25% (2+) og (D) 25-50% (3+) af de undersøgte hepatocytter. Korrelationer mellem HBsAg-ekspressionsniveauet og serum-HBV-DNA- (Ea) og HBsAg-niveauet (Eb) samt Knodell-nekroinflammationsgrad (Ec) og Ishak-fibrosestadiet (Ed). Sammenligninger mellem grupper blev analyseret ved Kruskal-Wallis ANOVA.

Korrelation af ekspressionen af intrahepatisk HBsAg med Knodell nekroinflammationsgrad (A) og Ishak fibrosestadium (B). Sammenligninger mellem grupper blev analyseret ved Mann-Whitney U-test.
Kliniske træk ved HBsAg-ekspression
Først undersøgte vi forbindelsen mellem virale faktorer og HBcAg/HBsAg-ekspression. HBsAg-ekspression, ikke HBcAg-ekspression, viste et signifikant lavere niveau i tilstedeværelsen af precore-mutation (P = 0,001). Patienter med genotype C udviste et større leverfibrosestadium (P = 0,004). Hos patienter med BCP T1762/A1764-mutationer var der en signifikant større nekroinflammationsgrad og fibrosestadium samt lavere HBcAg-ekspression enten i cytoplasma eller i kernen. Alle disse observationer indikerede en aktiv leverskade. Desuden udviste patienter med BCP T1762/A1764-mutationer højere intrahepatisk HBsAg-ekspression (9,3 ± 8,0 % vs. 4,3 ± 5,0 %, P = 0,008) (tabel 3). Desuden undersøgte vi faktorer, der kan være forbundet med niveauer af HB-sAg-ekspression. I tabel 4 var der 16 patienter, der udviste 2+/3+ skalaer af HBsAg-ekspression og 1+ skala i det af 89 patienter. En univariat analyse viste, at 2+/3+ skalaer af HBsAg-ekspression var forbundet med BCP T1762/A1764-mutationer og mere alvorlig nekroinflammation og fibrose i leveren. En multivariat regressionsanalyse viste, at BCP T1762/A1764-mutationer var den uafhængige faktor, der var forbundet med 2+/3+-skalaer af intrahepatisk HBsAg-ekspression.
Kliniske, virologiske og histologiske træk hos patienter med eller uden virale mutanter.
| Precore-mutation | P-værdi | BCP-mutationer | P-værdi | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Nej (n = 98) | Ja (n = 7) | Nej (n = 79) | Ja (n = 26) | ||||||
| Age (år) ± SD | 37.8 ±11.0 | 40.0 ± 13.7 | 0.541 | 36,0 ± 10,6 | 43,8 ±11,1 | 0,005 | |||
| Køn (mand/kvinde) | 70/28 | 5/2 | 1,000 | 54/25 | 21/5 | 0,000 | 0.318 | ||
| Middel AST-niveau (U/L) ± SD | 60,0 ± 58,3 | 71,3 ± 30,5 | 0,072 | 51,5 ± 32,1 | 87,3 ± 95.6 | 0,007 | |||
| Middel ALT-niveau (U/L) ±SD | 112,2 ± 143,6 | 131,6 ± 39,1 | 0,031 | 98,2 ± 77,9 | 160,0 ± 242.0 | 0,080 | |||
| HBV-genotype (B/C) | 45/53 | 3/4 | 1,000 | 44/35 | 4/22 | ||||
| Precore: G1896/A1896 | 6/73 | 1/25 | 0,678 | ||||||
| BCP:* mutant/vilde | 25/73 | 1/6 | 0.678 | ||||||
| HBV-DNA (log kopier/mL) | 3,9 ± 1,0 | 4,5 ± 0.5 | 0,959 | 4,5 ± 0,6 | 3,7 ± 0,6 | ||||
| HBsAg-niveau ((log IU/mL) | 8.2 ± 1,1 | 8,9 ± 0,7 | 0,892 | 8,8 ± 0,9 | 7,7 ± 1,4 | ||||
| Knodelnekroinflammationsgrad ± SD | 4,6 ± 3,0 | 6.1 ± 3,1 | 0,142 | 3,9 ± 2,7 | 7,2 ± 2,7 | ||||
| Ishak fibrose stadium ± SD | 1,8 ± 1,8 | 2,1 ± 0,9 | 0,9 | 0.286 | 1,3 ± 1,4 | 3,4 ± 1,6 | |||
| HBcAg cytoplasmatisk ekspression (%) | 53,6 ± 25,8 | 44,3 ± 30,5 | 0,402 | 56,3 ± 25.4 | 42.7 ± 25.8 | 0.018 | |||
| HBcAg nukleær ekspression (%) | 13.5 ± 17.3 | 17.6 ± 31.6 | 0.800 | 17.6 ± 20.0 | 2.3 ±4.1 | ||||
| HBsAg-ekspression (%) | 5,8 ± 6,5 | 2,4 ± 1,5 | 0,274 | 4,3 ± 5,0 | 9,3 ± 8,0 | 0,274 | 4,3 ± 5,0 | 9,3 ± 8,0 | 0.003 |
Mutant, T1762 og A1764; vild, A1762 og T1764. χ2-test blev anvendt til variabler for køn, HBV-genotype, precore- og basal core-promotor-mutationer, mens Mann-Whitney U-test blev anvendt til andre variabler. AST: aspartataminotransferase. ALT: alaninaminotransferase. BCP: basal core promoter. HBV: hepatitis B-virus.
Sammenhængen mellem demografiske karakteristika og grader af HBsAg-ekspression.
| Univariate | Multivariat | ||||||
|---|---|---|---|---|---|---|---|
| HBsAg-ekspression, skala | 1+ (n = 89) | 2+/3+ (n = 16) | P-værdi | Odds ratio (95% CI) | P-værdi | ||
| Aldersgruppe | 38.2 ±11.2 | 36.6 ±11.1 | 0.608 | 0.963 (0.903-1.026) | 0.242 | ||
| Genre (mand/kvinde) | 63/26 | 12/4 | 1.000 | ||||
| AST-niveau (U/L) | 55,0 ± 37,7 | 90,4 ± 113,2 | 0,234 | 1,026 (0,991∼1.063) | 0,142 | ||
| ALT-niveau (U/L) | 103,3 ± 84,4 | 170,1 ± 297,2 | 0,386 | 0,991 (0,978∼1.005) | 0,216 | ||
| HBV-genotype (B/C) | 42/47 | 6/10 | 0,589 | 0,994 (0,234∼4,231) | 0,994 (0,234∼4,231) | 0.994 | |
| Precore A1896-mutation (+/-) | 7/82 | 0/16 | 0.592 | 0.000 (0.000∼) | 0.000 (0.000∼) | 0.999 | |
| BCP:*mutant/vildt | 17/72 | 9/7 | 0.003 | 6.356 (1.204∼33.356) | 0.029 | ||
| HBsAg-niveau (log10IU/mL) | 4,3 ± 0,7 | 4,2 ± 0,8 | 0,180 | 2,096 (0,598∼7,349) | 0,180 | 2,096 (0,598∼7,349) | 0.247 |
| Serum HBV DNA (log10 kopier/mL) | 8,6 ± 1,1 | 8,1 ± 1,4 | 0,135 | 0,731 (0,386∼1,383) | 0,731 (0,386∼1,383) | 0.335 | |
| Knodell nekroinflammationsklassificering | 4,4 ± 2,9 | 6,3 ± 3,3 | 0,027 | ||||
| Ishak fibrosestadium | 1.7 ± 1,6 | 2,9 ± 2,1 | 0,041 | ||||
| HBcAg cytoplasmatisk ekspression (%) | 53.1 ± 25,8 | 52,3 ± 28,5 | 0,915 | ||||
| HBcAg nukleær ekspression (%) | 14,4 ± 18,3 | 10.1 ± 19,3 | 0,389 | ||||
Mutant, T1762 og A1764; vild, A1762 og T1764. Univariate analyse: χ2-test blev anvendt til variabler af køn, HBV-genotype, precore- og basal core-promotormutationer, mens Mann-Whitney U-test blev anvendt til andre variabler. Multivaiate analyse: Logistisk regressionsanalyse udtrykt som Odds ratio med 95 % konfidensinterval og P-værdier. AST: aspartataminotransferase. ALT: alaninaminotransferase. BCP: basal core promoter. HBV: hepatitis B-virus.
Diskussioner
Intrahepatisk HBsAg-ekspression er forbundet med forskellige replikationsstadier og sygdomsudvikling under det naturlige forløb af kronisk hepatitis B.7,10,23 Type I GGH præsenteres overvejende i aktive hepatitisstadier, mens type II GGH hovedsageligt forekommer i inaktive eller cirrose stadier.8 I denne undersøgelse viste vi, at type II GGH viste sig at være forbundet med mere alvorlig leverhistologi, ledsaget af signifikant lavere serum HBV DNA-niveauer og HBsAg-titre og relativt højere niveauer af intrahepatisk HBsAg-ekspression. Dette gensidige forhold mellem leverhistologi og HBV-replikation indikerede, at forekomsten af type II GGH kan være en markør for fremskreden leversygdom under sygdomsudviklingen i HBeAg-positiv kronisk hepatitis B. Mønstre af HB-sAg-ekspression er blevet rapporteret at være relateret til forskellige virale mutationer, der har indvirkning på reguleringen af HBV-replikation og defekt i sekretionen af overfladeantigen fra hepatocytter9,24 . Type II GGH indeholdt konsekvent Pre-S2-deletionsmutationer, der nedsatte syntesen af midterste overfladeproteiner og derefter resulterede i ophobning af store overfladeproteiner i hepatocytter og defekt i HBsAg-sekretionen.25 I denne undersøgelse foretog vi en korrelation af serum HBsAg og HBV DNA mellem patienter med eller uden type II GGH. Moderat korrelation mellem de to HBV-replikationsindikatorer udvises hos patienter uden type II GGH (r = 0,686, P 26,27 Pre-S-deletion kunne føre til ER-stress og aktivere stressrelateret signaltransduktion. Oxidativ skade på hepatocyt-DNA og derefter stimulerede DNA-reparationsmekanismer kan resultere i genomisk ustabilitet, der forværrer leverskaderne og er disponeret for carcinogenese.28
Ud over mønstre for HBsAg-ekspression fandt vi, at højere ekspressionsniveauer ledsages af mere alvorlige leverhistologiske aktiviteter og højere hyppighed af BCP T1762/A1764-mutationer. BCP T1762/A1764-mutationer er stærkt forbundet med alvorlige leverhistologiske aktiviteter og leverkræft.29,30 Så vidt vi ved, er der en stærk sammenhæng mellem genotype C og tilstedeværelsen af BCP T1762/ A1764-mutationer.30 I denne undersøgelse syntes genotype C ikke at spille nogen rolle for HBsAg-ekspressionsniveauet. I modsætning hertil viste BCP T1762/A1764-mutationer en stærk sammenhæng med HBsAg-ekspressionen. Med hensyn til virusmutationer kan BCP T1762/A1764-mutationer danne grundlag for andre HBV-mutationer, herunder pre-S-deletion og komplekse mutanter, der ofte forekommer i forbindelse med BCP T1762/A1764-mutationer. Komplekse HBV-mutanter viste delvise eller fuldstændige defekter i ekspression og sekretion af e, core- og overfladeproteiner.31 Den reducerede sekretion af hepatitis B-overfladeantigenet korrelerede med aberrant lokalisering af overfladeproteiner i ER og resulterede i høj ekspression af HBsAg. Desuden anses BCP T1762/A1764-mutationen for at være en konsekvens af viral fitness på grund af selektionspresset fra værtens immunovervågning. På samme måde falder pre-S2-mutationer, der er anbragt i type II GGH, sammen med de humane leukocytantigenbegrænsede T- og B-celleepitoper.32 Der er normalt ingen celle nekrose eller T-lymfocytinfiltration omkring type II GGH’erne, hvilket tyder på, at HBV med fremkomsten af pre-S2-deletionsmutationen også er en muligvis ny escape-mutant.33 Akkumulationen af overfladeantigen i hepatocytter kunne imidlertid ske uden at bære nogen af de kendte virale mutationer i pre-S- eller S-genomerne eller i overfladepromotorer.31,34 Derfor kunne HBsAg-ekspressionen være en sekvens i forbindelse med eller uden virale mutationer.
Denne undersøgelse havde flere potentielle begrænsninger. Observationerne i denne undersøgelse var baseret på et retrospektivt tværsnitsdesign, men der blev ikke foretaget nogen longitudinal opfølgning. Ekspressionsniveauet af HBsAg i hepatocytter og histologisk sværhedsgrad kan variere mellem forskellige dele af leveren hos en enkelt patient; leverbiopsi i sig selv kan ikke nøjagtigt repræsentere noget levervæv bortset fra biopsikernen.
Sammenfattende udviste patienter med type II GGH-mønster eller højere niveauer af intrahepatisk HBsAg-ekspression det gensidige forhold mellem mere alvorlige leverhistologiske aktiviteter og lavere HBV-replikationskapacitet. Den stærke sammenhæng mellem intrahepatisk HBsAg-ekspression og BCP T1762/A1764-mutationer indikerede, at HBsAg-ekspression muligvis kunne betragtes som den histologiske manifestation under HBV-genomisk evolution under værtens immuntryk.
Abkortelser
- –
BCP: basal core promoter.
- –
GGH: ground glass hepatocyte.
- –
HBcAg: hepatitis B core antigen.
- –
HBeAg: hepatitis B e antigen.
- –
HBsAg: hepatitis B-overfladeantigen.
- –
HBV: hepatitis B-virus.
Interessekonflikter
T.-T. C. har modtaget forskningsmidler fra Gilead Sciences, Bristol-Myers Squibb Company, Glaxo-SmithKline, Merck Sharp & Dohme (I.A.) Corporation og Pfizer Inc. Der er ingen interessekonflikter for de resterende forfattere.