Exelead har en tilgang til kontraktproduktion med fokuseret ekspertise inden for liposomale og PEGylerede formuleringer til behandling af sjældne sygdomme og små eller underforsynede befolkningsgrupper. Vi har specialiseret os i udvikling og fremstilling af lipidbaserede, parenterale lægemidler, og vores team har mere end 20 års erfaring med at arbejde med en bred vifte af prækliniske, kliniske og kommercielle kunder inden for kontraktproduktion.
Hvad er liposomer, og hvordan bruges de til lægemiddeloverførsel?
Liposomer er specialiserede leveringsmidler, der tjener flere roller i forbindelse med forbedring af de aktive farmaceutiske ingrediensers (API’er) egenskaber. For det første kan de beskytte et lægemiddel mod at blive opdaget af kroppens immunsystem, idet de efterligner biologiske membraner og giver lægemidlet mere tid til at nå frem til det tilsigtede bestemmelsessted. For det andet kan de hjælpe med at opløse meget lipofile lægemiddelmolekyler eller modulere API’ets farmakokinetik og biodistribution – og derved bidrage til at minimere bivirkninger og forbedre produktets sikkerhedsprofil.
Liposomer har en unik vesikulær struktur. Disse vesikler er sammensat af et lipiddobbeltlag, der danner sig i form af en hul kugle, som omslutter en vandig fase. Som sådan kan enhver interessant last indkapsles i liposomer i enten det vandige rum (hvis den er vandopløselig/hydrofil) eller i lipiddobbeltlaget (hvis den er fedtopløselig/lipofil).
Nogle af de primære lipider, der anvendes til fremstilling af liposomer, er phospholipider og sfingolipider. Disse to kategorier af lipider er unikke med hensyn til en hovedgruppe, der er vandelskende/hydrofil, og en hale gruppe, der er vandhadende/lipofil. På grund af deres amfifile natur samler disse molekyler sig spontant selv for at danne liposomer og andre unikke 3D-strukturer, når de tilsættes vandige opløsninger. 3D-strukturernes form eller morfologi er afhængig af en række forskellige faktorer, f.eks. lipidsammensætning, temperatur, pH-værdi eller tilstedeværelsen af andre buffere, salte og sukkerstoffer i vandet.

Billedkilde: Chem Libre Texts
Hvordan interagerer et lægemiddel med kroppen og bliver tilgængeligt til brug, når det er formuleret som et liposomalt lægemiddelprodukt?
I de seneste år har liposomer tiltrukket sig betydelig opmærksomhed som en betroet klasse af lægemiddelleveringsmidler. Deres selvlukkede strukturer kan indkapsle flere lægemidler på én gang og beskytte den indkapslede last mod hydrolyse og nedbrydning. Desuden kan målrettede proteiner og overfladefunktionelle ligander på den ydre skal af lipiddobbeltlaget tilføje ny funktionalitet, hvilket muliggør målrettet adgang for liposomer til cellerne, enten via antistoffer eller receptormålrettede ligander. Disse ligander knytter sig til cellereceptorer, der er overudtrykt i visse syge celler, hvilket gør det muligt for lægemidlet at trænge ind gennem cellemembranen.
“Liposomer beskytter indlæste lægemiddelmolekyler mod ekstern nedbrydning, og deres lighed med biologiske membraner giver enestående muligheder for at levere lægemiddelmolekyler ind i celler eller subcellulære rum … Desuden kan forskellige fysisk-kemiske egenskaber ved liposomer – herunder deres størrelse, ladning og overfladefunktionelle ligander – ændres, hvilket resulterer i funktionaliteter, der begunstiger specifikke lægemiddelleveringsopgaver. Disse fordele har gjort liposomer til en førende platform for lægemiddeloverførsel med en bred vifte af anvendelser i klinikken.”
– Liposomlignende nanostrukturer til lægemiddeloverførsel | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Typisk fremstilles liposomer som sterile injektionsprodukter til levering til blodbanen, og frigivelse af lægemidlet finder sted, når lipidhylstre nedbrydes – hvilket kan ske i ekstracellulære eller intracellulære miljøer.
Der er blevet anvendt forskellige strategier til at designe konventionelle liposomer med udløste frigivelsesmuligheder, der forbedrer den terapeutiske effektivitet ved at få liposomerne til at frigive den indkapslede API eller “last” baseret på et stimulusrespons. Denne frigivelse er enten drevet af konventionel nedbrydning af liposomerne, eller den er drevet af aktive stimuli og miljømæssige signaler, herunder termisk energi, pH-gradient og shear stress.1
Formuleringer, der er gearet til frigivelse i intracellulære miljøer, kan omfatte pH-følsomme lipider, der ændrer den liposomale struktur eller nedbrydes i sure rum, hvilket muliggør frigivelse af det indkapslede lægemiddel. Alternativt indgår der undertiden termosensitive eller lysfølsomme komponenter for at muliggøre nedbrydning og strukturmodulation som følge af temperaturændringer eller reaktion på lys med bestemte bølgelængder.
Liposomlignende lægemiddelbærere kan findes i mange forskellige varianter, der udviser en bred vifte af biokemiske og biofysiske egenskaber. Selv om dette er en fordel og gør det muligt for disse lipidbaserede partikler at antage nyttige anvendelser i hundredvis af forskellige sammenhænge, gør antallet af potentielle variationer en streng fremstillingskontrol nødvendig.2
Exelead har fremstillet lipidbaserede lægemidler siden begyndelsen af 1990’erne, startende med Abelcet. Amphotericin B, det aktive stof i Abelcet, holdes i et lipidkompleks og fusionerer selektivt med svampemembraner for at ramme sygdomsceller.
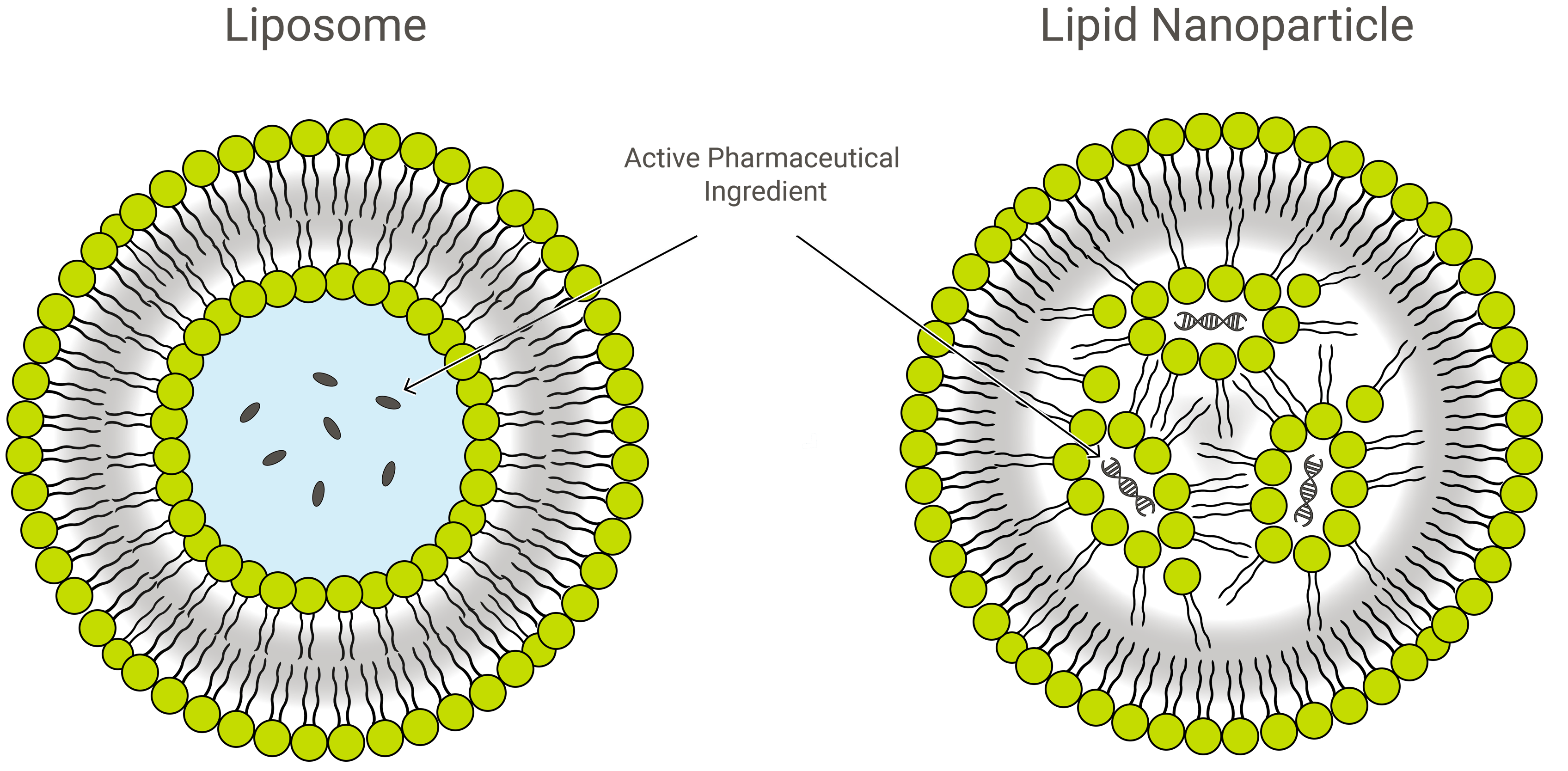
Liposomer vs. lipidnanopartikler
Liposomer og lipidnanopartikler (LNP’er) ligner hinanden i design, men er lidt forskellige i sammensætning og funktion. Begge er lipidnanoformuleringer og glimrende lægemiddelleveringsmidler, der transporterer den relevante last inden for et beskyttende, ydre lag af lipider. I anvendelsen kan LNP’er imidlertid antage en række forskellige former.
LNP’er er liposomlignende strukturer, der især er rettet mod indkapsling af en bred vifte af nukleinsyrer (RNA og DNA), og som sådan er de det mest populære ikke-virale system til genoverførsel. Exelead udvikler og fremstiller LNP’er til indkapsling af forskellige typer genetiske nyttelastninger, herunder siRNA, mRNA og saRNA.
Traditionelle liposomer omfatter en eller flere ringe af et lipiddobbeltlag, der omgiver en vandig lomme, men ikke alle LNP’er har et sammenhængende dobbeltlag, der ville kvalificere dem som lipidvesikler eller liposomer. Nogle LNP’er antager en micellignende struktur og indkapsler lægemiddelmolekyler i en ikke-vandig kerne.
PEGylering af LNP’er og liposomlignende strukturer til afgivelse af lægemidler
LNP’er består primært af kationiske lipider (se genterapi nedenfor) sammen med andre lipidbestanddele. Disse omfatter typisk neutrale fosfolipidmolekyler tilhørende fosfatidylcholin (PC)-klassen og steroler, såsom kolesterol. En anden almindelig lipidbestanddel er en såkaldt PEGyleret fosfolipid – en polyethylenglycol (PEG)-polymer, der er kovalent knyttet til hovedgruppen af en fosfolipid.

PEGylerede fosfolipider anvendes i mange lipidbaserede lægemiddelbærere, primært fordi de giver en såkaldt stealth-effekt for lægemiddelproduktet, når det cirkulerer i kroppen. Det menneskelige immunsystem er drevet af at beskytte kroppen mod ethvert fremmedlegeme, og medicinske nanopartikler er ingen undtagelse. For at hjælpe med leveringseffektiviteten og give lastmolekyler mere cirkulationstid til at nå de tilsigtede sygdomssteder, tilsættes PEG for at beskytte disse nanopartikler ved at forhindre, at blodplasmaproteiner absorberes i liposomoverfladen, hvilket øger levetiden for blodcirkulationen.1
Den anden fordel ved PEGylering er et løft i stabiliteten for liposomlignende nanostrukturer. Konventionelle liposomer, især dem, der er mindre end 200 nm, kan være ustabile i sig selv og har en tendens til at smelte sammen med hinanden for at reducere overfladespændingen. Dette kan resultere i tab af det indkapslede lægemiddel eller en ugunstig blanding af forskellige vesiklers ladning. En måde, hvorpå lægemiddelproducenterne har lært at overvinde dette problem, er ved at dække liposomernes yderside med polymerer som PEG.
Disse stealth-udstyrede nanopartikler har resulteret i en ny generation af liposomale formuleringer og flere klinisk godkendte produkter. PEG-behandlede liposomer og LNP’er er i øjeblikket det nye paradigme for de fleste kræftterapier.
LNP’er i genterapi
I lang tid var den mest effektive måde at levere genbaserede terapier til menneskelige celler på at anvende en virus, der var blevet modificeret til at bære medicinsk last i stedet for skadelige, selvreplikerende gener. Denne metode anvendes stadig lejlighedsvis i dag og betegnes som viral genlevering. Ikke-viral genoverførsel er imidlertid blevet populær i løbet af de sidste 20 år på grund af bedre sikkerhedsprofiler, lavere forekomst af uønskede immunogene reaktioner og lettere fremstilling. En af de primære drivkræfter bag denne bevægelse har været udviklingen af lipid- og polymerbaserede bærere, hvoraf LNP’er er de mest populære.
LNP’er, der anvendes til at levere gener, er primært syntetiseret ved hjælp af kationiske eller positivt ladede lipider, der associerer sig med anioniske eller negativt ladede nukleinsyrer. Der kan også tilsættes andre lipidbaserede komponenter for at modulere leveringseffektiviteten og frigivelsen af den genetiske ladning. LNP’er giver også mekanisk stabilitet, kontrolleret morfologi og snæver størrelsesfordeling.1
Organiske materialer, organiske materialer og hydrogeler er hver især blevet undersøgt som kerner til liposomale nanopartikler, indkapslet i et varierende antal lipidlag, der udgør skallen. En af de mest vellykkede variationer af disse hybride nanopartikler inkorporerer PLA- eller PGLA-polymerer i et lipidmonolag. Disse to kernebiopolymerer er særligt nyttige i forbindelse med lægemiddelafgivelse, fordi de letter kontrolleret frigivelse af lægemidler.1

Den nanopartikelformulering, der er vist ovenfor, er en lipid-polymerhybrid med en hydrofob PGLA-kerne og en hydrofil lipid-PEG-skal.
Et voksende felt
“Liposomer er kommet langt for at blive en klasse af validerede lægemiddelbærere … En stigende variation af liposomlignende nanostrukturer er under udvikling, hver med unikke styrker, der egner sig til specifikke lægemiddelleveringsopgaver. I mellemtiden sker der hurtige fremskridt i forståelsen af interaktionerne mellem disse nanostrukturer og biologiske systemer. Der er blevet indhentet en betydelig mængde oplysninger om deres cirkulationstid, vævsakkumulering og potentielle toksicitet. Det er sikkert, at liposomlignende nanocarriers vil spille en større rolle for lægemiddeloverførsel i en overskuelig fremtid.”
– Liposomlignende nanostrukturer til lægemiddeloverførsel | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Selv om der er et betydeligt arbejde i gang med udviklingen af medicinske stoffer med kontrolleret frigivelse og nanokompartmenter, er liposomer og LNP’er særligt lovende muligheder. Disse strukturer giver en unik, naturligt stabil, celleagtig morfologi for nanomedicin, og de er klar til at udvikle sig til mere avancerede terapeutiske strategier. Exelead tager sådanne udfordringer op, herunder udvikling af nanogeler, der inkorporerer en række biologiske stoffer og små molekyler.
Siden liposomer først blev foreslået som et lægemiddelafgivelsessystem i slutningen af 1960’erne, er der opstået variationer i struktur og funktionalitet, hvilket har givet værdifulde fremskridt med hensyn til målretning af sygdomme. LNP-lægemidler er dukket op i hele medicinalindustrien som terapier, der er designet til at levere kræftmidler, antibiotika, genmedicin, anæstetika og antiinflammatoriske lægemidler3 .
“I kliniske anvendelser har liposomale lægemidler vist sig at være mest nyttige for deres evne til “passivt” at akkumulere på steder med øget vaskulær permeabilitet, når deres gennemsnitlige diameter er i det ultrafiltrerbare område (<200 nm i diameter), og for deres evne til at reducere bivirkningerne ved de indkapslede lægemidler i forhold til frie lægemidler. Dette har resulteret i en generel stigning i det terapeutiske indeks, som måler effektiviteten frem for toksiciteten.”
– Liposomale lægemiddelafgivelsessystemer: fra koncept til kliniske anvendelser | Allen TM, Cullis PR 3
Anvendelser inden for personlig medicin – en ny æra inden for terapeutiske strategier
I modsætning til de traditionelle, big-pharma-tilgange til behandling af sygdomme tager personlig medicin hensyn til individuelle forskelle i livsstil, miljø og biologi – herunder patientens genetik.
Dette er yderst anvendeligt for sygdomme som kræft. Selv inden for en enkelt kræfttype er tumortyperne forskellige fra patient til patient, og ved at forstå den særlige genetiske mutation, som en patient har udviklet, kan lægerne anvende mere specifikke og præcise behandlinger.4
Med fremkomsten af personlige genetiske terapier kan læger og forskere effektivt skræddersy en aktiv lægemiddelbestanddel – ofte RNA eller DNA – til at matche den specifikke sygdomsprofil for en bestemt patient eller en lille gruppe af patienter. Denne tilgang til hyperspecifik sygdomsmålretning øger effektiviteten og mindsker uønskede bivirkninger for grupper af lignende patienter.
LNP’er som leveringsmidler for oligonukleotider
Da så meget af det voksende område for personlig medicin er fokuseret på genetiske terapier, er LNP’er blevet særligt nyttige som en lægemiddelleveringsplatform. Ethvert oligonukleotid kunne teoretisk set indkapsles i et liposom eller LNP, men siRNA er i øjeblikket den mest almindelige last i disse typer lægemiddelprodukter.
I teorien kan segmenter af siRNA designes til at lukke munden på ethvert gen, hvilket er et spændende koncept for både læger og forskere. Desværre er det vanskeligt at levere frit, uindkapslet RNA til menneskelige celler, da de er store, ustabile i serum og tilbøjelige til at blive nedbrudt af nukleaser.5
Selv om forskere har gjort forsøg på at stabilisere siRNA i serum ved at tilføje fosforothioatbindinger, kræves der høje doser for effektivt at lukke generne i mennesker ned. LNPs har givet en løsning på dette problem ved at give fleksible og nemme midler til indkapsling, der beskytter siRNA-segmenterne, indtil de når deres tilsigtede destination og letter deres levering til målceller.5
“LNPs, der indeholder ioniserbare kationiske lipider, har en række egenskaber, der er nødvendige for systemisk levering af polynukleinsyrer, herunder små størrelser, serumstabilitet, lav overfladezetapotentiale ved fysiologisk pH og kationisk ladning ved sure pH-værdier (f.eks. i endosomer). Endvidere kan der ved at udnytte “endogene” målretningsprocesser som følge af foreningen med ApoE efter indgift opnås en meget effektiv optagelse i hepatocytter efter i.v. indgift, hvilket fører til en fremragende evne til genudryddelse.”
– Lipid nanopartikelsystemer til levering af siRNA-baserede terapeutika | Wan C, Allen TM, Cullis PR 5
Mindre batchstørrelser
Personaliserede lægemidler fremstilles ofte i små batchstørrelser til enkelte patienter eller små populationer og kan ofte resultere i mindre end en liter produkt. I modsætning hertil fremstiller traditionelle fremstillingsserier til almindelige lægemidler ofte tusindvis af liter lægemiddelprodukt i stor skala. Personaliseret medicin kræver en unik tilgang, og hver batch skal fremstilles under strenge cGMP-betingelser.
Da personlig medicin er blevet et fremtrædende fokus inden for lægemiddeludvikling, har mange virksomheder i den farmaceutiske fremstillingsindustri tilpasset deres pipelines til at rumme mindre batches beregnet til små grupper af patienter ud over den traditionelle, storstilede lægemiddelproduktion.
I Exelead har man gjort en omfattende indsats for at rumme disse små batch-terapeutika, som ofte kræver dyre API’er og hurtig omsætningstid. Patient- eller antigenspecifikke lægemidler giver ikke meget tid fra det øjeblik oligonukleotidet er sekventeret til det tidspunkt, hvor produktet skal formuleres på vores sted. Disse kortfristede prognoser, som nogle gange kun er på seks uger, udgør udfordringer, som vi har været i stand til at overvinde ved at forfine vores eksisterende systemer og indarbejde innovative formuleringsteknikker.
Udbredte anvendelser
Selv om personlig medicin har potentiale til at behandle næsten alle sygdomme, har den nuværende forskning primært fokuseret på 1) immunterapier, 2) konventionelle terapier suppleret via farmakogenomik og 3) biomarkørrelaterede kræftbehandlinger. Liposomer og LNP’er kan anvendes som leveringsmidler til hver af disse kategorier af lægemidler, hvilket gør dem til et uundværligt aktiv inden for dette nye område af lægemiddeludvikling.

Reference Articles
- Gao W, Hu C-MJ, Fang RH, Zhang L. Liposome-like Nanostructures for Drug Delivery. Journal of materials chemistry B, Materials for biology and medicine. 2013;1(48):10.1039/C3TB21238F. doi:10.1039/C3TB21238F.
- Kraft JC, Freeling JP, Wang Z, Ho RJY. Nye tendenser inden for forskning og klinisk udvikling af lægemiddelformidlingssystemer med liposomer og lipidnanopartikler. Journal of pharmaceutical sciences. 2014;103(1):29-52. doi:10.1002/jps.23773.
- Theresa M. Allen, Pieter R. Cullis. Liposomale lægemiddeltilførselssystemer: Fra koncept til kliniske anvendelser. Advanced Drug Delivery Reviews. 2013 Jan;65(1):36-48
- Esposito L. Hvad betyder personaliseret medicin virkelig? US News: Health Care. 2018 Jan;
- Wan C, Allen TM, Cullis PR. Lipid nanopartikel leveringssystemer til siRNA-baserede terapeutika. Drug Deliv Transl Res. 2014 Feb;4(1):74-83. doi: 10.1007/s13346-013-0161-z.
- Vogenberg FR, Isaacson Barash C, Pursel M. Personaliseret medicin: Del 1: Udvikling og udvikling til teranostik. Pharmacy and Therapeutics. 2010;35(10):560-576.