US Pharm. 2012;37(5):HS-2-HS-7.
Smerter er den mest almindelige årsag til, at folk søger lægehjælp.1 nyere undersøgelse anslår, at smerter påvirker titusindvis af millioner af amerikanere og koster USA 635 milliarder dollars årligt på grund af øget forbrug af lægehjælp og indirekte omkostninger fra mistede arbejdsdage og tab af produktivitet.2 Håndtering af kroniske smerter med medicin såsom opioider er en almindelig strategi, men kroniske smerter kan fortsætte eller forværres på trods af aggressiv opioidbehandling. Denne artikel har til formål at kaste lys over fænomenet med opioider, der ordineres til behandling af smerter, men som forårsager nye eller paradoksalt forværrede smerter, hvilket kaldes opioidinduceret hyperalgesi (OIH). OIH kan mere formelt defineres som øget nociceptiv sensibilisering forårsaget af eksponering for opioider.3 OIH adskiller sig tydeligt fra tolerance, afhængighed, afhængighed og sygdomsudvikling. Den kliniske prævalens af OIH er ukendt.4
Diagnose og præsentation
Et af de største problemer ved korrekt diagnosticering af OIH er tilstandens store lighed med opioidtolerance. Tolerance og OIH deler den karakteristiske egenskab af reduceret analgetisk respons på opioiddosis, og de deler sandsynligvis mange af de samme cellulære mekanismer.5Tolerance kan overvindes ved at øge opioiddosis, mens den samme stigning hos en patient med OIH resulterer i forværret smerte.4 Desuden har tolerance tendens til at udvikle sig langsomt over tid, mens den øgede smerte som følge af opioidbehandling hos OIH-patienten opstår forholdsvis hurtigt. OIH adskiller sig ofte fra tolerance ved, at smerteintensiteten er stærkere end oprindeligt rapporteret.6
Underbehandlede smerter er en anden mulighed, der bør udelukkes. Hvisopioidbehandling er suboptimal, bør en forøgelse af dosis føre til smertelindring; hvis OIH er til stede, bør det modsatte være tilfældet. For at der kan stilles en nøjagtig diagnose af OIH, skal smerten forsvinde, når behandlingen med det ulovlige opioid ophører.6 For at komplicere tingene yderligere er hyperalgesi som følge af opioidafvænning et veldokumenteret fænomen.7 Som sådan vil smertelindring efter opioidafvænning ved OIH ikke være øjeblikkelig og vil kræve tålmodighed. Dette giver sine egne udfordringer for både klinikeren og patienten.
OIH har tendens til at vise sig med andre særskilte karakteristika (TABEL 1).Smerter forbundet med OIH har tendens til at være mere diffuse og af mindre kvalitet, og noxiske stimuli har tendens til at være mere smertefulde, end man normalt ville forvente. Ved OIH manifesterer smerten sig ofte i områder, der strækker sig ud over det område, hvor skaden eller vævsskaden er sket. Smerten kan ved OIH fortsætte, selv om den oprindelige smertekilde fjernes eller det beskadigede væv heles.Ved OIH kan smerten, efterhånden som opioidbehandlingen skrider frem, give illusionen af at blive værre end oprindeligt rapporteret på trods af tid, hvile og andre foranstaltninger, der normalt ville give mulighed for en klinisk relevant heling.5 Desuden er allodyni blevet påvist i en række undersøgelser af OIH hos mennesker og dyr.8

Etiologi
Der findes en række teorier om årsagen til OIH. Den teori, der er blevet forsket mest i og i øjeblikket får mest opmærksomhed, er den neuroekspiratoriske model. Det antages, at visseopioider og deres metabolitter agoniserer N-methyl-D-aspartat(NMDA)-receptoren(NMDA). Aktivering af NMDA-receptoren forårsager en tilstrømning af calcium, som i høj grad øger neuronets excitabilitet. NårNMDA -receptoren og de tilsvarende neuroner er mere aktive, kan de lettere overføre smerteimpulser, der er udløst af cirkulerende stoffer Por andre skadelige stimuli. Glutamat er den primære endogene agonist af NDMA-receptoren.9
Støtter denne teori om pronociception moduleret af NMDA-receptoraktivering er undersøgelser, der viser lindring af OIH efter indgift afNMDA-receptorantagonister. Disse antagonister binder ikke-kompetitivt til phencyclidinstedet på NMDA-kanalen og blokerer den tilstrømning af calcium, der ville forekomme, når receptoren binder glutamat eller en andenagonist.10 Dyre- og humane undersøgelser har vist, at forsøgspersoner med OIH, der fik ketamin, en NMDA-receptorantagonist, scorede bedre under kontrolleret smertestimulansprøvning. I en undersøgelse fik rotter intratekale morfinininjektioner i flere dage, indtil de udviste OIH, der var følsom over for varme. Indgivelse af dizocilpin, en NMDA-hæmmer, var effektiv til i det mindste delvist at vende den termiske hyperalgesi.5 Andre NMDA-receptorantagonister, såsom dextromethorphan, har vist visse tegn på at lindre hyperalgesiske tilstande gennem hæmning på NMDA-receptoren.
Opioider, såsom kodein, hydromorphone og morfin, gennemgår en række biotransformationer som led i den normale metaboliske proces.Kodein metaboliseres til morfin af CYP2D6-enzymet. Morfin metaboliseres til en række molekyler, men det metaboliseres primært gennem glucuronidering til morfin-3-glucuronid (M3G) og i mindre grad til morfin-6-glucuronid (M6G) (FIGUR 1) (FIGUR 1).11
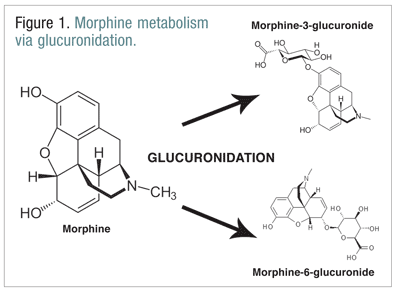
M6G er en terapeutisk vigtig metabolit. Den har mu-receptorbindende affinitet svarende til morfinets og er i stand til at frembringe analgesi, respirationsdepression og andre virkninger svarende til morfinets virkninger. M3G er imidlertid ikke en agonist ved mu-receptoren, og det har kun ringe affinitet for mu-receptoren sammenlignet med morfin. I modsætning til morfin, M6G og andre opioider er M3G en NMDA-agonist. Gennem glucuronidering omdannes M3G med en hastighed, der er ca. seks gange større end M6G.12 Andre opioider er blevet impliceret i, at de har NMDA-agonistaktivitet og paradoksale neuroekspiratoriske virkninger.6
Den teori, at OIH skyldes aktivitet af andre receptorer end mu-opioidreceptoren, understøttes af beviser for, at OIH ikke lindres ved indgift af en opioidantagonist (f.eks. naloxon). Hos patienter, der oplevede OIH under højdosisopioidbehandling, forårsagede indgivelse af naloxon en forværring af smerten.13 Ved at fortrænge opioidet fra mu-receptoren forhindrede naloxon opioidet i at give den analgesi, der var mulig gennem aktivering af mu-receptoren, mens hyperalgesien nu samtidig forblev uudfordret.14
Dynorphin kan også være involveret i udviklingen af OIH.15Dynorphin er et endogent opioidpeptid, der primært binder sig tilkappa-opioidreceptoren og i mindre grad til mu-opioid- og NMDA-receptorerne. Man mener, at dynorphins agonisme af kappaopioidreceptoren og NMDA-receptoren spiller en rolle i pronociceptionen af OIH på trods af tilstedeværelsen af rene mu-receptoragonister. Undersøgelser har vist, at reversering af dynorphin kan genoprette de analgetiske virkninger af morfin, når forsøgspersoner får et dynorphin-antiserum. Desuden er dynorfin kendt for at stige under langvarig opioidadministration. Dynorfin forårsager også frigivelse af excitatoriske neuropeptider på forskellige steder i centralnervesystemet.
Behandlingsmuligheder
Når diagnosen OIH er blevet stillet, er der en række behandlingsmuligheder, som man omhyggeligt skal vælge imellem. Forudsat at den oprindelige smertefulde skade eller vævsbeskadigelse er forsvundet, og at smerterne fortsætter på trods af – og på grund af – opioidbehandling, er den mest ligefremme fremgangsmåde at ophøre med den ulovlige opioidbehandling. Dette bør ske gradvist for at minimere skadelige abstinensvirkninger. Det skal bemærkes, at hyperalgesi sandsynligvis kan forværres tidligt i aftrapningsprocessen.16 Dette udgør en udfordrende etisk situation, hvor klinikeren kan have svært ved at overbevise patienten om, at den medicin, der er ordineret til smertebehandling, kan have forårsaget eller forværret smerten, og at smerten kan blive værre endnu, før den i sidste ende forsvinder.17
Hvis legitime smerter fortsætter, og der er behov for en vis mængde analgesi med opioider, bør andre strategier end total aftrapning af opioider undersøges. Patienter, der oplever OIH, kan opnå lindring ved at reducere opioiddosis.4 Der er rapporter om patienter, der finder en acceptabel balance mellem analgesi og lindring af hyperalgesi ved reduktion af opioiddosis.
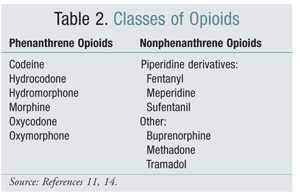
Skift fra en strukturel klasse af opioider til en anden har i nogle undersøgelser været en effektiv mulighed for at afbøde OIH. Hidtidige undersøgelser har vist, at OIH er stærkere forbundet med opioider fra phenanthrene-klassen (TABEL 2).4 Titrering af phenanthrene-opioidet og konvertering til et andet kan give en løsning på OIH. Kodein, hydromorphone, morfin og strukturelt lignende opioider undergår glucuronidering som en del af deres metabolisme. Det er muligt at undgå enNMDA -receptoraktiverende glucuronidmetabolit ved at skifte til et opioid, der er strukturelt unikt, f.eks. fentanyl. I skrivende stund er OIH ikke blevet påvist i forsøg med oxymorphone.4
Supplementering af opioidbehandling med en cyclo-oxygenase 2- (COX-2)-hæmmer er en anden strategi, der har en vis støtte. Ved at reducere prostaglandinsyntesen kan COX-2-hæmmere mindske sensibiliseringen af pronociceptive neuroner. Ikke-steroide antiinflammatoriske lægemidler (NSAID) og COX-2-hæmmere synes at have analgetiske virkninger uafhængigt af deres evne til at undertrykke prostaglandinsyntesen perifert.9 COX-2-hæmmere har også vist sig at være i stand til at modvirke NMDA-receptoren. Centralt er NSAID’er i stand til at modvirke NMDA-receptoren ved at blokere glutamat, stof P og andre excitatoriske aminosyrer. Uafhængigt af dette kan NMDA-receptoraktivering opregulere COX-2 ekspression.18
I betragtning af den opmærksomhed, som NMDA-receptoren har fået for sin rolle i OIH, synes antagonisering af denne receptor at være en rimelig behandlingsstrategi. Der er forsket meget i ketamin, men dets negative virkninger kan være alvorlige. Selv om det antagoniserer NMDA og giver en anæstetisk virkning, der ville fremme analgesi, er bivirkningerne almindelige, forskelligartede og alvorlige.19 Disse virkninger omfatter takyarytmi, hypertension, kognitive forringelser og psykomimetiske reaktioner, herunder humørsvingninger, livlige drømme, delirium, hallucinationer og sedering. Ketamin er effektivt til at vende hyperalgesi og forstærke virkningerne af opioider hos patienter, der modtager store doser, men dets bivirkninger forhindrer det i at være en levedygtig behandlingsmulighed.
Dextromethorphan er en anden NMDA-receptorantagonist, der er blevet undersøgt til behandling af OIH. Et kombinationsprodukt, der indeholder en 1:1-blanding af morfin og dextromethorphan, er blevet undersøgt.20 Undersøgelserne viste ikke, at kombinationsbehandling kunne opnå en bedre analgesi sammenlignet med morfin alene. Lignende behandlingsfejl opstod i en undersøgelse, hvor der blev anvendt en 2:1-blanding af de samme midler.Undersøgelserne er blevet kritiseret for at have en utilstrækkelig mængde dextromethorphan for at kunne antagonisere NMDA-receptoren i tilstrækkelig grad.21Det er fortsat ukendt, hvilken dosis dextromethorphan der er nødvendig for enten at øge en opioids analgesi eller forhindre OIH forårsaget af NMDAreceptoraktivering.
Methadon er et opioid med unikke egenskaber, der gør det til en overbevisende mulighed for behandling af smerter hos patienter med OIH. Ud over sine analgetiske virkninger gennem binding til mu-opioidreceptoren er metadon en svag NMDA-receptorantagonist.4 Det er blevet rapporteret, at tilsætning af selv en lav dosis metadon har været effektiv til at reducere hyperalgesi. I et tilfælde forbedrede tilføjelsen af metadon i lav dosis (10 mg to gange dagligt) rapporterne om smerte markant, med en reduktion af den samlede opioiddosis på 40-50 %.22 Skift fra den forstyrrende opioid til metadon har været en populær behandlingsstrategi. Tramadol og meperidin har også en vis NMDA-receptorantagonistisk aktivitet.
En anden behandlingsform, der har et vist potentiale til behandling af OIH, er buprenorphin.23,24 Buprenorphin er en partiel opioidagonist ved mu-receptoren og har også kappa-receptorantagonistisk aktivitet.4Dynorphin, en kappa-receptoragonist, er kendt for at stige under behandling med opioider. Aktivering af kappa-receptorantagoniserer i vid udstrækning de mu-receptormedierede virkninger af opioider.25 Den kliniske nytte af buprenorphin til behandling af OIH er endnu ikke fuldt ud forklaret.
Konklusion: Der skal stadig gøres meget arbejde, før det kan erklæres, at OIH er forstået. Den nøjagtige cellulære mekanisme og de signalveje, der er ansvarlige for dette fænomen, er ikke defineret. For at komplicere dette er der modstridende rapporter om, hvorvidt specifikke komponenter spiller en nøglerolle eller overhovedet spiller nogen rolle. Hovedparten af den forskning, der har været gennemført for at klarlægge OIH’s patofysiologi, har været baseret på dyremodellen. Dette har en vis værdi, men oplysninger fra den menneskelige model er sparsomme.
En svag forståelse af årsagen til en tilstand skaber et usikkert armamentarium af behandlingsmuligheder. Den bedste strategi, der er til rådighed, er fuldstændig ophør med det problematiske opioid, men dette er af ringe nytte for den patient, der har brug for smertelindring af opioid-typen.Flere andre behandlingsmetoder er blevet undersøgt, men alle ville have gavn af yderligere undersøgelser. Størstedelen af de undersøgelser, der er foretaget på mennesker, omfatter periskirurgiske patienter, stofmisbrugere i bedring og eksperimentelle smertemodeller. Disse undersøgelser er ikke uden værdi, men disse populationer afspejler ikke den kroniske smertepopulation. Andre begrænsninger af de tilgængelige behandlingsmuligheder omfatter mangelfulde resultater, overdreven toksicitet trods moderat succes og små undersøgelser, der giver svage konklusioner.
I skrivende stund er en række kliniske undersøgelser med NMDA-receptorantagonisten memantin til behandling af OIH i gang eller planlagt.26 Der er stadig modstridende rapporter om den nøjagtige rolle af NMDA-receptorer i OIH. Der må foretages yderligere forskning for at fastslå de vigtigsteansvarlige receptorer og mekanismer, der er til stede i OIH. En udvidelse af undersøgelsernes stikprøvestørrelse vil bidrage til at understøtte de konklusioner, der allerede er draget om, hvilke behandlingsmidler der er ansvarlige for OIH og effektive til behandling af det. Gennemførelse af undersøgelser, der fokuserer på kroniske smerter frem for modeller af akutte smerter, kan give klinisk relevante oplysninger til behandleren.
Chapman og kolleger har rejst specifikke spørgsmål, der skal besvares, før diagnosen OIH kan stilles og effektiv behandling kan ydes.27 Hvad er forholdet mellem opioiddosis og -varighed og OIH? Ved hvilken type smerte eller hos hvilken type patient er der større sandsynlighed for, at der udvikles OIH? Det er disse spørgsmål, der skal være styrende for den fremtidige kliniske forskning.
1. Parselis Kelly J, Cook SF, Kaufman DW, et al. Prævalens og karakteristika for opioidbrug i den voksne befolkning i USA. Pain. 2008;138:507-513.
2. Institute of Medicine. Lindring af smerter i Amerika: A Blueprint for Transforming Prevention, Care, Education, and Research. Washington, DC: The National Academies Press; 2011.
3. Chu LF, Angst MS, Clark D. Opioid-induceret hyperalgesi hos mennesker: molekylære mekanismer og kliniske overvejelser. Clin J Pain. 2008;24:479-496.
4. Lee M, Silverman SM, Hansen H, et al. En omfattende gennemgang af opioidinduceret hyperalgesi. Pain Physician. 2011;14:145-161.
5. Mao J. Opioidinduceret unormal smertefølsomhed: implikationer i klinisk opioidbehandling. Smerter. 2002;100:213-217.
6. Raffa RB, Pergolizzi JV Jr. Opioidinduceret hyperalgesi: Er det klinisk relevant for behandlingen af smertepatienter? Pain Manage Nurs. 2011;1-17.
7. Li X, Clark JD. Hyperalgesi under opioidabstinens: mediation af glutamat og stof P. Anesth Analg. 2002;95;95:979-984.
8. Pud D, Cohen D, Lawental E, Eisenberg E. Opioider og unormal smerteopfattelse: nye beviser fra en undersøgelse af kroniske opioidafhængige og sunde forsøgspersoner. Drug Alcohol Depend. 2006;82:218-223.
9. Malmberg AB, Yaksh TL. Hyperalgesi medieret af spinal glutamat- eller stof P-receptor blokeret af spinal cyclooxygenasehæmning. Science. 1992;257:1276 -1279.
10. Fisher K, Coderre TJ, Hagen NA. Målretning af N-methyl-D-aspartatreceptoren med henblik på behandling af kroniske smerter. Prækliniske dyreforsøg, nylige kliniske erfaringer og fremtidige forskningsretninger. J Pain Symptom Manage. 2000;20:358-373.
11. Lötsch J. Opioidmetabolitter. J Pain Symptom Manage. 2005;29:S10-S24.
12. Skarke C, Lötsch J. Morphine metabolitter: kliniske implikationer. Semin Anesth, Perioperative Med Pain. 2002;21:258-264.
13. Juni A, Klein G, Kest B. Morfinhyperalgesi hos mus er ikke relateret til opioidaktivitet, analgesi eller tolerance: beviser for flere forskellige hyperalgesiske systemer. Brain Res. 2006;1070:35-44.
14. Angst M, Clark JD. Opioidinduceret hyperalgesi: en kvalitativ systematisk gennemgang. Anesthesiology. 2006;104:570-587.
15. Vanderah TW, Gardell LR, Burgess SE, et al. Dynorphin fremmer unormal smerte og spinal opioid antinociceptiv tolerance. J Neurosci. 2000;20:7074-7079.
16. Hooten WM, Mantilla CB, Mantilla CB, Sandroni P, Townsend CO. Associationsbetween heat pain perception and opioid dose among patients with chronicpain under opioid tapering. Pain Med. 2010;11:1587-1598.
17. Silverman S. Opioidinduceret hyperalgesi: kliniske implikationer for smertebehandleren. Pain Physician. 2009;12:679-684.
18. Li SQ SQ, Xing YL, Chen WN, et al. Aktivering af NMDA-receptor er forbundet med opregulering af COX-2 ekspression i det spinale dorsalhorn under nociceptive input hos rotter. Neurochem Res. 2009;34:1451-1463.
19. Okon T. Ketamin: en introduktion for læger inden for smerte- og palliativmedicin. Pain Physician. 2007;10:493-500.
20. Galer BS, Lee D, Ma T, et al. MorphiDex (morphinesulfat/dextromethorphanhydrobromid-kombination) til behandling af kroniske smerter: tre multicenter, randomiserede, dobbeltblindede, kontrollerede kliniske forsøg påviser ikke øget opioidanalgesi eller reduktion af tolerance. Pain. 2005;115:284-295.
21. Wiesenfeld-Hallin Z. Kombinerede behandlinger med opioid-NMDA-antagonister: Hvilke fordele giver de i forbindelse med kontrol af smertesyndromer? Lægemidler. 1998;55;1-4.
22. Vorobeychik Y, Chen L, Chen L, Bush MC, Mao J. Forbedret opioidanalgetisk virkning efter reduktion af opioiddosis. Pain Med. 2008;9:724-727.
23. Baron MJ, McDonald PW. Signifikant smertereduktion hos kroniske smertepatienter efter afgiftning fra højdosisopioider. J Opioid Manag. 2006;2:277-282.
24. Koppert W, Ihmsen H, Körber N, et al. Forskellige profiler af buprenorfininduceret analgesi og antihyperalgesi i en menneskelig smertemodel. Pain. 2005;118:15-22.
25. Pan ZZ. Mu-modvirkende virkninger af kappa-opioidreceptoren. Trends Pharmacol Sci. 1998;19:94-98.
26. Ballantyne JC, Mao J. Opioidbehandling af kroniske smerter. N Engl J Med. 2003;349:1943-1953.
27. Chapman CR, Lipschitz DL, Angst MS, et al. Opioid farmakoterapi for kroniske smerter uden for kræft i USA: en forskningsvejledning til udvikling af et evidensgrundlag. J Pain. 2010;11:807-829.