Indledning
Immunofluorescens (IF) anvendes antistoffer og fluorescerende detektion til at studere lokalisering, relativ ekspression og aktiveringstilstande for målproteiner i fikserede celler eller væv. IF anvendes i vid udstrækning inden for forskellige undersøgelsesområder.
IF kan bruges til at besvare spørgsmål som:
- Hvilke celler eller væv udtrykker mine målprotein(er)?
- Hvordan ændres ekspressionen og/eller aktiveringen af mit målprotein som reaktion på eksperimentelle forstyrrelser?
- Hvor i cellen/vævet er målproteinet lokaliseret?
- Hvad er det rumlige forhold mellem forskellige målproteiner i forbindelse med celle- eller vævsarkitekturen?
Immunofluorescens omfatter en række beslægtede teknikker, der har udviklet sig over tid. Alle disse teknikker udnytter den specifikke genkendelse af biologiske mål ved hjælp af antistoffer og påvisning af fluorescerende reportere i cytometrisk analyse. Det er vigtigt at sikre, at den biologiske prøve er velbevaret, mens målantigener er tilgængelige for antistoffer, men det kan give udfordringer, der varierer afhængigt af prøven, målet og antistoffet.
På denne side har vi samlet ressourcer, der kan hjælpe dig med at navigere i protokoller, besvare almindelige spørgsmål og hjælpe dig med at designe vellykkede IF-eksperimenter.
Valg af den rigtige IF-teknik og protokol
Den optimale IF-teknik/protokol påvirkes af typen af biologisk materiale, prøvens behandlingstrin, egenskaberne ved målantigenet og det særlige antistof, der anvendes.
Det skal bl.a. overvejes:
- Inputmaterialer kan være dyrkede cellelinjer, frosset væv eller formalinfikseret, paraffinindlejret (FFPE) væv.
- For dyrkede cellelinjer og primære celler skal du kigge efter antistoffer, der er valideret til immunofluorescens-immunocytokemi (IF-IC).
- I mange laboratorier bruges “immunohistokemi/IHC” som en samlebetegnelse for væv, der enten er paraffinindlejret eller frosset, og kan bruges til at omfatte både kromogen og fluorescerende detektion. På cellsignal.com skelner applikationerne mellem frosne (IF-F) og paraffinindlejrede vævspræparater.
- For FFPE-vævsprøver kan antistoffer, der er valideret til immunohistokemi (IHC-P), også anvendes med fluorescerende detektion uden forstærkning, hvis målantigenet er rigeligt, eller i multiplexed IHC (mIHC) med signalforstærkning.
- Et antistof kan være valideret til en eller flere af de ovenfor anførte applikationer. Anbefalinger til protokoller er resultatet af test foretaget af forskere under valideringsprocessen.
- Produktspecifikke protokoller findes på hver produktwebside. For IF-validerede antistoffer skal du vælge “IF” på produktsiden for at få vist IF-valideringsdata og protokol. Grundlæggende oplysninger (fortyndinger/arbejdskoncentration, validerede anvendelser, artsreaktivitet, værtsspecies) for hvert antistof er inkluderet i produktdatabladet.
- De mest almindeligt anvendte IF-protokoller kan også findes på protokolsiden.
- Har du ikke brug for eller ønsker du ikke at bruge fluorescensdetektion til dine vævsprøver? En alternativ tilgang er kromogen detektion, som er beskrevet på IHC-siden.
Valg af antistoffer til IF: vigtigheden af antistofvalidering
De bedste antistoffer giver et stærkt, specifikt signal med minimal baggrund. Det er vigtigt at vælge antistoffer, der er blevet valideret i den applikation, du skal bruge. Validering af antistoffer i IF kan omfatte positive og negative ekspressionsforsøg (ved hjælp af knockoutcellelinjer, genetiske modeller, CRISPR eller RNAi), eksperimentel manipulation af målproteinlokalisering eller posttranslationelle modifikationer og protokoloptimering.
Et antistofs ydeevne varierer fra applikation til applikation. Et antistof, der f.eks. fungerer godt i et Western Blot-forsøg, fungerer måske eller måske ikke i IF. Under afprøvning af nye antistoffer vil nogle af dem udvise mindre off-target-binding; disse antistoffer anbefales aldrig til IF eller andre ikke-WB-applikationer. Desuden kan et antistof fungere godt på frosset væv, men ikke på FFPE-væv, eller omvendt. Antistoffernes følsomhed og ydeevne kan ændre sig afhængigt af, hvordan prøven er fikseret og behandlet, og af antistoffernes arbejdsbetingelser.
Når du har besluttet, hvilken type biologiske prøver du vil bruge i dit eksperiment, og hvordan de vil blive forberedt, er det nemmest at gennemse antistoffer på cellsignal.com ved først at vælge den relevante applikation. Derefter kan du indtaste søgeudtryk eller vælge andre attributter (f.eks. værtsart, forskningsområde m.m.) for at forfine din søgning yderligere og vælge et antistof, der er blevet valideret i den applikation, du har brug for.
Design af kontrolforsøg til IF
For at være sikker på dit eksperimentelle design og dine resultater, og at dit antistof nøjagtigt rapporterer sit mål, kan positive og negative kontrolforsøg være informative. For eksempel:
- Sekundær kontrol kan fortælle dig, om der er uspecifik binding af sekundært antistof.
- Bevis specificiteten af et primært antistof ved at designe Knockout/siRNA-forsøg eller ved at sammenligne kendte eksprimerende og ikke-eksprimerende cellelinjer.
- Single target-eksperimenter anvendes ved opsætning af spektral unmixing-billeddannelse. Denne type forsøg kan hjælpe med at afgøre, om en manglende farvning skyldes sterisk hindring, der opstår, når 2 antigener er tæt på hinanden.
- Behandl prøver med fosfatase for at bekræfte, at fosfo-specifikke antistoffer kun genkender det fosforylerede mål i IF.
- Hvis du har mistanke om problemer med fiksering eller permeabilisering, kan det være nyttigt at kontrollere med et antistof, der tidligere har fungeret for dit laboratorium, ved fejlfinding.
Cell Signaling Technology (CST)-forskere udfører rutinemæssigt disse typer af kontroller som en del af vores valideringsproces (se et eksempel). Det kan betale sig at opstille lignende kontroller i dit eksperimentelle modelsystem, især hvis du har svært ved at få de ønskede resultater.
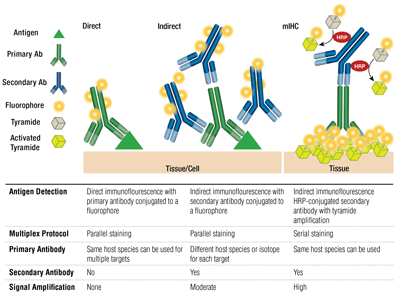
Primære vs. sekundære antistoffer og direkte vs. indirekte farvning
Primære antistoffer giver specifik genkendelse af målantigenet. Sekundære antistoffer binder sig til primære antistoffer baseret på den art, de blev opdrættet i. Primære antistoffer, der er opdrættet i kanin eller mus, kan påvises med sekundære anti-kanin- eller anti-mus-antistoffer.
Parring af et primært antistof og et sekundært antistof (specifikt for værtsarten for det primære), der er konjugeret til en fluorofor, kaldes indirekte farvning. Anvendelse af primære antistoffer, der er konjugeret til fluorophorer, uden sekundære antistoffer, kaldes direkte farvning. Direkte farvningsmetoder sparer tid og muliggør multiplexing ved hjælp af antistoffer, der er fremstillet i den samme værtsart. Indirekte farvning giver traditionelt en højere følsomhed takket være den signalforstærkning, der sker, når flere sekundære antistoffer binder til et enkelt primært antistof.
Der findes andre variationer af disse teknikker, f.eks. ved anvendelse af biotinylerede primære antistoffer med avidin/streptavidin-konjugeret fluorokrom. Fluorophore-konjugerede F(ab’)2-fragmenter af sekundære antistoffer (uden Fc-domænet) kan bidrage til at reducere baggrunden. I mIHC anvendes peberrodsperoxidase (HRP)-konjugerede sekundære antistoffer til at katalysere afsætningen af tyramid-fluorophore-konjugater.
Valg af antistoffer med fluorophorer
Valg af antistoffer med fluorophorer
Hvor mange mål/antistoffer kan multiplexes?
Multiplexing anvender detektion af mere end 1 mål ad gangen ved hjælp af flere antistoffer og detektion af forskellige bølgelængder (farver) for hvert mål. Ved indirekte farvning er evnen til multiplexing afhængig af parring af fluorforkonjugerede, artsspecifikke sekundære antistoffer til hvert primært antistof. Musekroppeantistoffer fra forskellige isotyper kan også multiplexes ved hjælp af isotypespecifikke sekundære antistoffer, hvilket giver mulighed for detektion af op til 5 musekroppeantistoffer på én gang. Ved direkte farvning skal hvert primært antistof kobles til en anden fluorofor. Dette gør det muligt at kombinere flere antistoffer fra samme art/isotype og giver også mulighed for “mus-på-mus”-farvning, da uspecifik binding af sekundære anti-mus-antistoffer til musevæv ikke er et problem.
Ved udformningen af multiplex IF-forsøg skal der tages hensyn til fluorescensmikroskopets spektrale egenskaber, herunder tilgængelige excitationskilder og filtersæt, for at undgå spektral bleed-through. Moderne epifluorescerende og konfokale fluorescensmikroskoper har typisk mulighed for at skelne mellem 3 eller flere kanaler.
Kombination af antistoffarvning med farvestoffer eller tags
Cellulære farvestoffer, der påføres efter fiksering, eller fiksérbare live-celle-mærkater kan indarbejdes i en IF-arbejdsgang. Organelle mærkning anvendes ofte til at verificere subcellulær lokalisering af et mål. Udtrykte mærker, såsom GFP, anvendes ofte til at spore transficerede celler eller i mosaikforsøg; hvis GFP-fluorescenssignalet er lavt, kan der anvendes et anti-GFP-antistof i IF. Anvendelse af farvestoffer eller fluorescerende proteiner vil optage fluorescenskanaler, så der er mindre til rådighed for antistoffer.
Valg af fluorophorer til dit eksperiment
Dette afhænger af spektralkarakteristikaene for den excitationskilde og excitations-/emissionsfiltrering, som du har til rådighed. Vurder fluoroforens excitations- og emissionsprofil, inden du udfører dit eksperiment, for at undgå fluorescensafsmitning. CST tilbyder en række fluorforkonjugerede primære og sekundære antistoffer, herunder farvestoffer i Alexa Fluor®-linjen.
Prøveforberedelse
Tvæv
Tvævsafsnit kan forberedes enten ved hurtig nedfrysning i medium med optimal skæringstemperatur (OCT) eller ved fiksering og indlejring i paraffin. Frosne prøver kan snittes ved hjælp af en kryostat og lufttørres på objektglasset i 10 til 15 minutter før fiksering før næste trin. For FFPE-vævsprøver kan kravene til udtagning, fiksering og indlejring i paraffin variere alt efter den enkelte vævstype.
Frosset vs. FFPE-væv
Generelt giver FFPE-væv en bedre morfologi end OCT-indlejret frosset væv. Dette kan gøre det lettere at kvantificere positive celler eller identificere grænserne mellem farvestoffer. FFPE-væv er også meget stabilt; når de er indlejret, kan blokke af væv opbevares i årevis. Denne type væv er også lettere at sende mellem laboratorier, og det er den foretrukne behandlingsmetode for humane patologiske prøver.
På den anden side gennemgår FFPE-væv flere ekstra behandlingstrin, der reducerer den samlede mængde antigen på grund af proteinnedbrydning, kræver afmaskeringstrin for at påvise resterende antigen og forværrer aldehydinduceret autofluorescens. Medmindre der arbejdes med et meget rigeligt protein, kan det resterende antigen være vanskeligt at påvise ved indirekte IF og kan kræve forstærkning for at opnå en passende farvning. Det er også muligt, at antigenudtagning kan afsløre antigener, der normalt ikke ville blive påvist, og at et antistof, der ellers giver det forventede farvemønster, kan give uspecifik farvning. Det er ligeledes muligt at arbejde med et mål, hvor der er behov for en specifik metode til antigenudtagning for at påvise målets epitop. Derfor er det vigtigt at overveje, hvordan et antistof er valideret, og hvilke trin der er nødvendige for at anvende det.
For så vidt angår OCT-indlejret frosset væv prioriteres reduktion af behandling frem for morfologi. Dette er den hurtigste metode til at opnå immunfarvningsresultater, da objektglasene er klar til brug i det øjeblik, vævet skæres ud, og der er færre behandlingstrin før indlejring. Der er mindre proteinnedbrydning, og der er mere antigen til rådighed til at binde antistof, uden at der er behov for yderligere, hårde udtagningstrin. Da denne metode ikke kræver forstærkning, er den mere følsom over for vævskvalitet. Fixeringstype (alkohol vs. aldehyd), varighed (nogle mål som f.eks. transkriptionsfaktorer kræver en kortere fiksationstid) og vævets alder (især efter sektionering) er alle vigtige og varierer fra mål til mål. Endelig giver arbejdet med frosset væv større fleksibilitet i udvælgelsen af mål, da behandlingen kan finde sted efter sektionering, hvilket giver mulighed for større tilpasning i assaydesignet.
Kulturceller
Cellerne skal være udsået på et støttemateriale, der er kompatibelt med fluorescensmikroskopi. Typiske understøtninger omfatter cellekulturskåle med glasbund, glasdæksler (opbevaret i plastikkulturskåle), der er forberedt med polylysin og/eller ekstracellulære matrixkomponenter for at understøtte adhærent cellekultur, og kommercielt tilgængelige multiwellkamre monteret på glasslidser, der er kompatible med mikroskoper.
Bemærk, at cellekulturbetingelser kan påvirke cellens sundhed, morfologi og ekspression/lokalisering af dit målprotein og i sidste ende diktere kvaliteten af dine IF-data. Sørg for, at dine celler er sunde ved regelmæssigt at kontrollere kulturmediet for pH-ændringer og inspicere for tegn på cellestress (f.eks. multinuklede celler) ved lav forstørrelse i et mikroskop. Kontroller også, at cellernes konfluens er passende for celletypen og målet.
Probefiksering
Det ideelle fiksationsmiddel bevarer et “livagtigt” øjebliksbillede, samtidig med at det hurtigt stopper den nedbrydende proces med autolyse ved at krydsbinde og hæmme endogene enzymer, og det præsenterer antigenet til genkendelse af antistoffet. Desværre findes der ikke én enkelt fikseringsmetode, der fungerer optimalt på alle prøver og for alle antigener. Selv forskellige antigener på det samme målprotein kan udvise forskelle mellem protokollerne. Derfor kan den bedste protokol ikke kun variere alt efter prøvetype, men også alt efter epitop (og antistof).
Væv
For friskfrosset væv skal sektioner, der er blevet frosset og kryostatskåret, nu behandles med fiksationsmiddel. Alternativt kan vævsprøver konserveres ved først at fiksere med transkardial perfusion eller nedsænkning, postfiksering og kryokonserveringstrin efterfulgt af nedfrysning og snitning.
I FFPE-vævsbehandling konserveres væv via nedsænkningsfiksering med formalin (eller et andet aldehydbaseret fiksationsmiddel) eller med perfusion som ovenfor, efterfulgt af paraffinindlejring og snitning. Inden inkubation med antistof skal sektionerne gennemgå deparaffinering, rehydrering og antigenudtagning for at give antistofferne adgang til prøven og binde målmolekyler.
Celler
Cellerne skylles med varmt proteinfrit medie eller PBS umiddelbart før fiksering for at forhindre udfældning af ekstracellulært protein og affaldsstoffer. Hurtig fiksering opnås ved hurtigt at udskifte medierne med fixeringsopløsning.
Aldehydfiksering vs. alkoholfiksering
Aldehydbaserede fixeringsmidler såsom formaldehyd, formalin (en blanding af opløst formaldehyd med en lavere procentdel methanol) og glutaraldehyd anvendes oftest, når bevarelse af strukturen er altafgørende. For de fleste antistoffer anbefaler CST fiksering med 4 % formaldehyd (methanolfri). Aldehyder reagerer med og tværbinder de primære aminer i cellulære proteiner og stabiliserer prøven. Desuden deaktiveres cellulære enzymer, herunder fosfataser og proteaser, ved tværbinding. Aldehyder krydser plasmamembranen og fikserer opløselige proteiner bedre end alkoholer, men nogle mål kan miste deres antigenicitet ved aldehydkrydsning.
Dehydrerende/denaturerende alkoholfikseringsmidler, som f.eks. methanol, fortrænger vand omkring cellulære makromolekyler, hvilket resulterer i denaturering og udfældning in situ. Denaturering af målproteinet kan afsløre begravede epitoper, hvilket gør denne fremgangsmåde fordelagtig i forhold til aldehydfiksering for nogle antistoffer. Dehydrerende fiksatorer er imidlertid mindre velegnede til opløselige mål og modifikationstilstandsspecifikke antistoffer som f.eks. fosfo-antistoffer. Kontroller produktets datablad for optimal fiksationsmetode.
Valg af permeabiliserende middel
Hvis der anvendes et tværbindende fiksationsmiddel, vil plasmamembranen stadig være intakt, hvilket gør intracellulære mål utilgængelige for antistoffer. Derfor bør permeabilisering udføres efter tværbindingsfiksering, medmindre dine antistoffer genkender ekstracellulære epitoper. Den optimale permeabiliseringsmetode varierer afhængigt af antistoffet; se altid produktsiden for anbefalet protokol.
Brug af Triton® X-100-permeabilisering efter fiksering er almindeligt. Triton og andre detergenter, såsom NP-40, TWEEN®, Saponin, Digitonin og DOTMAC, interagerer med cellemembraner for at skabe variable “porestørrelser” og give adgang til antistoffet.
Alternativt kan der udføres alkoholpermabilisering med ethanol eller methanol efter fikseringstrinnet. Denne metode kombinerer den hurtige fiksering af tværbindende fixeringsmidler med en mellemliggende denaturering af proteiner og delipidering af membranen. Dette kan forbedre signalet for visse mål, især dem, der er forbundet med organeller eller cytoskelettet.
Hvilke fix/permebetingelser skal jeg bruge ved multiplexing?
Hvis du multiplexer med antistoffer, der kræver forskellige CST-protokoller, kan du være nødt til at prioritere, hvilket antistof der skal bruges ved dets optimale betingelser. Et eksempel på optimering af rækkefølge, der udføres i mIHC, er vist i denne applikationsnote (PDF). Det kan være informativt at udføre en testkørsel i lille skala med sammenligning af forskellige protokoller, før du opskalerer dine eksperimenter.
Valg af blokeringsreagens
Den mest almindelige anbefaling er 5 % normalt gedeserum (eller serum fra samme art som det sekundære antistof) i PBS + 0,3 % Triton® X-100. Tjek databladet for anbefalet blokeringsmiddel.
Hvis der er Fc-receptorer til stede i prøven, vil antistofsignalet komme fra en blanding af specifik målgenkendelse (via antistoffets antigenbindingssted/variable område) samt uspecifik absorption af antistoffets tunge kæde, der binder sig til Fc-receptorer. Det samlede IgG i dyreserum blokerer Fc-receptorerne for at forhindre binding af primære og sekundære antistoffer og reducere baggrundsstøjen. Ved at vælge fluorforkonjugerede F(ab’)2-fragmenter undgås også Fc-receptorbinding for det sekundære antistof (men ikke for det primære antistof)
I andre antistofbaserede anvendelser, f.eks. western blotting, reducerer blokeringstrin det baggrundssignal, der skyldes uspecifik, lavere affinitetsbinding af primære og sekundære antistoffer til andre steder end deres tilsigtede mål. Vi har imidlertid fundet ud af, at rekombinante monoklonale kanin-antistoffer, der er blevet grundigt testet i IF, fungerer godt på mange prøver med eller uden blokering. I sidste ende kan man ved at vælge kvalitetsantistoffer, der er valideret i immunofluorescens, i høj grad undgå baggrundsstøj.
Antistofkoncentration og signal-støj-forhold i IF
Signal-støj-forholdet (S/N) er relateret til et antistofs specificitet og følsomhed i en bestemt anvendelse. S/N kan beregnes ved at sammenligne “signalet” af fluorescensintensiteter i celler, der udtrykker det pågældende mål, med “baggrundsstøjen” fra celler, der ikke udtrykker det pågældende mål, med “baggrundsstøjen” fra celler, der ikke udtrykker det. Hvis antistoffet anvendes i en for lav koncentration, vil fluorescenssignalet være for svagt til at kunne skelnes fra baggrundsstøj. På den anden side vil en for høj koncentration bidrage til baggrundsfarvningen, hvilket mindsker S/N. Kontroller altid produktets datablad for den anbefalede fortynding, som er baseret på titreringer udført under antistofvalidering.
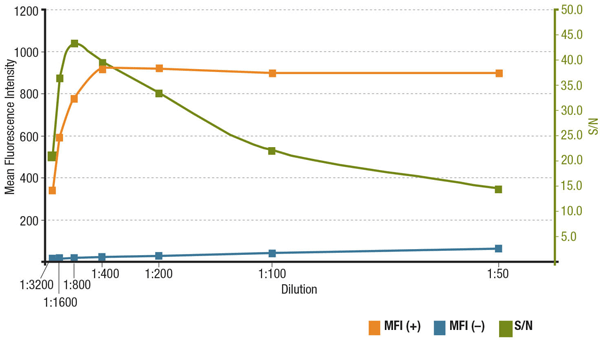
Analyse af S/N for MUC1 (D9O8K) XP® Rabbit mAb #14161 fortynding. Kvantificering af den gennemsnitlige fluorescensintensitet i udtrykkende (MFI(+), orange) ZR-75-1-celler og ikke-udtrykkende (MFI(-), blå) HCT 116-celler og beregnet S/N (grøn).
Analyse af S/N for MUC1 (D9O8K) XP® kanin-mabb #14161 fortynding. Kvantificering af gennemsnitlig fluorescensintensitet i udtrykkende (MFI(+), orange) ZR-75-1-celler og ikke-udtrykkende (MFI(-), blå) HCT 116-celler og beregnet S/N (grøn).
Antistofinkubationstid
Generelt resulterer inkubationer natten over ved 4 °C i et stærkt signal. Ændring af inkubationstid og temperatur kan ændre signalet og S/N. Forskellige antistoffer kan reagere forskelligt på ændrede inkubationsbetingelser; se mere herom i dette blogindlæg.
Har jeg brug for adgang til et konfokalt mikroskop for at udføre IF?
IF kan udføres på ethvert fluorescensmikroskop med passende excitationskilde og filtrering, herunder epifluorescerende, scanning og spinning disk konfokale mikroskoper. Immunofluorescens er også generelt kompatibel med specialiserede fluorescensteknikker, herunder total intern refleksionsfluorescens (TIRF), light sheet-mikroskopi og nogle superopløsningsteknikker.
Kompatibilitet med automatiseret high-throughput screening/high content analysis
Alle antistoffer, der er godkendt til IF-IC, kan anvendes i high throughput screening (HCS) og high content analysis (HCA). Disse eksperimenter er baseret på standard IF-teknikker med inddragelse af automatisering.
Støder du på problemer med dit IF-eksperiment? Klik her for at få en guide til fejlfinding.
Cell Signaling Technology, CST og XP er varemærker tilhørende Cell Signaling Technology, Inc. Alle andre varemærker tilhører deres respektive ejere.