Einführung
Die Immunfluoreszenz (IF) verwendet Antikörper und Fluoreszenzdetektion, um die Lokalisierung, die relative Expression und den Aktivierungszustand von Zielproteinen in fixierten Zellen oder Geweben zu untersuchen. IF wird in vielen Bereichen eingesetzt.
IF kann verwendet werden, um Fragen zu beantworten wie:
- Welche Zellen oder Gewebe exprimieren mein(e) Zielprotein(e)?
- Wie verändert sich die Expression und/oder Aktivierung meines Zielproteins als Reaktion auf experimentelle Störungen?
- Wo in der Zelle/im Gewebe ist das Zielprotein lokalisiert?
- Was ist die räumliche Beziehung zwischen verschiedenen Zielproteinen im Kontext der Zell- oder Gewebestruktur?
Die Immunfluoreszenz umfasst eine Reihe verwandter Techniken, die sich im Laufe der Zeit entwickelt haben. Alle diese Techniken nutzen die spezifische Erkennung biologischer Ziele durch Antikörper und den Nachweis von fluoreszierenden Reportern in der zytometrischen Analyse. Es ist wichtig sicherzustellen, dass die biologische Probe gut erhalten ist und die Zielantigene für die Antikörper zugänglich sind. Dies kann jedoch je nach Probe, Ziel und Antikörper unterschiedliche Herausforderungen mit sich bringen.
Auf dieser Seite haben wir Ressourcen zusammengestellt, die Ihnen bei der Navigation durch die Protokolle helfen, allgemeine Fragen beantworten und Sie bei der Planung erfolgreicher IF-Experimente unterstützen.
Auswahl der richtigen IF-Technik und des richtigen Protokolls
Die optimale IF-Technik/das optimale IF-Protokoll wird durch die Art des biologischen Materials, die Schritte der Probenverarbeitung, die Eigenschaften des Zielantigens und den verwendeten Antikörper beeinflusst.
Zu den Überlegungen gehören:
- Bei den Ausgangsmaterialien kann es sich um kultivierte Zelllinien, gefrorenes Gewebe oder in Formalin fixiertes, in Paraffin eingebettetes Gewebe (FFPE) handeln.
- Für kultivierte Zelllinien und Primärzellen sollten Sie nach Antikörpern suchen, die für die Immunfluoreszenz-Immunzytochemie (IF-IC) validiert sind.
- In vielen Labors wird „Immunhistochemie/IHC“ als Sammelbegriff für Gewebe verwendet, das entweder in Paraffin eingebettet oder eingefroren ist, und kann sowohl für den chromogenen als auch den fluoreszierenden Nachweis verwendet werden. Auf cellsignal.com wird bei den Anwendungen zwischen gefrorenen (IF-F) und in Paraffin eingebetteten Gewebepräparaten unterschieden.
- Für FFPE-Gewebeproben können Antikörper, die für die Immunhistochemie (IHC-P) validiert wurden, auch mit Fluoreszenzdetektion ohne Verstärkung verwendet werden, wenn das Zielantigen reichlich vorhanden ist, oder in der Multiplex-IHC (mIHC) mit Signalverstärkung.
- Ein Antikörper kann für eine oder mehrere der oben aufgeführten Anwendungen validiert werden. Die Protokollempfehlungen sind das Ergebnis von Tests, die von Wissenschaftlern während des Validierungsprozesses durchgeführt wurden.
- Produktspezifische Protokolle sind auf der jeweiligen Produktwebseite zu finden. Für IF-validierte Antikörper wählen Sie „IF“ auf der Produktseite, um IF-Validierungsdaten und -protokolle anzuzeigen. Grundlegende Informationen (Verdünnungen/Arbeitskonzentration, validierte Anwendungen, Speziesreaktivität, Wirtsspezies) für jeden Antikörper sind im Produktdatenblatt enthalten.
- Die am häufigsten verwendeten IF-Protokolle finden Sie ebenfalls auf der Protokollseite.
- Sollen oder müssen Sie keine Fluoreszenzdetektion für Ihre Gewebeproben verwenden? Eine Alternative ist die chromogene Detektion, die auf der IHC-Seite beschrieben wird.
Auswahl der Antikörper für IF: die Bedeutung der Antikörper-Validierung
Die besten Antikörper liefern ein starkes, spezifisches Signal mit minimalem Hintergrund. Es ist wichtig, Antikörper zu wählen, die für die von Ihnen verwendete Anwendung validiert wurden. Die Validierung von Antikörpern in der IF kann positive und negative Expressionsexperimente (unter Verwendung von Knockout-Zelllinien, genetischen Modellen, CRISPR oder RNAi), experimentelle Manipulationen der Zielproteinlokalisierung oder posttranslationale Modifikationen und Protokolloptimierung umfassen.
Die Leistung eines Antikörpers variiert je nach Anwendung. Ein Antikörper, der beispielsweise in einem Western-Blot-Experiment gut abschneidet, kann in einem IF-Experiment gut oder schlecht abschneiden. Bei der Erprobung neuer Antikörper zeigen einige von ihnen eine geringfügige Off-Target-Bindung; diese werden niemals für IF oder andere Nicht-WB-Anwendungen empfohlen. Außerdem kann ein Antikörper bei gefrorenem Gewebe gut funktionieren, bei FFPE-Gewebe jedoch nicht, oder umgekehrt. Die Empfindlichkeit und Leistung von Antikörpern kann sich je nach Fixierung und Verarbeitung der Probe und je nach Arbeitsbedingungen des Antikörpers ändern.
Wenn Sie sich entschieden haben, welche Art von biologischen Proben Sie in Ihrem Experiment verwenden möchten und wie diese vorbereitet werden sollen, ist es am einfachsten, die Antikörper auf cellsignal.com zu durchsuchen, indem Sie zunächst die entsprechende Anwendung auswählen. Anschließend können Sie Suchbegriffe eingeben oder andere Attribute (wie Wirtsspezies, Forschungsgebiet usw.) auswählen, um Ihre Suche weiter zu verfeinern und einen Antikörper auszuwählen, der für die von Ihnen benötigte Anwendung validiert wurde.
Kontrollexperimente für IF
Um sicher zu sein, dass Ihr Versuchsplan und Ihre Ergebnisse korrekt sind und dass Ihr Antikörper sein Ziel genau wiedergibt, können positive und negative Kontrollexperimente aufschlussreich sein. Zum Beispiel:
- Nur-Sekundärkontrollen können Aufschluss darüber geben, ob eine unspezifische Bindung des sekundären Antikörpers vorliegt.
- Bestätigen Sie die Spezifität eines primären Antikörpers, indem Sie Knockout/siRNA-Experimente konzipieren oder bekannte exprimierende und nicht exprimierende Zelllinien vergleichen.
- Einzelzielexperimente werden bei der Einrichtung eines Spectral Unmixing Imaging verwendet. Diese Art von Experimenten kann helfen festzustellen, ob ein Mangel an Färbung auf eine sterische Behinderung zurückzuführen ist, die auftritt, wenn sich zwei Antigene in unmittelbarer Nähe zueinander befinden.
- Behandeln Sie Proben mit Phosphatase, um zu bestätigen, dass phosphospezifische Antikörper nur das phosphorylierte Ziel in der IF erkennen.
- Wenn Sie Probleme mit der Fixierung oder Permeabilisierung vermuten, kann die Überprüfung mit einem Antikörper, der in der Vergangenheit in Ihrem Labor funktioniert hat, bei der Fehlersuche hilfreich sein.
Wissenschaftler von Cell Signaling Technology (CST) führen diese Art von Kontrollen routinemäßig als Teil unseres Validierungsprozesses durch (siehe ein Beispiel). Es kann sich lohnen, ähnliche Kontrollen in Ihrem experimentellen Modellsystem einzurichten, insbesondere wenn Sie Schwierigkeiten haben, die gewünschten Ergebnisse zu erzielen.
Primäre vs. sekundäre Antikörper und direkte vs. indirekte Färbung
Primäre Antikörper bieten eine spezifische Erkennung des Zielantigens. Sekundäre Antikörper binden an primäre Antikörper auf der Grundlage der Spezies, in der sie gezüchtet wurden. Primäre Antikörper, die in Kaninchen oder Mäusen gezüchtet wurden, können mit sekundären Antikörpern gegen Kaninchen bzw. gegen Mäuse nachgewiesen werden.
Die Kombination eines primären Antikörpers mit einem sekundären Antikörper (spezifisch für die Wirtsspezies des primären Antikörpers), der mit einem Fluorophor konjugiert ist, wird als indirekte Färbung bezeichnet. Die Verwendung von primären Antikörpern, die mit Fluorophoren konjugiert sind, ohne sekundäre Antikörper, wird als direkte Färbung bezeichnet. Direkte Färbemethoden sparen Zeit und ermöglichen das Multiplexing unter Verwendung von Antikörpern, die in derselben Wirtsspezies gezüchtet wurden. Indirektes Färben bietet traditionell eine höhere Empfindlichkeit dank der Signalverstärkung, die auftritt, wenn mehrere sekundäre Antikörper an einen einzigen primären Antikörper binden.
Es gibt weitere Variationen dieser Techniken, z. B. die Verwendung von biotinylierten primären Antikörpern mit Avidin/Streptavidin-konjugiertem Fluorochrom. Mit Fluorophoren konjugierte F(ab‘)2-Sekundärantikörperfragmente (ohne Fc-Domäne) können zur Verringerung des Hintergrunds beitragen. Bei mIHC werden mit Meerrettichperoxidase (HRP) konjugierte sekundäre Antikörper verwendet, um die Ablagerung von Tyramid-Fluorophor-Konjugaten zu katalysieren.
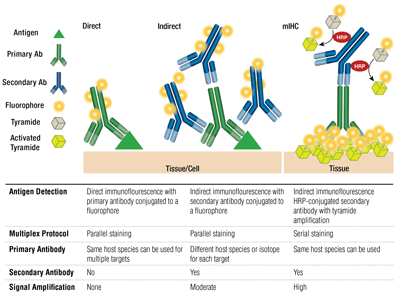
Auswahl von Antikörpern mit Fluorophoren
Auswahl von Antikörpern mit Fluorophoren
Wie viele Ziele/Antikörper können gemultiplext werden?
Multiplexing bedeutet den gleichzeitigen Nachweis von mehr als einem Ziel durch mehrere Antikörper und den Nachweis verschiedener Wellenlängen (Farben) für jedes Ziel. Bei der indirekten Färbung beruht die Fähigkeit zum Multiplexing auf der Kopplung von Fluorophor-konjugierten, speziesspezifischen Sekundärantikörpern an jeden Primärantikörper. Maus-Antikörper verschiedener Isotypen können auch mit isotyp-spezifischen Sekundärantikörpern gemultiplext werden, was den Nachweis von bis zu 5 Maus-Antikörpern gleichzeitig ermöglicht. Für die direkte Färbung sollte jeder primäre Antikörper an ein anderes Fluorophor gekoppelt werden. Auf diese Weise können mehrere Antikörper der gleichen Spezies/des gleichen Isotyps kombiniert werden, und es ist auch eine „Maus-auf-Maus“-Färbung möglich, da die unspezifische Bindung von sekundären Anti-Maus-Antikörpern an Mausgewebe kein Problem darstellt.
Beim Entwurf von Multiplex-IF-Experimenten sollten die spektralen Eigenschaften des Fluoreszenzmikroskops, einschließlich der verfügbaren Anregungsquellen und Filtersätze, berücksichtigt werden, um spektrales Durchscheinen zu vermeiden. Moderne epifluoreszente und konfokale Fluoreszenzmikroskope können in der Regel 3 oder mehr Kanäle unterscheiden.
Kombinieren von Antikörperfärbung mit Farbstoffen oder Markierungen
Zelluläre Farbstoffe, die nach der Fixierung aufgetragen werden, oder fixierbare Markierungen von lebenden Zellen können in einen IF-Arbeitsablauf integriert werden. Die Markierung von Organellen wird häufig verwendet, um die subzelluläre Lokalisierung eines Ziels zu überprüfen. Expressierte Markierungen wie GFP werden häufig verwendet, um transfizierte Zellen oder in Mosaikexperimenten zu verfolgen; wenn das GFP-Fluoreszenzsignal gering ist, kann ein Anti-GFP-Antikörper in der IF eingesetzt werden. Die Verwendung von Farbstoffen oder fluoreszierenden Proteinen belegt Fluoreszenzkanäle, so dass weniger für Antikörper zur Verfügung stehen.
Auswahl der Fluorophore für Ihr Experiment
Dies hängt von den spektralen Eigenschaften der Anregungsquelle und der Anregungs-/Emissionsfilterung ab, die Ihnen zur Verfügung stehen. Bewerten Sie das Anregungs- und Emissionsprofil des Fluorophors, bevor Sie Ihr Experiment durchführen, um ein Durchscheinen der Fluoreszenz zu vermeiden. CST bietet eine Reihe von Fluorophore-konjugierten primären und sekundären Antikörpern an, darunter auch Farbstoffe der Alexa Fluor®-Reihe.
Probenvorbereitung
Gewebe
Gewebeschnitte können entweder durch Schnellgefrieren in einem Medium mit optimaler Schnitttemperatur (OCT) oder durch Fixieren und Einbetten in Paraffin vorbereitet werden. Eingefrorene Proben können mit einem Kryostaten geschnitten und vor der Fixierung 10 bis 15 Minuten an der Luft auf dem Objektträger trocknen gelassen werden. Bei FFPE-Gewebeproben können die Anforderungen für die Schritte Entnahme, Fixierung und Paraffineinbettung je nach Gewebetyp variieren.
Gefrorenes vs. FFPE-Gewebe
Im Allgemeinen weist FFPE-Gewebe eine bessere Morphologie auf als OCT-einbettendes gefrorenes Gewebe. Dies kann die Quantifizierung positiver Zellen oder die Identifizierung von Grenzen zwischen Färbungen erleichtern. FFPE-Gewebe ist außerdem sehr stabil; einmal eingebettet, können Gewebeblöcke jahrelang gelagert werden. Diese Art von Gewebe lässt sich auch leichter von einem Labor zum anderen transportieren und ist die bevorzugte Verarbeitungsmethode für humanpathologische Proben.
Andererseits durchläuft FFPE-Gewebe mehrere zusätzliche Verarbeitungsschritte, die die Gesamtmenge des Antigens aufgrund des Proteinabbaus verringern, Demaskierungsschritte zum Nachweis des verbleibenden Antigens erfordern und die aldehydinduzierte Autofluoreszenz verstärken. Wenn es sich nicht um ein sehr reichlich vorhandenes Protein handelt, kann das verbleibende Antigen durch indirekte IF nur schwer nachgewiesen werden und erfordert möglicherweise eine Amplifikation, um eine geeignete Färbung zu erhalten. Es ist auch möglich, dass Antigen-Retrieval Antigene demaskiert, die normalerweise nicht erkannt werden, und dass ein Antikörper, der sonst das erwartete Färbemuster liefert, eine unspezifische Färbung ergibt. Es ist auch möglich, mit einem Ziel zu arbeiten, bei dem eine spezifische Methode der Antigenrückgewinnung erforderlich ist, um das Zielepitop zu erkennen. Daher ist es wichtig, sich zu überlegen, wie ein Antikörper validiert wird und welche Schritte für seine Verwendung erforderlich sind.
Im Falle von OCT-eingebettetem gefrorenem Gewebe hat die Reduzierung der Verarbeitung Vorrang vor der Morphologie. Dies ist die schnellste Methode, um Immunfärbungsergebnisse zu erhalten, da die Objektträger in dem Moment einsatzbereit sind, in dem das Gewebe geschnitten wird, und es weniger Verarbeitungsschritte vor der Einbettung gibt. Es findet weniger Proteinabbau statt, und es steht mehr Antigen zur Bindung von Antikörpern zur Verfügung, ohne dass zusätzliche, belastende Retrievalschritte erforderlich sind. Da diese Methode keine Amplifikation erfordert, ist sie empfindlicher für die Gewebequalität. Die Art der Fixierung (Alkohol oder Aldehyd), die Dauer (einige Zielmoleküle wie z. B. Transkriptionsfaktoren erfordern eine kürzere Fixierungszeit) und das Alter des Gewebes (insbesondere nach dem Schneiden) sind wichtig und variieren je nach Zielmolekül. Schließlich bietet die Arbeit mit gefrorenem Gewebe mehr Flexibilität bei der Auswahl der Ziele, da die Verarbeitung nach der Sektion erfolgen kann, was eine größere Anpassungsfähigkeit beim Assay-Design ermöglicht.
Kultivierte Zellen
Zellen müssen auf einem Trägermaterial ausgesät werden, das mit der Fluoreszenzmikroskopie kompatibel ist. Typische Trägermaterialien sind Zellkulturschalen mit Glasboden, Glasdeckgläser (die in Plastikkulturschalen aufbewahrt werden), die mit Polylysin und/oder extrazellulären Matrixkomponenten präpariert sind, um die adhärente Zellkultur zu unterstützen, und handelsübliche Multiwell-Kammern, die auf mikroskopkompatible Glasträger montiert sind.
Beachten Sie, dass die Zellkulturbedingungen die Gesundheit der Zellen, die Morphologie und die Expression/Lokalisierung Ihres Zielproteins beeinträchtigen können und letztlich die Qualität Ihrer IF-Daten bestimmen. Vergewissern Sie sich, dass Ihre Zellen gesund sind, indem Sie das Kulturmedium regelmäßig auf pH-Veränderungen und Anzeichen von Zellstress (z. B. vielkernige Zellen) bei geringer Vergrößerung unter dem Mikroskop überprüfen. Überprüfen Sie auch, ob die Konfluenz der Zellen für den Zelltyp und das Ziel angemessen ist.
Probenfixierung
Das ideale Fixiermittel bewahrt einen „lebensechten“ Schnappschuss und stoppt gleichzeitig schnell den Abbauprozess der Autolyse durch Vernetzung und Hemmung endogener Enzyme, und es präsentiert das Antigen für die Erkennung durch den Antikörper. Leider gibt es keine einzige Fixierungsmethode, die bei jeder Probe und jedem Antigen ideal funktioniert. Selbst verschiedene Antigene auf demselben Zielprotein können Unterschiede zwischen den Protokollen aufweisen. Aus diesem Grund kann das beste Protokoll nicht nur je nach Probentyp, sondern auch je nach Epitop (und Antikörper) variieren.
Gewebe
Bei frisch eingefrorenem Gewebe sollten Schnitte, die eingefroren und kryostatisch geschnitten wurden, jetzt mit Fixiermittel behandelt werden. Alternativ können Gewebeproben konserviert werden, indem sie zunächst durch transkardiale Perfusion oder Immersion fixiert werden, dann nachfixiert und kryokonserviert werden und anschließend eingefroren und geschnitten werden.
Bei der Verarbeitung von FFPE-Gewebe wird das Gewebe durch Immersionsfixierung mit Formalin (oder einem anderen Fixiermittel auf Aldehydbasis) oder durch Perfusion wie oben beschrieben konserviert, gefolgt von Paraffineinbettung und Schnitt. Vor der Inkubation mit Antikörpern müssen die Schnitte entparaffiniert, rehydriert und Antigene abgetrennt werden, damit die Antikörper die Probe erreichen und die Zielmoleküle binden können.
Zellen
Das Spülen der Zellen mit warmen proteinfreien Medien oder PBS unmittelbar vor der Fixierung kann die Ausfällung von extrazellulärem Protein und Trümmern verhindern. Eine schnelle Fixierung wird durch den raschen Austausch des Mediums gegen die Fixierlösung erreicht.
Aldehydfixierung vs. Alkoholfixierung
Fixiermittel auf Aldehydbasis wie Formaldehyd, Formalin (eine Mischung aus gelöstem Formaldehyd mit einem geringeren Anteil an Methanol) und Glutaraldehyd werden am häufigsten verwendet, wenn die Erhaltung der Struktur von größter Bedeutung ist. Für die meisten Antikörper empfiehlt die CST die Fixierung mit 4 % Formaldehyd (methanolfrei). Aldehyde reagieren mit den primären Aminen der zellulären Proteine und vernetzen sie, wodurch die Probe stabilisiert wird. Darüber hinaus werden zelluläre Enzyme, einschließlich Phosphatasen und Proteasen, durch die Quervernetzung inaktiviert. Aldehyde durchdringen die Plasmamembran und fixieren lösliche Proteine besser als Alkohole, aber einige Zielproteine können durch die Aldehydvernetzung ihre Antigenität verlieren.
Dehydratisierende/denaturierende alkoholische Fixierungsmittel wie Methanol verdrängen das Wasser um die zellulären Makromoleküle, was zu deren Denaturierung und Ausfällung in situ führt. Die Denaturierung des Zielproteins kann vergrabene Epitope freilegen, so dass dieser Ansatz für einige Antikörper gegenüber der Aldehydfixierung von Vorteil ist. Dehydrierende Fixiermittel sind jedoch weniger geeignet für lösliche Zielproteine und modifizierungszustandsspezifische Antikörper wie Phospho-Antikörper. Informieren Sie sich im Produktdatenblatt über die optimale Fixierungsmethode.
Auswahl eines Permeabilisierungsmittels
Wird ein vernetzendes Fixierungsmittel verwendet, ist die Plasmamembran noch intakt, so dass intrazelluläre Ziele für Antikörper unzugänglich sind. Daher sollte die Permeabilisierung nach der vernetzenden Fixierung durchgeführt werden, es sei denn, Ihre Antikörper erkennen extrazelluläre Epitope. Die optimale Permeabilisierungsmethode variiert je nach Antikörper; das empfohlene Protokoll finden Sie immer auf der Produktseite.
Die Verwendung von Triton® X-100 zur Permeabilisierung nach der Fixierung ist üblich. Triton und andere Detergenzien wie NP-40, TWEEN®, Saponin, Digitonin und DOTMAC interagieren mit zellulären Membranen, um variable „Porengrößen“ zu erzeugen und den Zugang zu Antikörpern zu ermöglichen.
Alternativ kann nach dem Fixierungsschritt eine Alkohol-Permabilisierung mit Ethanol oder Methanol durchgeführt werden. Diese Methode kombiniert die schnelle Fixierung von vernetzenden Fixiermitteln mit einer mittleren Proteindenaturierung und Delipidierung der Membran. Dies kann das Signal für bestimmte Zielmoleküle verbessern, insbesondere für solche, die mit Organellen oder dem Zytoskelett assoziiert sind.
Welche Fixierungs-/Perm-Bedingungen verwende ich beim Multiplexing?
Wenn Sie mit Antikörpern multiplexen, für die unterschiedliche CST-Protokolle erforderlich sind, müssen Sie möglicherweise Prioritäten setzen, welcher Antikörper unter seinen optimalen Bedingungen verwendet werden soll. Ein Beispiel für die Optimierung der Reihenfolge bei mIHC finden Sie in diesem Anwendungshinweis (PDF). Die Durchführung eines kleinen Testlaufs, bei dem verschiedene Protokolle verglichen werden, kann aufschlussreich sein, bevor Sie Ihre Experimente ausweiten.
Auswahl eines Blockierungsreagenzes
Die häufigste Empfehlung ist 5% normales Ziegenserum (oder Serum derselben Spezies wie der Sekundärantikörper) in PBS + 0,3% Triton® X-100. Die empfohlenen Blockierungsmittel sind dem Datenblatt zu entnehmen.
Wenn Fc-Rezeptoren in der Probe vorhanden sind, entsteht das Antikörpersignal durch eine Mischung aus spezifischer Zielerkennung (über die Antigenbindungsstelle/variable Region des Antikörpers) und unspezifischer Absorption der schweren Kette des Antikörpers, die an Fc-Rezeptoren bindet. Das im Tierserum vorhandene Gesamt-IgG blockiert die Fc-Rezeptoren, um die Bindung von Primär- und Sekundärantikörpern zu verhindern und das Hintergrundrauschen zu verringern. Die Wahl von Fluorophor-konjugierten F(ab‘)2-Fragmenten verhindert ebenfalls die Bindung von Fc-Rezeptoren für den sekundären Antikörper (aber nicht für den primären Antikörper)
In anderen Antikörper-basierten Anwendungen, wie z.B. Western Blotting, reduzieren Blockierungsschritte das Hintergrundsignal, das durch unspezifische, niedrigaffine Bindung von primären und sekundären Antikörpern an andere Stellen als das beabsichtigte Ziel verursacht wird. Wir haben jedoch festgestellt, dass rekombinante monoklonale Kaninchen-Antikörper, die im IF-Verfahren eingehend getestet wurden, bei vielen Proben mit oder ohne Blockierung gut funktionieren. Letztendlich trägt die Wahl von Qualitätsantikörpern, die in der Immunfluoreszenz validiert wurden, wesentlich dazu bei, Hintergrundrauschen zu vermeiden.
Antikörperkonzentration und Signal-Rausch-Verhältnis in der IF
Das Signal-Rausch-Verhältnis (S/N) hängt mit der Spezifität und Empfindlichkeit eines Antikörpers in einer bestimmten Anwendung zusammen. Das Signal-Rausch-Verhältnis kann berechnet werden, indem man das „Signal“ der Fluoreszenzintensitäten in Zellen, die das Zielmolekül exprimieren, mit dem „Hintergrundrauschen“ der Zellen vergleicht, die es nicht exprimieren. Wird der Antikörper in einer zu niedrigen Konzentration eingesetzt, ist das Fluoreszenzsignal zu schwach, um es vom Hintergrundrauschen zu unterscheiden. Andererseits trägt eine zu hohe Konzentration zur Hintergrundfärbung bei, wodurch sich das S/N verringert. Die empfohlene Verdünnung ist stets dem Produktdatenblatt zu entnehmen und basiert auf Titrationen, die während der Antikörpervalidierung durchgeführt wurden.
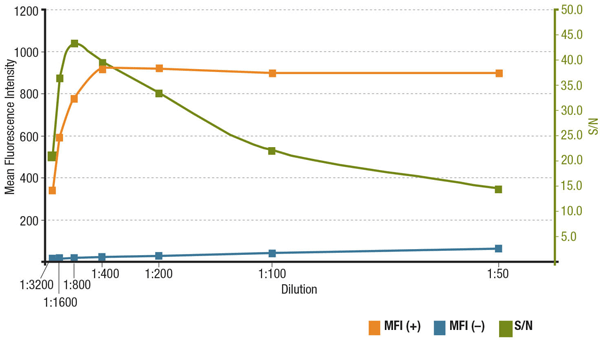
Analyse des S/N für MUC1 (D9O8K) XP® Rabbit mAb #14161 Verdünnung. Quantifizierung der mittleren Fluoreszenzintensität in exprimierenden (MFI(+), orange) ZR-75-1-Zellen und nicht-exprimierenden (MFI(-), blau) HCT 116-Zellen und Berechnung des S/N (grün).
Analyse des S/N für MUC1 (D9O8K) XP® Rabbit mAb #14161 Verdünnung. Quantifizierung der mittleren Fluoreszenzintensität in exprimierenden (MFI(+), orange) ZR-75-1-Zellen und nicht-exprimierenden (MFI(-), blau) HCT 116-Zellen und berechneter S/N-Wert (grün).
Inkubationszeit des Antikörpers
In der Regel führt eine Inkubation über Nacht bei 4°C zu einem starken Signal. Eine Änderung der Inkubationszeit und der Temperatur kann das Signal und das S/N verändern. Verschiedene Antikörper können auf geänderte Inkubationsbedingungen unterschiedlich reagieren; weitere Informationen finden Sie in diesem Blog-Beitrag.
Brauche ich ein konfokales Mikroskop, um IF durchzuführen?
IF kann mit jedem Fluoreszenzmikroskop mit geeigneter Anregungsquelle und Filterung durchgeführt werden, einschließlich Epifluoreszenz-, Scanning- und Spinning-Disk-Konfokalmikroskopen. Die Immunfluoreszenz ist im Allgemeinen auch mit spezialisierten Fluoreszenztechniken kompatibel, einschließlich der internen Totalreflexionsfluoreszenz (TIRF), der Lichtblattmikroskopie und einigen Superresolutionstechniken.
Kompatibilität mit automatisiertem High-Throughput-Screening/High-Content-Analyse
Jeder für IF-IC zugelassene Antikörper kann im High-Throughput-Screening (HCS) und in der High-Content-Analyse (HCA) verwendet werden. Diese Experimente basieren auf Standard-IF-Techniken und beinhalten eine Automatisierung.
Stoßen Sie auf Probleme mit Ihrem IF-Experiment? Klicken Sie hier für eine Anleitung zur Fehlerbehebung.
Cell Signaling Technology, CST und XP sind Marken von Cell Signaling Technology, Inc. Alle anderen Marken sind das Eigentum ihrer jeweiligen Inhaber.