In den Anfängen der organischen Chemie wurden Alkene als „ungesättigt“ bezeichnet, weil man feststellte, dass sie im Gegensatz zu den „gesättigten“ Alkanen leicht mit Substanzen wie Halogenen, Halogenwasserstoffen, Oxidationsmitteln usw. reagieren. Daher wurde die „chemische Affinität“ von Alkenen als unbefriedigend oder „ungesättigt“ angesehen. (Siehe auch Abschnitt 1-1I.)
Ein Grund dafür, dass Alkene und Alkine leichter reagieren als Alkane, liegt darin, dass die Kohlenstoff-Kohlenstoff-Bindungen einer Mehrfachbindung individuell schwächer sind als normale Kohlenstoff-Kohlenstoff-Einfachbindungen. Betrachten Sie die beteiligten Bindungsenergien. Nach Tabelle 4-3 betragen die Stärken von Kohlenstoff-Kohlenstoff-Einfach-, Doppel- und Dreifachbindungen \(83\), \(146\) bzw. \(200 \: \text{kcal}\). Aus diesen Werten können wir berechnen, dass die Spaltung einer Hälfte einer Kohlenstoff-Kohlenstoff-Doppelbindung \(63 \: \text{kcal}\) und die Spaltung eines Drittels einer Kohlenstoff-Kohlenstoff-Dreifachbindung \(54 \: \text{kcal}\) erfordern sollte:

Als Ergebnis werden Additionsreaktionen an Mehrfachbindungen voraussichtlich etwa \(20\)-\(30 \: \text{kcal}\) exothermer sein als die entsprechenden Spaltungsreaktionen von Kohlenstoff-Kohlenstoff-Einfachbindungen, wie hier für die Reaktion mit Brom geschätzt wird:
Der erhebliche Unterschied in den Reaktionswärmegraden von Ethan, Ethen und Ethin mit Brom spiegelt sich in einer sehr wichtigen praktischen Überlegung im Umgang mit Ethin (Acetylen) wider, nämlich seiner thermodynamischen Stabilität gegenüber festem Kohlenstoff und Wasserstoffgas. Im Gegensatz zu Ethan kann anhand der Bindungsenergien gezeigt werden, dass sowohl Ethen als auch Ethyne in Bezug auf die Bildung von festem Kohlenstoff und gasförmigem Wasserstoff instabil sind:
Obwohl dies bei Ethen keine besonderen Probleme zu bereiten scheint, kann es zu einer explosiven Zersetzung von Ethyne zu Kohlenstoff und Wasserstoff kommen, wenn das Gas auf \(10\)-\(20 \: \text{kg cm}^{-2}\) komprimiert wird. Auch flüssiges Ethin (bp \sim 83^\text{o}\)) muss mit Vorsicht behandelt werden. Ethin wird im Handel nicht unter Druck verwendet, es sei denn, es wird mit einem Inertgas gemischt und in robusten Geräten gehandhabt. Ethin verbrennt mit reinem Sauerstoff und erzeugt eine sehr heiße Flamme, die häufig zum Schweißen verwendet wird. Zu diesem Zweck wird das Gas unter etwa \(15 \: \text{kg cm}^{-2}\) in 2-Propanon (Aceton, 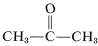 , bp \(56,5^\text{o}\)) gelöst und in mit Kieselgur gefüllten Zylindern aufbewahrt.
, bp \(56,5^\text{o}\)) gelöst und in mit Kieselgur gefüllten Zylindern aufbewahrt.
Warum ist Ethin so viel weniger stabil als Ethen oder Ethan? Erstens sind \(\ce{C-C}\)-Bindungen nicht so stark wie \(\ce{C-H}\)-Bindungen. Daher ist normalerweise ein Stabilitätsgewinn zu erwarten, wenn \(\ce{C-H}\)-Bindungen auf Kosten von \(\ce{C-C}\)-Bindungen hergestellt werden; Ethen und Ethan haben jeweils mehr \(\ce{C-H}\)-Bindungen als Ethin. Zweitens hat Ethin sechs Elektronen, die zwischen den beiden Kohlenstoffen gehalten werden, und diese Elektronen stoßen sich gegenseitig stark ab. Dies erklärt die Tatsache, dass die durchschnittliche Bindungsstärke für die Dreifachbindung eines Alkins \(200/3 = 67 \: \text{kcal}\) beträgt, verglichen mit \(146/2 = 73 \: \text{kcal}\) für die Doppelbindung eines Alkens und \(83 \: \text{kcal}\) für eine normale Einfachbindung eines Alkans.
- John D. Robert und Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Dieser Inhalt ist unter den folgenden Bedingungen urheberrechtlich geschützt: „Sie erhalten die Erlaubnis zur individuellen, bildungsbezogenen, wissenschaftlichen und nicht kommerziellen Vervielfältigung, Verbreitung, Darstellung und Aufführung dieses Werks in jedem Format.“