Reale und ideale Gase
Ein ideales Gas ist ein Gas, das unter allen Temperatur- und Druckbedingungen den Gasgesetzen folgt. Dazu müsste das Gas die kinetisch-molekulare Theorie vollständig einhalten. Die Gasteilchen müssten ein Volumen von Null einnehmen und keinerlei Anziehungskräfte aufeinander ausüben. Da keine dieser Bedingungen erfüllt sein kann, gibt es kein ideales Gas. Ein reales Gas ist ein Gas, das sich nicht gemäß den Annahmen der kinetisch-molekularen Theorie verhält. Glücklicherweise verhalten sich reale Gase unter den im Labor üblichen Temperatur- und Druckbedingungen sehr ähnlich wie ideale Gase.
Unter welchen Bedingungen verhalten sich Gase also am wenigsten ideal? Wenn ein Gas unter hohen Druck gesetzt wird, werden seine Moleküle enger zusammengedrängt, da sich der leere Raum zwischen den Teilchen verkleinert. Eine Verringerung des leeren Raums bedeutet, dass die Annahme, das Volumen der Teilchen selbst sei vernachlässigbar, weniger gültig ist. Wenn ein Gas abgekühlt wird, führt die Abnahme der kinetischen Energie der Teilchen dazu, dass sie langsamer werden. Wenn sich die Teilchen langsamer bewegen, sind die Anziehungskräfte zwischen ihnen stärker ausgeprägt. Eine andere Sichtweise ist, dass sich das Gas bei fortgesetzter Abkühlung schließlich in eine Flüssigkeit verwandelt, und eine Flüssigkeit ist sicherlich kein ideales Gas mehr (siehe Flüssigstickstoff in der Abbildung unten). Zusammenfassend lässt sich sagen, dass ein reales Gas bei niedrigen Temperaturen und hohen Drücken am meisten von einem idealen Gas abweicht. Gase sind bei hoher Temperatur und niedrigem Druck am idealsten.

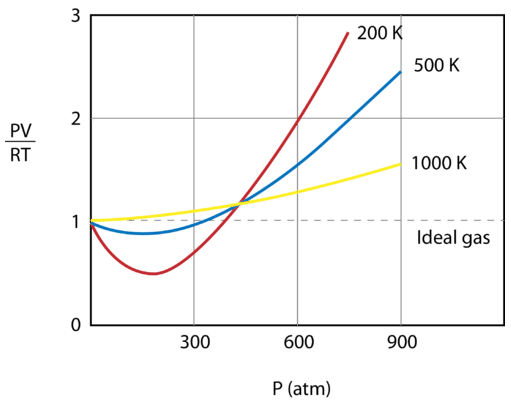
Die folgende Abbildung zeigt ein Diagramm von \(\frac{PV}{RT}\) aufgetragen gegen den Druck für \(1 \: \text{mol}\) eines Gases bei drei verschiedenen Temperaturen – \(200 \: \text{K}\), \(500 \: \text{K}\) und 1000 \: \text{K}\). Ein ideales Gas hätte für dieses Verhältnis bei allen Temperaturen und Drücken einen Wert von 1, und das Diagramm wäre einfach eine horizontale Linie. Wie man sieht, treten Abweichungen von einem idealen Gas auf. Wenn der Druck zu steigen beginnt, bewirken die Anziehungskräfte, dass das Volumen des Gases geringer ist als erwartet und der Wert von \(\frac{PV}{RT}\) unter 1 fällt. Ein weiterer Druckanstieg führt dazu, dass das Volumen der Teilchen signifikant wird und der Wert von \(\frac{PV}{RT}\) auf über 1 ansteigt. Beachten Sie, dass das Ausmaß der Abweichungen von der Idealität für das Gas bei \(200 \: \text{K}\) am größten und für das Gas bei \(1000 \: \text{K}\) am kleinsten ist.
Die Idealität eines Gases hängt auch von der Stärke und Art der zwischenmolekularen Anziehungskräfte ab, die zwischen den Teilchen bestehen. Gase, deren Anziehungskräfte schwach sind, sind idealer als solche mit starken Anziehungskräften. Bei gleicher Temperatur und gleichem Druck ist Neon idealer als Wasserdampf, weil die Neonatome nur durch schwache Dispersionskräfte angezogen werden, während die Moleküle von Wasserdampf durch relativ starke Wasserstoffbrückenbindungen angezogen werden. Helium ist ein idealeres Gas als Neon, weil die Dispersionskräfte von Helium aufgrund der geringeren Anzahl von Elektronen noch schwächer sind als die von Neon.