Kekulé-Struktur für Benzol
Benzol hatte bekanntlich die Summenformel C6H6, aber seine Strukturformel war unbekannt.
Wenn Benzol ein geradkettiger ungesättigter Kohlenwasserstoff war, sollte es leicht Additionsreaktionen durchlaufen (genau wie andere Alkene und Alkine).
Brom, Br2, sollte zum Beispiel über die Doppel- oder Dreifachbindung addieren, wie unten gezeigt:
| mögliche Additionsreaktion mit geradkettiger Struktur: | |||
| CH3-C≡C-C≡C-CH3 | + Br2 | → | CH3-CBr=CBr-C≡C-CH3 |
Aber, Wenn man Brom zu Benzol bei 25°C und 1 atm (101.3 kPa) zugegeben wird, scheint keine Reaktion stattzufinden.
Die möglichen Strukturen für Benzol, bei denen Doppel- und/oder Dreifachbindungen in einer Kette angeordnet sind, scheinen also sehr unwahrscheinlich zu sein, da diese Additionsreaktionen unterliegen sollten.
Wird Brom in Gegenwart von FeBr3 zu Benzol gegeben, kommt es zu einer Substitutionsreaktion, bei der eines der Wasserstoffatome durch ein Bromatom ersetzt wird und eine Verbindung mit der Formel C6H5Br entsteht, wie unten gezeigt:
| bekannte Substitutionsreaktion: | ||||||||
| C6H6 | + Br2 | FeBr3 → |
C6H5Br | + HBr | ||||
In dieser Hinsicht, verhielt sich Benzol viel mehr wie ein gesättigter Kohlenwasserstoff (nur Einfachbindungen zwischen Kohlenstoffatomen).
Die erste Struktur, die Kekulé 1865 für Benzol vorschlug, enthielt keine Doppelbindungen, sondern ordnete die 6 Kohlenstoffatome wie unten gezeigt in einem Ring an:
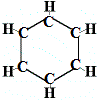
Kekulé erkannte, dass dieses Molekül die Tetravalenzregel für Kohlenstoff bricht, d.h. jedes Kohlenstoffatom bildet nur 3 statt 4 Bindungen.
Daher schlug Kekulé 1872 eine Benzolstruktur vor, die aus drei abwechselnden Einfach- und Doppelbindungen besteht, wie unten dargestellt:
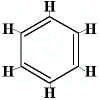
Bitte beachten Sie, dass die Kohlenstoffatome zwar nicht in der Struktur angegeben sind, dass aber immer davon ausgegangen wird, dass an der Stelle, an der zwei Linien des Sechsecks zusammentreffen, ein Kohlenstoffatom vorhanden ist, so dass es 6 „Verbindungen“, 6 Winkel und somit 6 Kohlenstoffatome gibt.
In dieser Struktur ist jedes Kohlenstoffatom an ein Wasserstoffatom und an zwei andere Kohlenstoffatome gebunden. Eine der Kohlenstoff-Kohlenstoff-Bindungen ist eine Einfachbindung, die andere Kohlenstoff-Kohlenstoff-Bindung ist eine Doppelbindung. Jedes Kohlenstoffatom hat 4 Bindungen gebildet.
Diese Struktur erklärt zwar nicht, warum Benzol keine Additionsreaktionen eingeht, aber sie könnte erklären, warum Benzol nur ein Strukturisomer bildet, wenn Benzol mit Brom in einer Substitutionsreaktion wie unten gezeigt reagiert:
 vorgeschlagene Benzolstruktur |
+ Br2 | → | 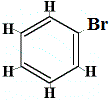 nur 1 Strukturisomer |
+ HBr |
Die anderen vorgeschlagenen Ringstrukturen für Benzol hätten mehr als ein strukturelles Isomer für das Produkt der Substitutionsreaktion vorhergesagt, wie unten gezeigt:
| andere vorgeschlagene Ringstrukturreaktion: | 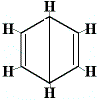 |
Br2 → |
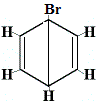 Strukturisomer 1 |
+ | 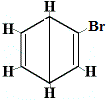 Strukturisomer 2 |
Was würde passieren, wenn ein weiteres Wasserstoffatom durch ein Bromatom ersetzt (substituiert) wird?
| C6H5Br | + Br2 | FeBr3 → |
C6H4Br2 | + HBr |
Wie viele Strukturisomere von C6H4Br2 würden sich ergeben?
 |
Br2 → FeBr3 |
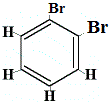 Strukturisomer 1 |
+ | 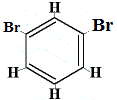 Strukturisomer 2 |
+ | 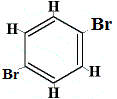 Strukturisomer 3 |
+ | 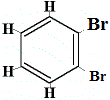 Strukturisomer 4 |
Die Strukturisomere 1 und 4 unterscheiden sich voneinander, da bei Isomer 1 die beiden Br-Atome an Kohlenstoffatome über eine C-C-Bindung gebunden sind, während im Isomer 4 die beiden Br-Atome über eine C=C-Bindung an die Kohlenstoffatome gebunden sind.
Wenn jedoch das aus Benzol hergestellte C6H5Br mit Brom in einer Substitutionsreaktion reagiert, entstehen nur 3 Strukturisomere von C6H4Br2!
Um dieses Problem zu lösen, schlug Kekulé vor, dass sich der Benzolring in einem schnellen Gleichgewicht zwischen Strukturen befindet, in denen sich die Doppelbindungen in den alternativen Positionen befinden, wie unten dargestellt:
 |
⇋ |  |
Wenn also Brom mit C6H5Br in einer Substitutionsreaktion zu C6H4Br2 reagiert, befinden sich Paare von Strukturisomeren von C6H4Br2 im Gleichgewicht miteinander.
Das bedeutet, dass die oben gezeigten Strukturisomere 1 und 4, die sich nur darin unterscheiden, dass die Br-Atome über eine Einfach- oder eine Doppelbindung gebunden sind, nun wie unten gezeigt in einem schnellen Gleichgewicht zueinander stehen:
| Br-Atome an benachbarten C-Atomen, Strukturisomer 1 hat Br-Atome über C-C Strukturisomer 4 hat Br-Atome über C=C |
 Strukturisomer 1 |
⇋ |  Strukturisomer 4 |
Nach Kekulé, befinden sich diese beiden Strukturisomere von C6H4Br2 in einem so schnellen Gleichgewicht, dass sie nicht als zwei getrennte Moleküle getrennt werden können, so dass es anscheinend nur 3 statt 4 Isomere gibt.
Diese schnelle Gleichgewichtsstruktur für Benzol, die so genannte Kekulé-Struktur, hat sich zwar als nützlich erwiesen, erklärt aber nicht die einzigartige Stabilität (fehlende Reaktivität) des Benzolrings und auch nicht, warum Benzol nicht ohne weiteres Additionsreaktionen eingeht, aber zu Additionsreaktionen angeregt werden kann.
Verstehst du das?
Mach mit bei AUS-e-TUTE!
Jetzt den Test machen!