Was ist Kobalt
Kobalt (Aussprache: KO-bolt) ist ein hartes, glänzendes silbrig-blaues Element, das zur Gruppe der Übergangsmetalle gehört und durch das chemische Symbol Co dargestellt wird. Es ist chemisch aktiv und kann zahlreiche Verbindungen bilden. Es ist ein ferromagnetisches Metall, das magnetisiert werden kann und mit Nickel und Aluminium legiert wird, um starke Magnete herzustellen.

Kobalt Symbol
Isotope
Es hat ein stabiles, natürlich vorkommendes Isotop, 59Co und 28 Radioisotope, von denen die stabilsten 60Co, 57Co, 56Co und 58Co sind, mit Halbwertszeiten von 5,2714 Jahren, 271,8 Tagen, 77,27 Tagen bzw. 70,86 Tagen. Die Halbwertszeiten der anderen Radioisotope betragen weniger als 18 Stunden.
Wo findet man Kobalt
Kobalt kommt natürlich in Kombination mit anderen Elementen in Mineralerzen wie Kobaltit (ein Sulfid, das Kobalt, Arsen, Eisen und Nickel enthält), Erythrit (hydratisiertes Kobaltarsenat) und Skutterudit (Kobaltarsenat) vor. Es wird im Allgemeinen als Nebenprodukt des Kupfer- und Nickelbergbaus gewonnen.
Die Manganknollen, die auf dem Meeresboden gefunden werden, sind riesige Reserven an Übergangsmetallen, die Tonnen von Kobalt enthalten. Die 3 größten Kobaltreserven haltenden Länder sind die Demokratische Republik Kongo (DRC), Australien und Kuba, während die 3 größten Produzenten die DRC, China und Sambia sind.

Kobalt
Geschichte
Herkunft des Namens: Der Name leitet sich von „kobald“, deutsch für „Kobold“, und von „cobalos“, einem griechischen Wort, das „Mine“ bedeutet, ab.
Wer hat es entdeckt: Das Element wurde von dem schwedischen Chemiker und Mineralogen Georg Brandt entdeckt.
Wann und wie wurde es entdeckt
Im Grab von Tutanchamun, dem altägyptischen Pharao, der von 1361-1352 v. Chr. regierte, befand sich ein tiefblaues Glasobjekt, das aus Kobalt hergestellt war. In China wurde Kobaltblau zur Herstellung von Töpferglasuren verwendet.
Abgesehen von seinen antiken Ursprüngen geht seine Entdeckung in der jüngeren Vergangenheit auf die 1730er Jahre zurück, als Georg Brandt sich für ein blaues Erz aus einigen der örtlichen Minen interessierte. Schließlich gelang es ihm, nachzuweisen, dass das blaue Erz ein neues Metall enthielt. Er beschrieb seine Eigenschaften und veröffentlichte die Ergebnisse 1739.
Seine Entdeckung war umstritten, da andere Chemiker seine Ergebnisse jahrelang bestritten. Sein schwedischer Chemiker-Kollege Torbern Bergman führte jedoch weitere Studien durch und bestätigte Georg Brandts Entdeckung im Jahr 1780 .
Kobalt Identifikation |
|||
| Atomzahl | 27 | ||
| CAS-Nummer | 7440-48-4 | ||
| Position im Periodensystem | Gruppe | Periode | Block |
| 9 | 4 | d | |
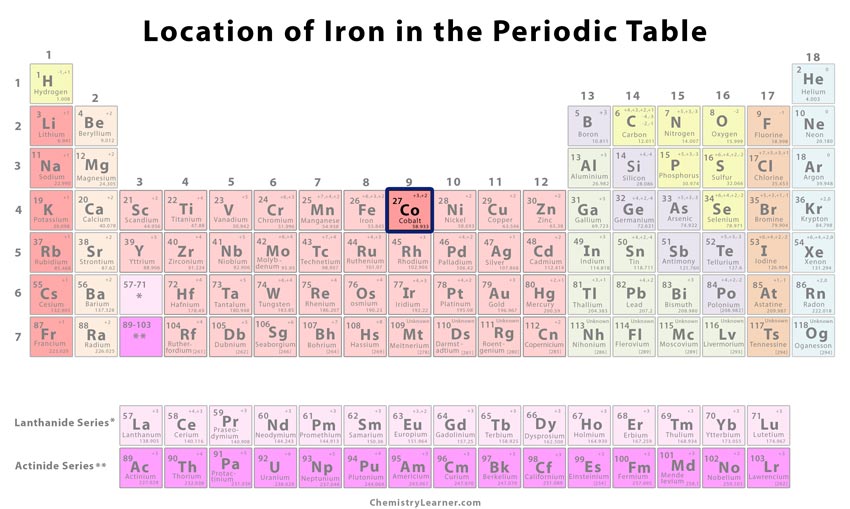
Wo befindet sich Kobalt im Periodensystem
Eigenschaften und Merkmale von Kobalt
Allgemeine Eigenschaften |
||||||||||||||||
| Relative Atommasse | 58.933 | |||||||||||||||
| Atommasse | 58.933 amu | |||||||||||||||
| Molare Masse | 58.9331950 ± 0.0000050 g/mol | |||||||||||||||
| Molekulargewicht | 58.933 g/mol | |||||||||||||||
Physikalische Eigenschaften |
||||||||||||||||
| Farbe | Silberblau, bläulich-weiß | |||||||||||||||
| Schmelzpunkt/Gefrierpunkt | 1495 °C, 2723 °F | |||||||||||||||
| Siedepunkt | 2927 °C, 5301 °F | |||||||||||||||
| Dichte | 8.86 g cm-3 | |||||||||||||||
| Zustand der Materie bei Raumtemperatur (fest/flüssig/gasförmig) | Fest | |||||||||||||||
| Härte | ||||||||||||||||
| – Brinell | 700 MPa | |||||||||||||||
| – Mohs | 5 | |||||||||||||||
| – Vickers | 1043 MPa | |||||||||||||||
| Elektrische Leitfähigkeit | 1.7 X 107 S/m | |||||||||||||||
| Ionenladung | 3+ | |||||||||||||||
| Wärmeleitfähigkeit | 100 W/(m K) | |||||||||||||||
| Spezifische Wärme | 421 J kg-1 K-1 | |||||||||||||||
| Blockmodul | Unbekannt | |||||||||||||||
| Schermodul | Unbekannt | |||||||||||||||
| Jungscher Modul | Unbekannt | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| – Temperatur (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||
| – Druck (Pa) | – | – | – | 2.09 X 10-10 | 1.00 X 10-6 | 4.19 X 10-4 | 0.0379 | 1.15 | 16 | – | – | |||||
Chemische Eigenschaften |
||||||||||||||||
| Oxidationsstufen | 3, 2, 0, -1 | |||||||||||||||
| Isotope | Isotop | Masse | Häufigkeit (%) | Halbwertszeit | Zerfallsart | |||||||||||
| 59Co | 58.933 | 100 | – | – | ||||||||||||
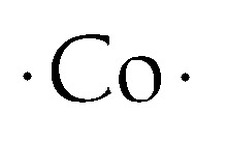
Kobalt-Lewis-Punkt-Struktur
Atomische Daten von Kobalt (Element 27)
| Valenz-Elektronen | 9 | |||||||
| Quantenzahlen | ||||||||
| – n | 3 | |||||||
| – ℓ | 2 | |||||||
| – mℓ | -1 | |||||||
| – ms | -1/2 | |||||||
| Elektronenkonfiguration (Edelgaskonfiguration) | 3d74s2 | |||||||
| Atomstruktur | ||||||||
| – Anzahl der Elektronen | 27 | |||||||
| – Anzahl der Neutronen | 32 | |||||||
| – Anzahl der Protonen | 27 | |||||||
| Radius des Atoms | ||||||||
| – Atomradius | 2.00 Å | |||||||
| – Kovalenter Radius | 1,18 Å | |||||||
| Elektronengativität (Pauling-Skala) | 1,88 | |||||||
| Elektronenaffinität | 63.873 kJ mol-1 | |||||||
| Ionisierungsenergie (kJ mol-1) | 1te | 2te | 3te | 4te | 5te | 6te | 7te | 8te |
| 760.402 | 1648.356 | 3232.3 | 4949.7 | 7670.6 | 9842 | 12437 | 15225.4 | |
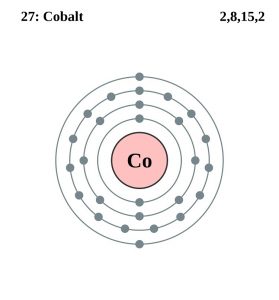
Kobalt-Elektronenkonfiguration (Bohr-Modell)
Wofür wird Kobalt verwendet
- Kobalt wird wegen seiner Hochtemperaturfestigkeit und Korrosionsbeständigkeit für den Einsatz in Gasturbinengeneratoren und Strahlturbinen legiert.
- Kobalt wird gelegentlich wegen seiner Härte und seines attraktiven Aussehens in der Galvanotechnik verwendet.
- Es wird häufig als Kathodenmaterial in Lithium-Ionen-Batterien verwendet.
- Kobaltsalze werden verwendet, um Glas, Porzellan, Töpferwaren, Emaille und Farbe intensive blaue Farben zu verleihen.
- Radioaktives 60Co wird zur Behandlung von Krebs und in der Lebensmittelbestrahlung zur Bekämpfung von Krankheitserregern und zur Verlängerung der Haltbarkeit verwendet.
- Stellit-Superlegierungen, die aus Chrom, Kobalt und Wolfram bestehen, werden zur Herstellung von hochtemperatur- und verschleißfesten Schneidwerkzeugen verwendet.
Kobalttoxizität und gesundheitliche Auswirkungen
Kobaltvergiftungen können auftreten, wenn man es versehentlich einnimmt, einatmet oder in großen Mengen mit der Haut in Berührung kommt. In großen Mengen kann Kobalt bei Menschen und einigen Tieren krebserregend sein.
Es kommt in Spuren beim Menschen vor und ist ein wesentlicher Bestandteil von Vitamin B12. Kleine Dosen von Kobalt werden auch einigen Tieren verabreicht, um Mineralmangel bei ihnen zu verhindern.

Mineral Kobalt (Kobaltit)
Interessante Fakten
- Kobalt wird grafisch durch einen „Kobold“ oder Kobold (der von den mittelalterlichen deutschen Bergleuten als lästig angesehen wurde) mit chinesischem Porzellan im Hintergrund dargestellt, was auf seine Verwendung als Töpferglasur im alten China hinweist.
- Cobalt kann seine magnetischen Eigenschaften bis zu einer Temperatur (Curie-Punkt) von 1.121 °C (2049.8 °F) beibehalten, dem höchsten aller ferromagnetischen Elemente .
- Im Jahr 2010 verwendeten deutsche Wissenschaftler ein Kobaltatom, um die ersten Bilder von Spin-Änderungen einzufangen .
Preis von Kobalt
Die Kosten für reines Kobalt liegen bei etwa $0,21 pro Gramm, und in loser Form kostet es etwa $0.044 pro Gramm.
- http://www.rsc.org/periodic-table/element/27/cobalt
- https://education.jlab.org/itselemental/ele027.html
- https://www.livescience.com/29275-cobalt.html
- https://www.chemicool.com/elements/cobalt.html
- https://education.jlab.org/itselemental/iso027.html
- https://www.webqc.org/molecular-weight-of-Co%28cobalt%29.html
- https://pubchem.ncbi.nlm.nih.gov/compound/cobalt#section=Top
- http://periodictable.com/Elements/027/data.html
- http://www.gpb.org/files/pdfs/gpbclassroom/chemistry/ionicChargesChart.pdf
- http://dwb4.unl.edu/Chem/CHEM869B/CHEM869BLinks/learn.chem.vt.edu/tutorials/bonding/valence.html
- http://chemistry-reference.com/q_elements.asp?Symbol=Co&language=en
- https://medlineplus.gov/ency/article/002495.htm