Jedes Elektron in einem Atom kann durch eine Reihe von vier Quantenzahlen eindeutig identifiziert werden.

Obwohl ihre Entdeckung fortgeschrittene Mathematik erforderte, sind sie alle konventionelle Zahlen: drei von ihnen können nur einfache ganzzahlige Werte annehmen; die vierte ist ein einfacher Bruch.
Die ersten drei Quantenzahlen ergeben sich aus der Wellenfunktion Ψ, die man durch Lösung der Schrödinger-Gleichung erhält.
Die vierte Quantenzahl, der Elektronenspin, ergibt sich aus der Entdeckung, dass Elektronen zwei mögliche Ausrichtungen haben.
Die Zahlen und ihre Definitionen lauten wie folgt:
Die Quantenzahlen
| Quantenzahl | Name | Mögliche Werte | Information |
|---|---|---|---|
| n | Hauptquantenzahl | 1, 2, 3,…, n | Definiert die vom Elektron besetzte Energieschale. Schalen, die dem Kern am nächsten sind, haben den niedrigsten Wert von n und die niedrigste potentielle Energie. n ist die erste Zahl, die in Elektronenkonfigurationen wie der von Magnesium geschrieben wird: 1s2 2s2 2p6 3s2 |
| l | Orbitaldrehimpulsquantenzahl (auch azimutale Quantenzahl genannt) |
0, 1, 2,…, (n-1) | Definiert die Energieunterschale – in Systemen mit mehr als einem Elektron haben die Unterschalen unterschiedliche Energien. l definiert den Buchstaben der Unterschale in Elektronenkonfigurationen. Zum Beispiel: 1s2 2s2 2p6 3s2 l = 0 ergibt eine s-Unterschale. l = 1 ergibt eine p-Unterschale. l = 2 ergibt eine d-Unterschale, usw. |
| ml | magnetische Quantenzahl | -l, (l+1), …, 0,… , (l+1), l | Definiert die Ausrichtung des Unterschalenorbitals. Die p-Unterschale, mit l = 1, hat drei ml-Werte: -1, 0, 1. Diese zeigen an, dass es drei p-Orbitale gibt, d.h. die Orbitale px, py und pz. Die d-Unterschale mit l = 2 hat fünf ml-Werte: -2, -1, 0, 1, 2.Diese zeigen an, dass fünf d-Orbitale existieren. |
| ms | Elektronenspinquantenzahl | -½ oder +½ | Elektronen haben zwei mögliche Spinausrichtungen. |
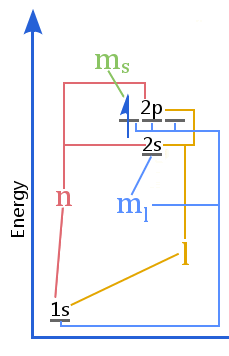
Das Energieniveaudiagramm zeigt die Beziehung zwischen Quantenzahlen und den Schalen, Unterschalen, Orbitalen und dem Elektronenspin in einem Atom.
Kein Elektron in einem Atom hat alle vier Quantenzahlen gemeinsam.Jedes Elektron kann eindeutig durch seine Quantenzahl identifiziert werden – siehe Pauli-Ausschlussprinzip.
Die Formen der Orbitale sind nicht durch die Quantenzahlen gegeben, sondern sind Wahrscheinlichkeitsdichten – dreidimensionale Karten des Raums um den Kern, in dem ein Elektron in 99 Prozent der Fälle zu finden ist.Die Form der Orbitale ergibt sich aus dem Quadrat der Wellenfunktion Ψ2. Der genaue Ort und Impuls eines Elektrons kann niemals bekannt sein – siehe Heisenbergsche Unschärferelation.
