Einführung
Meningeome sind die häufigste primäre Neubildung des Zentralnervensystems (ZNS) und machen über 37 % aller primären Hirntumoren aus (1). Die Behandlungsmöglichkeiten für Meningeome umfassen Beobachtung, Operation und Strahlentherapie (2, 3). Während eine Minderheit der Meningeome aggressiv ist, einschließlich der WHO-Grade II und III, sind über 80 % der Meningeome WHO-Grad I und werden oft als „gutartig“ bezeichnet (4). Doch selbst Meningeome vom WHO-Grad I können wiederkehren, wobei frühere Studien eine Rezidivrate von bis zu 47 % bei langfristiger Nachbeobachtung ergaben (4, 5). Ein Meningiomrezidiv macht häufig eine zusätzliche Operation oder eine zusätzliche Strahlentherapie erforderlich, was zu einer möglichen Morbidität führt (6, 7). Daher ist die Fähigkeit zur Vorhersage eines Rezidivs ein entscheidender Bestandteil der Behandlung von Meningeomen des WHO-Grads I, um Empfehlungen für die Häufigkeit von Überwachungsbildern oder den Einsatz einer adjuvanten Strahlentherapie geben zu können.
Neben dem bei der Resektion erreichten Simpson-Grad wurde eine Reihe von Tumormerkmalen als mögliche Prädiktoren für ein Rezidiv untersucht, wobei der Schwerpunkt auf histopathologischen Befunden lag (8). Dazu gehören der MIB-1-Index (ein Marker für die Zellproliferation), die Hirninvasion und das Vorhandensein atypischer histologischer Merkmale, einschließlich erhöhter Zellularität, Sheeting, Foci spontaner Nekrosen und Kernatypien (9-13). Die WHO-Klassifikation von 2016 verwendet ausschließlich pathologische Befunde zur Bestimmung des Tumorgrades, wobei Grad II durch eine Hirninvasion und eine erhöhte Mitose über 4/10 high powered field (HPF) definiert ist (4). Darüber hinaus führen drei atypische Merkmale zusammen zu einem höheren Tumorgrad (4). Kürzlich wurden molekulare Merkmale von Meningiomen mit dem Rezidivrisiko in Verbindung gebracht, die in Zukunft wahrscheinlich bei der Einstufung von Meningiomen verwendet werden (14-16).
Während die WHO-Klassifikationen die verfügbare Literatur zusammenfassen, um klare Abgrenzungen zwischen den Tumorgraden zu schaffen, bleibt die Literatur über das Wiederauftreten von Meningiomen des WHO-Grades I uneinheitlich. Während beispielsweise die Hirninvasion allein zu einer Erhöhung des Tumorgrades von WHO-Grad I-II führen kann, wurde in einer Reihe von Folgestudien kein Zusammenhang zwischen Hirninvasion und Rezidiv festgestellt, was die Notwendigkeit weiterer Untersuchungen zu den Prädiktoren des Rezidivs unterstreicht (10, 17, 18). Der Nutzen des MIB-1-Index bei der Vorhersage des Wiederauftretens von Meningeomen ist ebenfalls umstritten; eine Studie mit Meningeomen des WHO-Grades I deutete nur auf ein höheres Wiederauftretensrisiko bei einem MIB-1-Index von >3% hin, während andere Studien, die alle WHO-Grade einschlossen, eine höhere Wiederauftretensrate bei >5% oder >10% nachwiesen (9-11). Frühere Studien haben auch einen MIB-1-Cutoff von >3% nur bei Patienten mit einer Simpson II- oder III-Resektion vorgeschlagen, was die Vielfalt der MIB-1-Cutoffs und ihrer Verwendung weiter verdeutlicht (13). Im Vergleich dazu wurde in einer begrenzten Anzahl von Studien der Einfluss atypischer Merkmale auf das Wiederauftreten von Meningeomen des WHO-Grads I untersucht, obwohl sie auf ein höheres Wiederauftretensrisiko bei WHO-Grad I-Tumoren hinwiesen, die bei der pathologischen Analyse atypische Merkmale aufwiesen (9).
Das Ziel dieser Studie war es daher, klinische, radiologische und pathologische Prädiktoren für das Wiederauftreten von WHO-Grad I-Meningeomen zu untersuchen. In Anbetracht des fehlenden Konsenses über die Verwendung des MIB-1-Indexes bei Meningeomen des WHO-Grades I verwenden wir auch eine rekursive Partitionierungsanalyse, um einen klinisch relevanten Grenzwert für den MIB-1-Index zu ermitteln. Anschließend identifizieren wir Prädiktoren für ein frühes und postmediales Rezidiv bei WHO-Grad-I-Tumoren.
Methoden
Patientenpopulation
Patienten, die von 2007 bis 2017 wegen eines WHO-Grad-I-Meningeoms behandelt wurden, wurden retrospektiv anhand einer institutionellen Datenbank identifiziert. Diese Studie wurde vom Institutional Review Board der University of California, San Francisco, formell genehmigt (IRB#13-12587). Patienten ohne MIB-1-Indexwerte, die in der elektronischen Patientenakte verfügbar waren, wurden ausgeschlossen. Zu Beginn des Studienzeitraums wurde der MIB-1-Index nach dem Ermessen des behandelnden Neuropathologen bestimmt, doch im weiteren Verlauf wurde der MIB-1-Index bei allen Patienten mit WHO-Meningeom Grad I bestimmt.
Klinische Daten
Demografische, klinische und Behandlungsmerkmale, histopathologische Daten und klinische Ergebnisse der Patienten wurden retrospektiv überprüft und erfasst. Zu den erfassten klinischen Daten gehörten Alter, Geschlecht, Karnofsky-Leistungsstatus (KPS) zum Zeitpunkt der Behandlung, klinische Präsentation und Vorgeschichte der Meningeom-Behandlung. Zu den histopathologischen Daten gehörten der MIB-1-Index, Schichtung/Verlust der Architektur, erhöhte Zellularität, Nekrose, Kernatypie und das Vorhandensein einer Knocheninvasion. Die Ergebnisse der Färbung von Progesteronrezeptor (PR), Epithelialmembranantigen (EMA), CD34, S100 und glialem fibrillärem und saurem Protein (GFAP) wurden, sofern verfügbar, erfasst. Die pathologischen Daten wurden dem pathologischen Bericht entnommen, der zum Zeitpunkt des chirurgischen Eingriffs erstellt wurde. Die Lage und Größe des Tumors sowie das Vorhandensein eines präoperativen peritumoralen Ödems wurden mit Hilfe der präoperativen MRT-Bildgebung bestimmt. Erfasst wurden der anterior-posteriore (AP), superior-inferiore (SI) und transversale (TV) Durchmesser. Das präoperative Tumorvolumen wurde anhand der Gleichung für nicht kugelförmiges Tumorvolumen berechnet. Die Art der Behandlung wurde ebenfalls erfasst. Der Simpson-Grad wurde anhand des Operationsberichts bestimmt. Bruttototal- (GTR) und Subtotalresektion (STR) wurden anhand von postoperativen Magnetresonanztomographie-Scans (MRT) bestimmt.
Die primären Endpunkte von Interesse waren Tumorrezidive und die Zeit bis zum Rezidiv. Ein Rezidiv wurde anhand der postoperativen Röntgenaufnahmen als lokales Wiederauftreten oder Fortschreiten des Resttumors bestimmt. Die Zeit bis zum Wiederauftreten des Tumors wurde ab dem Datum der Behandlung des Patienten bestimmt. Die Dauer der Nachbeobachtung wurde ab dem Datum der Behandlung bis zum letzten Besuch in der neurochirurgischen Klinik berechnet. Zu den sekundären Endpunkten gehörten das frühe und das postmediane Rezidiv. Ein frühes Wiederauftreten wurde definiert als innerhalb von 2 Jahren nach der Erstbehandlung (19). Ein postmediales Wiederauftreten wurde als >2 Jahre nach der Erstbehandlung definiert.
Statistische Analyse
Chi-square und Student’s t-test wurden für den Vergleich von kategorischen bzw. kontinuierlichen Variablen verwendet. Ein multivariates Backward-Likelihood-Cox-Regressionsmodell wurde unter Verwendung von Variablen mit p < 0,200 bei der univariaten Analyse erstellt. In ähnlicher Weise wurden multivariate binäre logistische Backward-Likelihood-Modelle zur Vorhersage des frühen und postmedianen Wiederauftretens unter Verwendung von Variablen mit p < 0,200 in der univariaten Analyse konstruiert. Die rekursive Partitionierungsanalyse (RPA) wurde zur weiteren Identifizierung der Hauptrisikofaktoren für ein allgemeines, frühes und postmedianes Meningeomrezidiv verwendet. Ein p < 0,050 wurde als Schwellenwert für die statistische Signifikanz verwendet. Alle statistischen Analysen wurden mit SPSS 26 durchgeführt.
Ergebnisse
Gesamtdemografie der Patienten und klinische Ergebnisse
Die Gesamtdemografie der Patienten, die histopathologischen Merkmale und die klinischen Ergebnisse sind in Tabelle 1 dargestellt. Insgesamt wurden 239 Patienten mit WHO Grad I Meningeomen in die Studie aufgenommen. Das Durchschnittsalter betrug 60,0 Jahre, und 69,5 % der Patienten waren weiblich. Das häufigste Symptom waren Kopfschmerzen (30,5 %), gefolgt von einem fokalen neurologischen Defizit (27,6 %). Die Mehrzahl der Patienten wurde allein operiert (98,3 %), wobei jeweils 2 Patienten eine adjuvante Strahlentherapie (0,8 %) oder eine Gamma Knife-Behandlung (0,8 %) erhielten. Bei 38,1 % der Patienten war auf den präoperativen MRT-Aufnahmen ein peritumorales Ödem zu erkennen. Das durchschnittliche berechnete Tumorvolumen betrug 30,6 cm3 (Spanne = 0,23-215,73 cm3), und die durchschnittliche Größe des größten Tumors betrug 3,8 cm (Spanne = 0,6-11,3 cm). Insgesamt befanden sich 91 (38,1 %) Tumore an der Schädelbasis, 57 (23,8 %) waren konvexe Tumore, 43 (18,0 %) hatten eine Falx/Parasagittallage und 55 (23,0 %) hatten eine andere Lage. Die meisten Patienten erhielten eine totale Bruttoresektion (63,6 %). Die Inzidenz der Simpson-I-, -II-, -III- und -IV-Resektion betrug 31,4, 29,7, 2,5 bzw. 35,6 %. Atypische Merkmale traten bei einer Reihe von Patienten auf; die häufigsten atypischen Merkmale waren Knocheninvasion (18,0 %) und Schichtung/Verlust der Architektur (8,4 %). Die durchschnittliche Nachbeobachtungszeit betrug 41,1 Monate (Bereich: 0-147 Monate).
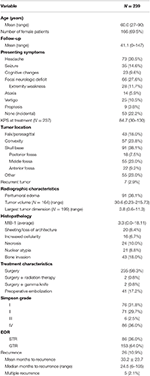
Tabelle 1. Patientencharakteristika, histopathologische Merkmale, Röntgenbilder und Ergebnisse.
Prädiktoren für das Wiederauftreten eines Meningeoms vom WHO-Grad I
Bei insgesamt 26 Patienten trat ein Rezidiv auf, wobei die mediane Zeit bis zum Wiederauftreten 24,5 Monate betrug (Tabelle 1). Ein Vergleich zwischen Patienten mit einem Rezidiv und solchen ohne Rezidiv ist in Tabelle 2 zu finden. Es gab keinen Unterschied im Alter (60,2 vs. 58,8, p = 0,582) oder im weiblichen Geschlecht (61,5 vs. 70,4%, p = 0,353) zwischen Patienten mit rezidivierenden und nicht rezidivierenden Tumoren. Die Behandlungsmerkmale waren zwischen den Gruppen ähnlich, wobei die meisten Patienten in jeder Gruppe nur operiert wurden (100,0 vs. 98,1 %, p = 1,000). Bei Patienten mit rezidivierenden Tumoren war jedoch die Inzidenz von STR höher (61,5 vs. 32,7 %, p = 0,004) und die Inzidenz von Simpson Grad I Resektionen niedriger (11,5 vs. 34,1 %, p = 0,019). Das Auftreten eines peritumoralen Ödems, die Tumorgröße und das Tumorvolumen waren in beiden Gruppen ähnlich. Bei der histopathologischen Analyse zeigte sich bei den Patienten mit Rezidiv eine Tendenz zu einer erhöhten Kernatypie (19,2 vs. 7,5 %, p = 0,061). Patienten mit einem Rezidiv hatten auch eine höhere durchschnittliche Nachbeobachtungszeit (68,9 vs. 37,7 Monate, p = 0,001).
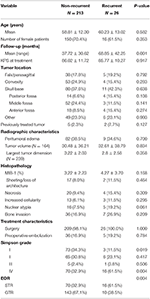
Table 2. Vergleich von Patienten mit rezidivierenden Meningeomen gegenüber nicht rezidivierenden Meningeomen.
Eine anschließende Backward-Likelihood-Cox-Regressionsanalyse zeigte einen unabhängigen Zusammenhang zwischen Rezidiv und Tumorlokalisation in der hinteren Fossa (HR = 5.25, CI 1,71-16,17, p = 0,004), MIB-1-Index (HR = 1,18, CI 1,05-1,34, p = 0,008), Kernatypie (HR = 5,24, CI 1,73-15,92, p = 0,003) und STR (HR = 5,66, CI 1,30-13,92, p < 0,001; Tabelle 3). Kaplan-Meier-Kurven, die das rezidivfreie Überleben für die Lage der hinteren Fossa (p = 0,007), Kernatypie (p = 0,137), Ausmaß der Resektion (p = 0,001) und MIB-1 >4,5% (p = 0,001) hervorheben, sind in den Abbildungen 1A-D dargestellt.
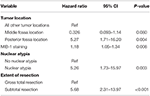
Tabelle 3. Cox-Regressionsanalyse für das Wiederauftreten.

Abbildung 1. Kaplan-Meier-Kurven der Risikofaktoren für das Wiederauftreten von Meningeomen des WHO-Grades I. (A) Kernatypie (blaue Linie) vs. keine Kernatypie (rote Linie) (X2 = 2,21, p = 0,137). (B) Lokalisation des Tumors in der posterioren Fossa (blaue Linie) im Vergleich zu anderen Lokalisationen (rote Linie) (X2 = 10,36, p = 0,001). (C) MIB-1-Index >4,5% (blaue Linie) vs. ≤4,5% (rote Linie) (X2 = 6,17, p = 0,013). (D) STR (blaue Linie) vs. GTR (rote Linie) (X2 = 10,46, p = 0,001).
Prädiktoren für ein frühes vs. postmedianes WHO-Grad-I-Meningeom-Rezidiv
Ein Vergleich zwischen nicht rezidivierten Patienten und Patienten mit Tumoren, die früh oder postmedian rezidivierten, ist in Tabelle 4 dargestellt. Bei Patienten mit einem frühen Rezidiv wurde häufiger eine subtotale Resektion durchgeführt (76,9 vs. 32,7 %, p = 0,001). Sie wiesen auch tendenziell eine höhere Inzidenz von Kernatypien (23,1 vs. 7,5 %, p = 0,084) in der Histopathologie auf (Tabelle 4). Patienten mit einem postmedialen Rezidiv wiesen tendenziell eine höhere Inzidenz der Tumorlokalisation in der hinteren Fossa (23,1 vs. 6,6 %, p = 0,063) und eine höhere Inzidenz der Knocheninvasion (38,5 vs. 16,9 %, p = 0,064) sowie einen höheren MIB-1-Index (5,55 vs. 3,22 %, p = 0,098) auf. Es gab keinen signifikanten Unterschied zwischen dem Simpson-Grading oder den GTR-Raten bei Patienten mit postmedianem Rezidiv im Vergleich zu Patienten ohne Rezidiv (Tabelle 4).
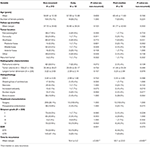
Table 4. Frühes vs. postmediales Rezidiv.
Zwei multivariate binäre logistische Modelle mit umgekehrter Wahrscheinlichkeit wurden verwendet, um Prädiktoren für ein frühes vs. postmediales Rezidiv zu identifizieren (Tabelle 5). Zu den unabhängigen Prädiktoren für ein frühes Tumorrezidiv gehörten Kernatypien in der Histopathologie (OR = 6,45, CI 1,34-31,07, p = 0,020) und STR (OR = 8,92, CI 2,18-36,46, p = 0,002). Der einzige unabhängige Prädiktor für ein postmediales Rezidiv war der MIB-1-Index (OR = 1,24, KI 1,05-1,45, p = 0,010), obwohl die Lage der hinteren Fossa sich der Signifikanz näherte (OR = 4,42, KI 0,954-20,49, p = 0,058; Tabelle 5).

Tabelle 5. Binäres logistisches Modell für postmediane und frühe Tumorrezidive.
Recursive Partitioning Analysis of Recurrence
RPA wurde durchgeführt, um die wichtigsten Risikofaktoren für ein Meningeomrezidiv zu identifizieren (Abbildung 2). In Übereinstimmung mit der Cox-Regressionsanalyse war STR die erste Partition bei der Vorhersage des Gesamtrezidivs: Bei 18,6 % der Patienten mit einer STR-Resektion trat ein Rezidiv auf, verglichen mit 6,5 % bei einer GTR-Resektion. Der nächste Entscheidungsknoten innerhalb der GTR-Patienten betraf einen MIB-1-Cutoff von 4,5 %, da 18,8 % der Patienten mit einem MIB-1 >4,5 % rezidivierten gegenüber 3,3 % der Patienten mit einem MIB-1 ≤4,5 % (Abbildung 2A). Im Hinblick auf das postmediane Rezidiv identifizierte die RPA den ersten Entscheidungsknoten als MIB-1-Grenzwert von 5,83 %: 22,2 % der Patienten mit einem MIB-1 >5,83 % traten erneut auf, gegenüber 3,3 % der Patienten mit einem MIB-1 ≤5,83 %. Für den anschließenden Entscheidungsknoten wurde die Lage des Tumors in der hinteren Schädelgrube herangezogen: Bei 13,3 % der Patienten mit einem Tumor in der hinteren Schädelgrube trat ein Rezidiv auf, gegenüber 2,5 % bei anderen Tumorlokalisationen (Abbildung 2B). Bei der RPA für frühe Rezidive wurde das Ausmaß der Resektion als primärer Entscheidungsknoten identifiziert: Bei 11,6 % der Patienten mit STR kam es zu einem Rezidiv im Vergleich zu 2,0 % der GTR-Patienten. Als nächster Entscheidungsknoten wurde die Falx- oder Parasagittallage verwendet: 36,4 % der Falx- oder Parasagittaltumoren traten erneut auf, gegenüber 8,1 % der anderen Tumorlokalisationen (Abbildung 2C).
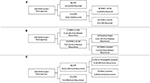
Abbildung 2. Rekursive Partitionierungsanalyse mit Hervorhebung der wichtigsten Risikofaktoren für (A) das Gesamtrezidiv, (B) das postmediane Rezidiv und (C) das frühe Rezidiv.
Diskussion
Schlüsselergebnisse
Das Wiederauftreten von Meningeomen des WHO-Grades I ist unabhängig voneinander mit dem MIB-1-Index, der Lage des Tumors in der hinteren Fossa, dem Vorhandensein von Kernatypien und STR verbunden. Genauer gesagt wurde ein MIB-1-Index von 4,5 % als klinisch relevanter Grenzwert für die Risikostratifizierung von WHO-Meningeom-Patienten nach GTR identifiziert. Patienten mit einem MIB-1-Index >4,5 % und GTR ihres WHO-Grad-I-Meningioms hatten ein ähnliches Rezidivrisiko wie Patienten mit einer STR. Weitere Analysen ergaben, dass der MIB-1-Index ein entscheidender Faktor ist, der mit einem Rezidiv nach dem mittleren Stadium assoziiert ist, während das Ausmaß der Resektion der Hauptfaktor für ein frühes Rezidiv war.
Prädiktoren für das Rezidiv eines Meningeoms vom WHO-Grad I
Vorangegangene Studien haben in ähnlicher Weise die Beziehung zwischen histopathologischen Merkmalen, klinischen Eigenschaften und dem Rezidiv bei allen WHO-Graden von Meningeomen untersucht. In einer Studie mit 901 Patienten (716 WHO-Grad I, 174 Grad II und 11 Grad III) untersuchten Gousias et al. zeigen ein höheres Rezidivrisiko bei Meningeomen mit einem MIB-1-Index von >10 %, höherem WHO-Grad, Tumorgröße >6 cm, petroklivaler oder kavernöser Lage und Multiplizität (11). Gousias et al. untersuchten jedoch nicht den Zusammenhang zwischen dem Vorhandensein atypischer Merkmale in der Histologie und dem Wiederauftreten des Tumors. Marciscano et al. nutzten eine Kohorte von 148 Patienten mit WHO-Meningeomen des Grades I mit vollständiger pathologischer Analyse, um Variablen zu identifizieren, die mit einem Wiederauftreten assoziiert sind, wobei der Schwerpunkt auf den Auswirkungen atypischer pathologischer Merkmale auf das Wiederauftretensrisiko lag (9). Interessanterweise identifizierten sie das Vorhandensein atypischer Merkmale als unabhängigen Risikofaktor zusätzlich zum MIB-1-Index >3% und der Simpson-Resektion. Unsere Studie hebt in ähnlicher Weise die chirurgische GTR und die Kernatypie, ein atypisches Merkmal, als unabhängige Prädiktoren für ein Rezidiv hervor (Tabelle 3), obwohl wir jedes atypische Merkmal unabhängig bewertet haben. In unserem Cox-Regressionsmodell berücksichtigen wir auch die Tumorlokalisation und identifizieren die Lokalisation des Tumors in der hinteren Fossa als unabhängigen Risikofaktor für ein Rezidiv. Während Marciscano et al. die Tumorlokalisation nicht in ihre Analyse der Prädiktoren für das Fortschreiten des Tumorwachstums einbezogen haben, zeigen Gousias et al. in ähnlicher Weise die petroklivale Tumorlokalisation als Risikofaktor für ein Rezidiv, allerdings unter Berücksichtigung aller WHO-Meningeomgrade (9, 11). Das höhere Rezidivrisiko in Verbindung mit der Lage in der hinteren Fossa könnte auf die erhöhte Prävalenz von NF2-Mutationen in der hinteren Fossa zurückzuführen sein (14, 15, 20), obwohl wir nicht in der Lage sind, dies vollständig zu erforschen, da wir in unserer Einrichtung keine routinemäßigen Gentests für Meningeome durchführen. Unabhängig davon sind weitere Studien mit größeren WHO-Grad I Meningeom-Patientenkohorten erforderlich, um diese Beziehung zu untersuchen.
MIB-1 Index und WHO-Grad I Meningeom-Rezidiv
Ähnlich wie in früheren Studien (9, 11, 13, 21) haben wir dann auch die Beziehung zwischen dem MIB-1 Index eines Tumors und seinem Rezidivrisiko untersucht. Zunächst werteten wir den MIB-1-Index in einem Cox-Regressionsmodell für das Gesamtrezidiv aus, wie zuvor beschrieben. In Übereinstimmung mit früheren Studien stellten wir fest, dass ein höherer MIB-1-Index unabhängig mit einem insgesamt erhöhten Rezidivrisiko verbunden war. In Anbetracht der Diskrepanzen bei den Grenzwerten für MIB-1 in der Literatur und der Variabilität zwischen den Laboren haben wir MIB-1 zunächst als kontinuierliche Variable bewertet. Als Nächstes versuchten wir, den Cutoff-Wert für den MIB-1-Index in unserer Patientenpopulation zu bestimmen, indem wir die RPA zur Modellierung des Gesamtrezidivs einsetzten, was einen MIB-1-Cutoff-Wert von 4,5 % bei Patienten mit GTR ergab (Abbildung 2A). Interessanterweise hatten diese Patienten ein ähnliches Rezidivrisiko wie Patienten mit einem STR, was die Nützlichkeit des MIB-1-Index bei Patienten nach GTR belegt. Perry et al. ermittelten in einer univariaten Analyse ebenfalls einen MIB-1-Index von 4,2 %, der mit einem Rezidiv nach einer GTR assoziiert ist, allerdings unter Berücksichtigung aller Meningeomgrade (22).
Die Rezidivrate von 18,8 % bei Patienten mit einer GTR und einem MIB-1-Wert von >4,5 % unterstreicht die Notwendigkeit einer engmaschigen Überwachung dieser Patienten oder sogar die Erwägung einer adjuvanten Strahlentherapie, je nach Präferenz des Patienten. Es hat sich gezeigt, dass eine adjuvante Strahlentherapie nach der Resektion eines Meningeoms vom WHO-Grad I das Wiederauftreten reduziert, insbesondere nach einer STR (23-25), obwohl die Beobachtung nach einer STR nach wie vor Standardpraxis ist (8). In einer Studie mit 92 WHO-Grad-I-Meningeomen wiesen Soyuer et al. ein progressionsfreies Überleben (PFS) von 91 % bei Patienten nach, die nach einer STR eine adjuvante Strahlentherapie erhielten, was signifikant höher war als das PFS von 38 % bei den Patienten, die keine adjuvante Strahlentherapie erhalten hatten (24). Da die Patienten in unserer Studie mit einem STR ein ähnliches Rezidivrisiko hatten wie die Patienten mit einem GTR und einem MIB-1 >4,5 %, könnte eine adjuvante Strahlentherapie für beide Gruppen sinnvoll sein. Es sind jedoch größere Studien erforderlich, um unseren MIB-1-Grenzwert und die damit verbundenen klinischen Auswirkungen weiter zu validieren. Prospektive Studien, die den Einsatz einer adjuvanten Strahlentherapie bei Meningeomen des WHO-Grads I untersuchen, sind ebenfalls erforderlich.
Prädiktoren für ein frühes und postmedianes Wiederauftreten von Meningeomen des WHO-Grads I
Angesichts des Trends zu einem späteren Wiederauftreten bei Patienten mit einem erhöhten MIB >4.5 % (Abbildung 1C), untersuchten wir anschließend die Unterschiede bei den Prädiktoren für ein frühes Rezidiv (definiert als innerhalb von 2 Jahren nach der Behandlung) oder ein postmedianes Rezidiv (Patienten mit einem Rezidiv >2 Jahre nach der Behandlung). Nur wenige Studien in der Literatur haben die Prädiktoren für ein frühes Rezidiv bei Meningeomen untersucht. In einer Studie von Budohoski et al. wurden in einer Kohorte von 220 atypischen Meningeomen die parafalcine Lage, die STR und das peritumorale Ödem in der Röntgenaufnahme als Prädiktoren für ein frühes Rezidiv ermittelt (26). In einer ähnlichen Studie von Maillo et al. wurden bei Meningeomen des WHO-Grades I die Interphasen-Fluoreszenz-in-situ-Hybridisierung (FISH) und pathologische Merkmale zur Identifizierung von Risikofaktoren für ein frühes Rezidiv (definiert als 2,5 Jahre nach der Behandlung) herangezogen, und es wurde festgestellt, dass eine größere Tumorgröße, Karyotyp-Anomalien, das Alter der Patienten und Anomalien von Chromosom 10 mit einem erhöhten Rezidivrisiko verbunden sind (19). Die Autoren berücksichtigten jedoch nicht das Vorhandensein von Atypien in der Pathologie oder den MIB-1-Index. Anhand einer Kohorte von Meningeom-Patienten des WHO-Grades I mit detaillierteren pathologischen und klinischen Daten identifizierten wir das Ausmaß der Resektion und die Kernatypie in der Pathologie als unabhängige Prädiktoren für ein frühes Rezidiv in der binären logistischen Regressionsmodellierung (Tabelle 5). Die RPA zeigte ebenfalls die Bedeutung des Ausmaßes der Resektion bei der Risikostratifizierung von Patienten für ein frühes Rezidiv (Abbildung 2C). Interessanterweise wurde auch ein erhöhtes Risiko in Verbindung mit der Falx/Parasagittallage des Tumors festgestellt, was mit den Ergebnissen von Budohoski et al. (26) übereinstimmt. Der einzige signifikante Prädiktor für das postmediane Tumorrezidiv bei der binären logistischen Regressionsmodellierung war der MIB-1-Index, obwohl die Lage des Tumors in der hinteren Fossa annähernd signifikant war. Dies zeigte sich auch bei der RPA (Abbildung 2B). Überraschenderweise war das Ausmaß der Resektion kein unabhängiger Prädiktor für ein postmedianes Rezidiv, da die Mehrzahl der postmedianen Rezidive mit einem GTR behandelt worden war. Postmediane Rezidive könnten auf eine Kategorie von Meningeomen des WHO-Grads I hinweisen, die aufgrund ihres erhöhten MIB-1-Index und ihrer Lage in der hinteren Fossa molekular aggressiver sind und trotz GTR wiederkehren. Frühe Rezidive werden wesentlich stärker durch das Ausmaß der Resektion beeinflusst und stellen daher wahrscheinlich ein fortgesetztes Wachstum des Resttumors dar, im Gegensatz zum Wiederauftreten eines zuvor vollständig resezierten Tumors, wie es bei postmedianen Rezidiven der Fall ist. Somit repräsentieren unsere Ergebnisse möglicherweise zwei verschiedene molekulare Subtypen des WHO-Meningeoms Grad I. Zukünftige Studien mit größeren Patientenkohorten und molekularen Tumordaten sind jedoch erforderlich, um die zugrundeliegenden Unterschiede in den molekularen Veränderungen zwischen frühen und postmedianen Rezidiven weiter zu untersuchen.
Grenzwerte
Zu den Grenzwerten unserer Studie gehören ihr retrospektiver Charakter und die geringe Inzidenz von Rezidiven. Unsere Studie umfasst auch Patienten ab 2007 und erstreckt sich daher sowohl auf die WHO-ZNS-Klassifikation von 2007 als auch von 2016. Die einzige signifikante Änderung zwischen den beiden Klassifikationen war jedoch die Hinzufügung der Hirninvasion als einziges Kriterium für den WHO-Grad II-Status. Nur bei zwei der in unserer Kohorte eingeschlossenen Patienten wurde bei der pathologischen Analyse eine Hirninvasion festgestellt, und bei keinem der Patienten kam es zu einem Rezidiv. Daher glauben wir nicht, dass die Einbeziehung von Patienten, die nach dem Klassifizierungsschema von 2007 eingestuft wurden, einen wesentlichen Einfluss auf unsere Ergebnisse hatte. Darüber hinaus stützt sich unsere Studie auf die pathologischen Berichte nach der ersten Resektion, ohne eine zentrale erneute Überprüfung der pathologischen Objektträger. Dies kann zu einer erhöhten Variabilität bei den pathologischen Variablen führen, wie z. B. Kernatypien und andere ähnliche pathologische Befunde, die eine Variabilität zwischen den Beobachtern aufweisen können (27, 28). MIB-1 ist jedoch ein relativ objektives Maß mit geringerer Interobserver-Variabilität zwischen Pathologen, die dieselbe Methode innerhalb eines Pathologielabors anwenden (29). Die Praxis der MIB-1-Tests änderte sich während des Studienzeitraums ebenfalls – von der individuellen Präferenz der Pathologen, die je nach Pathologe variierte, bis hin zu Tests bei allen Patienten. Zu den Faktoren, die von den Pathologen bei der Entscheidung über einen MIB-1-Test berücksichtigt wurden, gehörten auch die atypischen Merkmale, die in unserer Studie untersucht wurden, so dass deren potenzielle Auswirkungen auf unsere Ergebnisse minimiert wurden. Außerdem handelt es sich bei allen Meningeomen in unserer Studie um WHO-Grad I. Daher sind wir der Ansicht, dass eine Verzerrung der Studie aufgrund dieser Veränderungen in der Praxis minimal ist. Auch wenn wir detaillierte klinische und pathologische Merkmale einbeziehen, fehlen in unserer Patientenkohorte Informationen über genetische und molekulare Veränderungen des Tumors, die nachweislich einen erheblichen Einfluss auf die Tumorergebnisse haben (15, 30-32). Daher besteht nach wie vor ein Bedarf an zusätzlichen großen, institutionsübergreifenden Studien mit molekularen/genetischen Daten zusätzlich zu den traditionellen pathologischen und klinischen Variablen bei der Vorhersage des Gesamtrezidivs von WHO-Grad-I-Meningeomen. Dies schließt die Berücksichtigung von molekularen/genetischen Prognostikern wie genomweiten Methylierungsmustern (33, 34), TERT-Promotor-Mutationen (35) und zusätzlichen molekularen Tumordaten ein. In Anbetracht unserer Ergebnisse sind künftige Untersuchungen zu einzigartigen genetischen/molekularen, klinischen und pathologischen Prädiktoren für frühe und spätere Rezidive angesichts der potenziellen Auswirkungen auf die therapeutische Entscheidungsfindung von Ärzten ebenfalls gerechtfertigt.
Dennoch bietet unsere Studie einen detaillierten Einblick in die klinischen und histopathologischen Prädiktoren für ein Rezidiv, insbesondere bei Meningeomen vom WHO-Grad I. Darüber hinaus identifizieren wir Patienten mit einem MIB-1 >4,5 % als Patienten mit einem hohen Rezidivrisiko nach GTR. Wir nutzen unsere Daten auch, um einen Einblick in die Unterschiede zwischen frühen und postmedianen WHO-Grad-I-Meningiom-Rezidiven zu erhalten, wodurch sich möglicherweise verschiedene molekulare Untergruppen von WHO-Grad-I-Meningiomen identifizieren lassen. Unsere Ergebnisse deuten darauf hin, dass Patienten mit einem erhöhten MIB-1-Index und Kernatypien in der pathologischen Analyse, mit einer posterioren Fossa-Lage ihres Tumors und mit STR ein höheres Rezidivrisiko haben und für eine engmaschigere Nachsorge oder sogar eine adjuvante Strahlentherapie in Betracht gezogen werden sollten. Darüber hinaus haben Patienten mit einem MIB-1-Wert von über 4,5 % ein ähnliches Rezidivrisiko wie diejenigen, bei denen der Tumor entfernt wurde, und sollten ebenfalls für eine adjuvante Strahlentherapie in Betracht gezogen werden.
Schlussfolgerung
Es gibt nach wie vor nur wenig Literatur über spezifische Prädiktoren für ein Rezidiv bei Meningeomen vom WHO-Grad I. Die Ergebnisse dieser Studie zeigen, dass die Lage des Tumors in der hinteren Schädelgrube, der MIB-1-Index, die Kernatypie und das Ausmaß der Resektion unabhängig voneinander mit dem Wiederauftreten von Meningeomen des Grades I verbunden sind. Wir zeigen auch, dass Patienten mit einem MIB-1 >4,5% und GTR ein ähnliches Rezidivrisiko haben wie Patienten mit einem STR. Schließlich ergab eine differenzierte Analyse der frühen und der postmedianen Rezidive einen Zusammenhang zwischen dem MIB-1-Index und der Lage der hinteren Schädelgrube bei den postmedianen Rezidiven, während die frühen Rezidive stärker vom Ausmaß der Resektion beeinflusst wurden. Weitere Studien, die unsere Ergebnisse validieren und molekulargenetische Daten einbeziehen, sind erforderlich, um zusätzliche Prädiktoren für ein Rezidiv bei WHO-Meningeomen vom Grad I zu identifizieren. Solche Studien könnten einen genaueren Rahmen für die Risikostratifizierung von Patienten bieten und bei der therapeutischen Entscheidungsfindung helfen, einschließlich des Potenzials für eine adjuvante Strahlentherapie.
Erklärung zur Datenverfügbarkeit
Die Rohdaten, die die Schlussfolgerungen dieses Artikels stützen, werden von den Autoren ohne unangemessene Vorbehalte zur Verfügung gestellt.
Ethikerklärung
Die Studien mit menschlichen Teilnehmern wurden vom UCSF Institutional Review Board geprüft und genehmigt. Eine schriftliche Einwilligung zur Teilnahme war für diese Studie in Übereinstimmung mit der nationalen Gesetzgebung und den institutionellen Anforderungen nicht erforderlich.
Beiträge der Autoren
AH: Konzeptualisierung, Methodik, formale Analyse, Untersuchung, Verfassen des ursprünglichen Entwurfs, Verfassen, Überprüfung und Bearbeitung sowie Visualisierung. JY: Konzeptualisierung, Methodik und schriftliche Überprüfung und Überarbeitung. IK und SS: Untersuchung. J-SC: Visualisierung und formale Analyse. DR und MM: Schriftliche Überprüfung und Überarbeitung. SM: Schriftliche Überprüfung und Überarbeitung, Konzeptualisierung und Methodik. MA: Korrekturlesen, Redaktion und Überwachung. Alle Autoren trugen zum Artikel bei und genehmigten die eingereichte Version.
Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Der Gutachter BB erklärte gegenüber dem behandelnden Redakteur eine frühere Co-Autorenschaft mit den Autoren DR, MM und SM.
1. Ostrom QT, Cioffi G, Gittleman H, Patil N, Waite K, Kruchko C, et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2012-2016. Neuro Oncol. (2019) 21:v1-100. doi: 10.1093/neuonc/noz150
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Karsy M, Guan J, Cohen A, Colman H, Jensen RL. Medical management of meningiomas. Aktueller Stand, gescheiterte Behandlungen und vielversprechende Aussichten. Neurosurg Clin N Am. (2016) 27:249-60. doi: 10.1016/j.nec.2015.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Brastianos PK, Galanis E, Butowski N, Chan JW, Dunn IF, Goldbrunner R, et al. Advances in multidisciplinary therapy for meningiomas. Neuro Oncol. (2019) 21:I18-31. doi: 10.1093/neuonc/noy136
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Pettersson-Segerlind J, Orrego A, Lönn S, Mathiesen T. Long-term 25-year follow-up of chirurgically treated parasagittal meningiomas. World Neurosurg. (2011) 76:564-71. doi: 10.1016/j.wneu.2011.05.015
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Van Alkemade H, De Leau M, Dieleman EMT, Kardaun JWPF, Van Os R, Vandertop WP, et al. Beeinträchtigtes Überleben und langfristige neurologische Probleme bei benignen Meningeomen. Neuro Oncol. (2012) 14:658-66. doi: 10.1093/neuonc/nos013
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Buerki RA, Horbinski CM, Kruser T, Horowitz PM, James CD, Lukas RV. An overview of meningiomas. Futur Oncol. (2018) 14:2161-77. doi: 10.2217/fon-2018-0006
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Rogers L, Barani I, Chamberlain M, Kaley TJ, McDermott M, Raizer J, et al. Meningiomas: knowledge base, treatment outcomes, and uncertainties. Eine RANO-Übersicht. J Neurosurg. (2015) 122:4-23. doi: 10.3171/2014.7.JNS131644
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Marciscano AE, Stemmer-Rachamimov AO, Niemierko A, Larvie M, Curry WT, Barker FG, et al. Benigne Meningeome (WHO Grad I) mit atypischen histologischen Merkmalen: Korrelation der histopathologischen Merkmale mit dem klinischen Verlauf. J Neurosurg. (2016) 124:106-14. doi: 10.3171/2015.1.JNS142228
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Baumgarten P, Gessler F, Schittenhelm J, Skardelly M, Tews DS, Senft C, et al. Brain invasion in otherwise benign meningiomas does not predict tumor recurrence. Acta Neuropathol. (2016) 132:479-81. doi: 10.1007/s00401-016-1598-1
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gousias K, Schramm J, Simon M. The simpson grading revisited: aggressive surgery and its place in modern meningioma management. J Neurosurg. (2016) 125:551-60. doi: 10.3171/2015.9.JNS15754
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Matsuno A, Fujimaki T, Sasaki T, Nagashima T, Ide T, Asai A, et al. Klinische und histopathologische Analyse des proliferativen Potentials von rezidivierenden und nicht-rezidivierenden Meningeomen. Acta Neuropathol. (1996) 91:504-10. doi: 10.1007/s004010050458
PubMed Abstract | Querverweis Volltext | Google Scholar
13. Oya S, Kawai K, Nakatomi H, Saito N. Significance of Simpson grading system in modern meningioma surgery: integration of the grade with MIB-1 labeling index as a key to predict the recurrence of WHO Grade I meningiomas – clinical article. J Neurosurg. (2012) 117:121-8. doi: 10.3171/2012.3.JNS111945
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Yuzawa S, Nishihara H, Tanaka S. Genetic landscape of meningioma. Brain Tumor Pathol. (2016) 33:237-47. doi: 10.1007/s10014-016-0271-7
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karsy M, Azab MA, Abou-Al-Shaar H, Guan J, Eli I, Jensen RL, et al. Clinical potential of meningioma genomic insights: a practical review for neurosurgeons. Neurosurg Focus. (2018) 44:E10. doi: 10.3171/2018.2.FOCUS1849
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Patel AJ, Wan YW, Al-Ouran R, Revelli JP, Cardenas MF, Oneissi M, et al. Molecular profiling predicts meningioma recurrence and reveals loss of DREAM complex repression in aggressive tumors. Proc Natl Acad Sci USA. (2019) 116:21715-26. doi: 10.1073/pnas.1912858116
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Spille DC, Heß K, Sauerland C, Sanai N, Stummer W, Paulus W, et al. Brain invasion in meningiomas: incidence and correlations with clinical variables and prognosis. World Neurosurg. (2016) 93:346-54. doi: 10.1016/j.wneu.2016.06.055
PubMed Abstract | CrossRef Full Text | Google Scholar
18. PiŽem J, Velnar T, Prestor B, Mlakar J, Popović M. Brain invasion assessability in meningiomas is related to meningioma size and grade, and can be improved by extensive sampling of the surgically removed meningioma specimen. Clin Neuropathol. (2014) 33:354-63. doi: 10.5414/NP300750
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Maillo A, Orfao A, Espinosa AB, Sayagués JM, Merino M, Sousa P, et al. Frühe Rezidive bei histologisch gutartigen Meningeomen des Grades I sind assoziiert mit großen Tumoren und der Koexistenz von Monosomie 14 und del(1p36) im angestammten Tumorzellklon. Neuro Oncol. (2007) 9:438-46. doi: 10.1215/15228517-2007-026
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Youngblood MW, Duran D, Montejo JD, Li C, Omay SB, Özduman K, Sheth AH, et al. Correlations between genomic subgroup and clinical features in a cohort of more than 3000 meningiomas. J Neurosurg. (2019). doi: 10.3171/2019.8.jns191266. .
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Chen WC, Magill ST, Wu A, Vasudevan HN, Morin O, Aghi MK, et al. Histopathological features predictive of local control of atypical meningioma after surgery and adjuvant radiotherapy. J Neurosurg. (2019) 130:443-50. doi: 10.3171/2017.9.JNS171609
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Perry A, Stafford SL, Scheithauer BW, Suman VJ, Lohse CM. Die prognostische Bedeutung von MIB-1, p53 und DNA-Durchflusszytometrie bei vollständig resezierten primären Meningeomen. Cancer. (1998) 82:2262-9. doi: 10.1002/(SICI)1097-0142(19980601)82:11<2262::AID-CNCR23>3.0.CO;2-R
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Ohba S, Kobayashi M, Horiguchi T, Onozuka S, Yoshida K, Ohira T, et al. Long-term surgical outcome and biological prognostic factors in patients with skull base meningiomas: clinical article. J Neurosurg. (2011) 114:1278-87. doi: 10.3171/2010.11.JNS10701
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Soyuer S, Chang EL, Selek U, Shi W, Maor MH, DeMonte F. Radiotherapy after surgery for benign cerebral meningioma. Radiother Oncol. (2004) 71:85-90. doi: 10.1016/j.radonc.2004.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Park S, Cha YJ, Suh SH, Lee IJ, Lee KS, Hong CK, et al. Risk group-adapted adjuvant radiotherapy for WHO grade I and II skull base meningioma. J Cancer Res Clin Oncol. (2019) 145:1351-60. doi: 10.1007/s00432-019-02891-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Budohoski KP, Clerkin J, Millward CP, O’Halloran PJ, Waqar M, Looby S, et al. Predictors of early progression of chirurgically treated atypical meningiomas. Acta Neurochir. (2018) 160:1813-22. doi: 10.1007/s00701-018-3593-x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. De La Monte SM, Flickinger J, Linggood RM. Histopathologische Merkmale zur Vorhersage des Wiederauftretens von Meningeomen nach subtotaler Resektion. Am J Surg Pathol. (1986) 10:836-43. doi: 10.1097/00000478-198612000-00002
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Backer-Grøndahl T, Moen BH, Torp SH. Das histopathologische Spektrum der menschlichen Meningeome. Int J Clin Exp Pathol. (2012) 5:231-42.
PubMed Abstract | Google Scholar
29. Rezanko T, Akkalp AK, Tunakan M, Sari AA. MIB-1-Zählmethoden bei Meningeomen und Übereinstimmung unter Pathologen. Anal Quant Cytol Histol. (2008) 30:47-52.
PubMed Abstract | Google Scholar
30. Pérez-Magán E, Campos-Martín Y, Mur P, Fiaño C, Ribalta T, García JF, et al. Genetic alterations associated with progression and recurrence in meningiomas. J Neuropathol Exp Neurol. (2012) 71:882-93. doi: 10.1097/NEN.0b013e31826bf704
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Linsler S, Kraemer D, Driess C, Oertel J, Kammers K, Rahnenführer J, et al. Molekularbiologische Bestimmungen der Meningeom-Progression und des Rezidivs. PLoS ONE. (2014) 9:e94987. doi: 10.1371/journal.pone.0094987
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Barbera S, Miguel TS, Gil-Benso R, Muñoz-Hidalgo L, Roldan P, Gonzalez-Darder J, et al. Genetische Veränderungen mit prognostischem Wert bei histologisch gutartigen Meningeomen. Clin Neuropathol. (2013) 32:311-7. doi: 10.5414/NP300580
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Gao F, Shi L, Russin J, Zeng L, Chang X, He S, et al. DNA methylation in the malignant transformation of meningiomas. PLoS ONE. (2013) 8:e54114. doi: 10.1371/journal.pone.0054114
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Vengoechea J, Sloan AE, Chen Y, Guan X, Ostrom QT, Kerstetter A, et al. Methylation markers of malignant potential in meningiomas. J Neurosurg. (2013) 119:899-906. doi: 10.3171/2013.7.JNS13311
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Lu VM, Goyal A, Lee A, Jentoft M, Quinones-Hinojosa A, Chaichana KL. Die prognostische Bedeutung von TERT-Promotor-Mutationen bei Meningeomen: eine systematische Überprüfung und Meta-Analyse. J Neurooncol. (2019) 142:1-10. doi: 10.1007/s11060-018-03067-x
PubMed Abstract | CrossRef Full Text | Google Scholar