Einführung
Reis hat eine komplexe Wurzelarchitektur mit einer Mischung aus embryonalen und post-embryonalen Wurzeln. Während der Keimung bildet sich zuerst die Keimwurzel aus, kurz darauf folgen die embryonalen Kernwurzeln (Rebouillat et al., 2009; Coudert et al., 2010). Die ersten postembryonalen Adventivwurzeln, die aus der Aktivität des Sprossapikalmeristems hervorgehen, erscheinen einige Tage nach der Keimung des Sämlings. Adventivwurzeln werden auch als Koronar- oder Kronenwurzeln bezeichnet und werden während des gesamten Lebens einer Pflanze gebildet.
Die innere Anatomie der Reiswurzel ist gut beschrieben, insbesondere im Keimlingsstadium (Rebouillat et al., 2009). Mehrere konzentrische Gewebe (von der Peripherie bis zur Stele) befinden sich zwischen der Epidermis und den Gefäßgeweben (Abbildung 1). Diese Gewebe, die zusammen als „Grundgewebe“ bezeichnet werden, werden manchmal auch als „Kortex“ bezeichnet (Lux et al., 2004). Wir behalten hier den Oberbegriff „Grundgewebe“ bei, um die exodermalen, sklerenchymalen, kortikalen und endodermalen Gewebe zu beschreiben. Als „Kortex“ bezeichnen wir das Gewebe, das sich zwischen der Endodermis und dem Sklerenchym befindet.
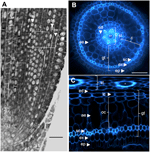
Abbildung 1. Anatomie einer 6 Tage alten Nipponbare-Radicula. (A) Längsschnitt einer fixierten und in Paraplast eingebetteten Radicula. Balken = 100 μm. (B) Querschnitt einer frischen Radicula, betrachtet unter UV-Licht. Balken = 50 μm. (C) Polartransformierte Ansicht von B. Die Gewebeschichten sind wie folgt beschriftet: Stiel (st), Grundgewebe (gt), bestehend aus mehreren Zellschichten: eine Schicht Endodermis (ed), mehrere Schichten Kortex (c), eine Schicht Sklerenchym (sc) und eine Schicht Exodermis (ex). Die Schichten der Endodermis (ed) und der Exodermis (ex) lassen sich leicht durch das Fehlen bzw. die Verringerung der Fluoreszenz in den Zellwandzentren dieser Zellen erkennen. Die Keimwurzel ist durch eine Epidermisschicht (ep) geschützt. Es lassen sich zwei Arten von Rindenschichten erkennen: die innere Rinde (ic), die an die Endodermis (ed) angrenzt, und die äußere Rinde (oc), die schließlich das Aerenchym (ae) bildet. In der Stele ist das Vorhandensein eines großen zentralen Metaxylems (cx) zu beachten, das von 6 Metaxylem-Gefäßen (x) umgeben ist.
Das Grundgewebe besteht aus mehreren Gewebeschichten, die denselben parenchymatösen Ursprung, aber unterschiedliche spezifische Eigenschaften haben, die verschiedene und wichtige strukturelle und funktionelle Rollen in den Wurzeln spielen. Exodermis und Endodermis sind beispielsweise apoplastische Barrieren, die den radialen Transport von Wasser und Nährstoffen aus dem Boden zu den photosynthetischen Organen kontrollieren, was hauptsächlich durch die Ablagerung von Suberinlamellen und die sekundäre Zellwanddifferenzierung geschieht (Gregory, 2006). Sklerenchymzellen sind verholzte Zellen, die eine kritische Barriere für einige Metalle darstellen und möglicherweise eine mechanische Stützfunktion haben (Huang et al., 2012). Im Gegensatz zu diesen drei einschichtigen Geweben besteht das Rindengewebe in der Reiswurzel aus vier oder fünf Schichten. Dieses Gewebe, das auch als Mittelkortex oder Mesodermis bezeichnet wird, zeichnet sich durch die schizogene Bildung von Zwischenräumen aus, die zur Bildung des Aerenchyms im Reis führen (Justin und Armstrong, 1991; Kawai et al., 1998). Das Aerenchym spielt eine wichtige Rolle bei der Toleranz gegenüber Überschwemmungen und gewährleistet einen kontinuierlichen Sauerstofffluss vom Spross zur Wurzel, was das Wurzelwachstum unter anoxischen Bedingungen ermöglicht. Die Rinde hat eine wichtige, aber variable Funktion in der Wurzelphysiologie zahlreicher Arten und ist an der Speicherung, der Überflutungstoleranz oder symbiotischen Interaktionen beteiligt (Lux et al., 2004).
Die Wurzel- und Kronenwurzeln produzieren drei Arten von Seitenwurzeln: kleine Seitenwurzeln (SLRs) und zwei Arten von großen Seitenwurzeln (Kawata und Shibayama, 1965; Kono et al., 1972; Rebouillat et al., 2009). Diese Einteilung basiert auf (i) dem Wurzeldurchmesser: SLRs sind die kleinsten (50-60 μm) und L-LLRs die größten (120-150 μm), (ii) Verzweigungen, die nur an LLRs beobachtet werden, (iii) das Vorhandensein eines zentralen Metaxylemgefäßes nur in LLRs und (iv) das Vorhandensein einer Sklerenchymschicht nur in L-LLRs (Kono et al., 1972; Kawata et al., 1977; Rebouillat et al., 2009). Trotz dieser Klassifizierung bleibt die Identität der inneren Wurzelgewebe in Seitenwurzeln, insbesondere in SLR, ungewiss. Rebouillat et al. (2009) und Kawata et al. (1977) behaupteten beide, dass das Grundgewebe der SLR aus Endodermis, Sklerenchym und Exodermis (von innen nach außen) besteht, während Kono et al. (1972) beschrieben, dass die Sklerenchymzellschicht der inneren Rinde in SLRs und T-LLRs nicht vorhanden ist.
Um dieses Dilemma zu lösen und die Entwicklung und Funktion bestimmter Gewebe im Allgemeinen zu untersuchen, ist die Verwendung von Identitätsmarkern erforderlich. Die meisten der bisher verwendeten Gewebemarker sind morphologische Marker oder histochemische Färbungen, die eine nützliche Methode zur Charakterisierung der Zellidentität darstellen. Berberin zeigt das Vorhandensein von Suberin in den Zellwänden an, das fast ausschließlich in den Caspar’schen Streifen zu finden ist, die jede einzelne Endodermiszelle umgeben, und ist somit ein guter indirekter Marker für die endodermale Identität (Brundett et al., 1988). In A. thaliana wurden auch gewebespezifische Marker entwickelt, indem gewebespezifische Promotoren mit Reportergenen (GUS und/oder GFP) in gentechnisch veränderten Pflanzen fusioniert wurden. So wird beispielsweise der SCARECROW-Promotor als endodermaler Identitätsmarker verwendet (Sugimoto et al., 2010). QC25 und QC46 Enhancer Trap GUS-Linien (Sabatini et al., 2003) und QHB in Reis (Kamiya et al., 2003) wurden aufgrund ihrer QC-spezifischen Expression ebenfalls als Marker für das Ruhezentrum (QC) identifiziert. Trotz des Interesses an diesen Markern sind nur wenige verfügbar und fast ausschließlich in A. thaliana. Sie haben auch Nachteile. So ist beispielsweise die Eignung des SCARECROW (SCR)-Promotors als „Endodermis“-Marker fraglich, wenn es um spezifische Fragen zur Rolle von SCR und SHORT ROOT (SHR) bei der Differenzierung von Grundgewebe geht. In der Tat sind die SCR- und SHR-Gene per se an der Endodermis-/Kortexbildung beteiligt (Wu und Gallagher, 2014). In A. thaliana sind die einzigen verfügbaren Wurzelrindenmarker die Co2 und Co3 Promotoren (Heidstra et al., 2004; Ten Hove et al., 2010). In Reis werden diese Rindenmarker noch nicht verwendet, da es keine eindeutigen Orthologe für die Gene Co2 und Co3 gibt. Bisher wurden bei Reis nur indirekte morphologische Marker verwendet, wie z. B. die Aerenchymbildung für die Rindenidentität (Rebouillat et al., 2009).
Eine weitere Klasse von Markern sind kommerziell erhältliche Antikörper, die gegen Pflanzenzellwände gerichtet sind (http://www.plantprobes.net/index.php). Diese Marker wurden in der Vergangenheit kaum verwendet, aber ihre Effizienz wurde nachgewiesen. So wurden beispielsweise die Zellwand-Antikörper CCRC-M2 und JIM13 bei A. thaliana verwendet, um zu zeigen, dass die einzige Schicht des inneren Gewebes der shr-Mutante eine kortikale Identität aufweist, während die Schicht des Grundgewebes der scr-Mutante mehrere Identitäten aufweist (Di Laurenzio et al., 1996; Helariutta et al., 2000). Diese Marker haben viele Vorteile: ihre Einfachheit und die Möglichkeit, sekundäre Antikörper zu kombinieren, die an verschiedene Fluorochrome gekoppelt sind, um Überschneidungen mit der Autofluoreszenz zu begrenzen, sie erfordern keine genetische Transformation und sie können zur Ergänzung anderer Markerklassen verwendet werden.
In dieser Arbeit beschreiben wir zunächst ein einfaches Protokoll mit mittlerem Durchsatz für die Immunmarkierung frischer Vibratom-Gewebeschnitte. Mit Hilfe dieses Protokolls haben wir Radialschnitte von Reiswurzeln mit einer großen Bibliothek von 174 Zellwand-Antikörpern untersucht. Unter diesen identifizierten wir acht rindenspezifische Marker und wiesen nach, dass Reis zwei Arten von Rindengeweben mit unterschiedlicher Identität besitzt. Wir nannten diese Schichten die innere und die äußere Rinde, basierend auf ihrer jeweiligen anatomischen Position in den Wurzelabschnitten. Um die Nützlichkeit dieser rindenspezifischen Marker zu demonstrieren, haben wir die Identität des Grundgewebes von Seitenwurzeln mit drei dieser Antikörper geklärt. Insbesondere bei SLRs zeigen wir, dass die innere Gewebeschicht eine äußere kortikale Identität aufweist. Unser Protokoll ist so allgemein gehalten, dass es für die Entwicklung von Gewebemarkern bei jeder Art verwendet werden kann, ohne dass transgene Pflanzen erzeugt werden müssen. Dieses Protokoll kann leicht an frische Spross-, Blatt-, Wurzel- oder beliebige andere Pflanzengewebe angepasst werden und stellt eine einfache und leichte Methode zur Identifizierung gewebespezifischer Marker dar. Darüber hinaus können diese Marker in Verbindung mit anderen molekularen Markern verwendet werden.
Ergebnisse
Immunoprofiling von Zellwand-Antikörpern in Radialschnitten von Reiswurzeln zeigt spezifische Antikörper für Rindenschichten
Mit dem Ziel, Antikörper-basierte Marker für Rindenzellen zu identifizieren, haben wir zunächst ein Protokoll für die Immunolabeling von Radialschnitten frischer Reiswurzeln mit mittlerem Durchsatz erstellt (siehe Material und Methoden und ergänzende Abbildung 1 für Details). Anschließend führten wir ein Screening mit monoklonalen Antikörpern durch, die gegen Zellwandbestandteile gerichtet waren (vom Complex Carbohydrate Research Center (CarboSource Services, Athens Georgia, USA) und vom Paul Knox Cell Wall Lab (Universität Leeds, UK), siehe Materialien und Methoden für weitere Einzelheiten), um Kortexmarker zu identifizieren. Von den 174 getesteten Antikörpern wurden nur 12 als vermeintlich kortexspezifisch ausgewählt. Wir testeten ihre Wiederholbarkeit durch zwei zusätzliche Experimente und kamen zu dem Schluss, dass acht Antikörper in den drei Wiederholungen ähnliche und stabile Profile aufwiesen (Abbildung 2). Fünf Antikörper (JIM7, M14, M38, M130 und M131) zeigten in der Rinde das gleiche Immunmarkierungsmuster. Nur nicht benachbarte Zellwände wurden markiert, was zu einer einzigartigen „rautenförmigen“ Markierung aller kortikalen Zellen führte. Bei den drei anderen Antikörpern (LM5, M133 und M107) wurde die Markierung in der Rinde und manchmal in den Sklerenchymzellen nachgewiesen, insbesondere mit den Antikörpern LM5 und M107. Das Signal war homogen auf der Zellwand der Rinde, aber in den inneren Rindenschichten (der an die endodermale Schicht angrenzenden Rindenschicht) war es viel schwächer als in den äußeren Rindenschichten. Somit sind alle diese Antikörper mit Profilen, die komplementär zu kortikalen Geweben sind, spezifische Marker, die zur Analyse der kortikalen Zellidentität verwendet werden können. Darüber hinaus deuten die zwei unterschiedlichen kortikalen Markierungen, die zwei subkortikale Bereiche definieren, darauf hin, dass die äußeren und inneren Schichten eine unterschiedliche molekulare Identität haben, die durch diese Antikörper aufgedeckt wurde.
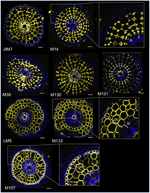
Abbildung 2. Identifizierung von acht spezifischen Kortex-Antikörpern (JIM7, M14, M38, M130, M131, LM5, M133 und M107) unter den 174 gescreenten Antikörpern aus der monoklonalen Zellwand-Bibliothek. Für jeden Antikörper wurden nach der immunhistologischen Markierung unter einem konfokalen Mikroskop zusammengesetzte Bilder von Querschnitten aufgenommen: in gelb das Antikörpermuster bei 561 nm und in blau die Autofluoreszenz der Zellwand unter UV-Licht. Fünf Antikörper (JIM7, M14, M38, M130 und M131) zeigen ein ähnliches Profil in allen gefärbten kortikalen Zellschichten (Rautenformen). Drei Antikörper (LM5, M133 und M107) markieren homogen die kortikalen Zellwände. Beachten Sie, dass bei diesen Antikörpern die inneren Rindenschichten (ic) im Vergleich zu den äußeren Rindenschichten (oc) nicht gefärbt sind. Die Einschübe sind Nahaufnahmen der entsprechenden Bilder. Balken = 20 μm.
Einige spezifische Merkmale dieser beiden subkortikalen Schichten wurden hervorgehoben, als das „Polartransformator“-Plugin der ImageJ-Software (http://imagej.nih.gov/ij/) verwendet wurde, um die Bilder der Wurzelschnitte zu betrachten (Abbildungen 1B,C; Schneider et al., 2012; Lartaud et al., 2014). Die inneren Zellen zeichneten sich durch eine dicke Zellwand im Vergleich zu den äußeren Zellen aus, die verschiedene luftenthaltende Hohlräume aufwiesen, die aus der Zellwandfusion resultierten. Die inneren Rindenzellen wiesen auch eine abgeflachte Form auf, die endodermalen Zellen ähnelte, im Gegensatz zu den äußeren Zellen, die runder waren. In diesem transformierten Bild ist die radiale Zellwand, die von der Innenseite der Zelle zur Außenseite verläuft, und die Autofluoreszenz der endodermalen und exodermalen Zellen nicht sichtbar, was vermutlich auf das Vorhandensein von Casparschen Streifen zurückzuführen ist. In ähnlicher Weise, aber in geringerem Maße, waren kleine Löcher ohne Autofluoreszenz auch an den radialen Zellwänden der inneren Rindenzellen sichtbar.
Alle Seitenwurzeltypen besitzen nur äußeres Rindengewebe
Um die Nützlichkeit der Rindenmarker zu demonstrieren und die Zellidentitäten zu charakterisieren, markierten wir die drei Reis-Seitenwurzeltypen (L-LLR, T-LLR und SLR) mit drei dieser Antikörper (M107, M133 und M14). Da sich L-LLRs nicht oft auf Petrischalen entwickeln, wurden für dieses Experiment Seitenwurzeln von Reissetzlingen gesammelt, die 2 Wochen lang unter hydroponischen Bedingungen gewachsen waren. Zunächst analysierten wir die Organisation des Grundgewebes jedes Typs von Seitenwurzeln, indem wir die Autofluoreszenz der Zellwände in den Quer- und Polaransichten der Wurzelschnitte beobachteten (Abbildung 3). Diese erste Analyse ergab eine leicht unterschiedliche innere radiale Anatomie für die drei Typen von Seitenwurzeln. Ähnlich wie bei den unter UV-Licht betrachteten Wurzelschnitten lassen sich die endodermalen und exodermalen Gewebe durch die Fluoreszenzauslöschung in der Mitte der radialen Zellwände erkennen. Diese beiden Gewebe waren in allen Seitenwurzeln vorhanden. Zwischen der Endodermis und der Exodermis befanden sich in den L-LLRs und T-LLRs mehrere Gewebeschichten, während die SLRs nur eine einzige (nicht identifizierte) Zellschicht besaßen. Die Anatomie der L-LLRs sah aus wie eine Samenwurzel, und außerhalb der Endodermis waren bei der Bildung von Aerenchymgewebe leicht mehrere Schichten von Rindengewebe zu erkennen. Darüber hinaus wurde auch eine Sklerenchymschicht aus dicht gepackten Zellen mit breiten Zellwänden beobachtet. Je nach Experiment war diese Zellschicht nicht immer vollständig ausgebildet. In den T-LLR-Schnitten ähnelte die äußere Schicht dem Kortikalisgewebe und die innere Schicht der einzelnen (nicht identifizierten) SLR-Schicht.
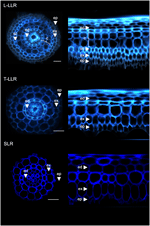
Abbildung 3. Gewebezusammensetzung der großen Seitenwurzeltypen (Large-LLR und Thin-LLR) und der kleinen Seitenwurzel (SLR). Die Keimlinge wurden 2 Wochen lang unter hydroponischen Bedingungen gezogen. Autofluoreszenz der Zellwand in Querschnitten und polarisierte Ansicht unter UV-Licht. Die Gewebe sind wie folgt beschriftet: Epidermis (ep), Exodermis (ex), Kortex (c), Endodermis (ed). Beachten Sie, dass die Epidermis (ep) im Laufe des Experiments häufig fragmentiert wurde. Balken = 20 μm.
Um die im SLR- und T-LLR-Grundgewebe vorhandenen Zellschichten zu identifizieren und die kortikale Identität in den L-LLRs zu bestätigen, haben wir laterale Wurzelschnitte mit drei kortikalspezifischen Antikörpern (M107, M133 und M14; Abbildung 4) immungefärbt. Die Antikörper M107 und M133 markierten alle Zellschichten zwischen der Endodermis und der Exodermis in allen Seitenwurzeln. Ausgehend von der Färbung der Radicula mit diesen Antikörpern deutet diese Beobachtung darauf hin, dass diese Zellschichten eine Sklerenchym- oder Kortikalidentität aufweisen könnten. Die Tatsache, dass M14 auch diese Schichten immunmarkierte, insbesondere in den SLR-Abschnitten, zeigt jedoch eindeutig, dass diese Schichten eine äußere kortikale Identität hatten.

Abbildung 4. Zusammengefügte Bilder von Schnitten der großen Seitenwurzeln (Large-LLR und Thin-LLR) und der kleinen Seitenwurzeln (SLR), immunmarkiert mit M107, M133 und M14. Die Keimlinge wurden 2 Wochen lang unter hydroponischen Bedingungen gezogen. Gelb: Antikörpermarkierung bei 561 nm, blau: Autofluoreszenz unter UV-Licht. Die Gewebe sind wie folgt beschriftet: Epidermis (ep), Exodermis (ex), Kortex (c), Endodermis (ed). Beachten Sie, dass die Epidermis (ep) im Laufe des Experiments häufig fragmentiert wurde. Balken = 20 μm.
Variationen in der Anzahl der äußeren Rindenzellschichten (eine in den SLRs, zwei in den T-LLRs, drei in den L-LLRs und vier bis fünf in der Keimwurzel) spielen eine wichtige Rolle für den Durchmesser der Reiswurzel (Abbildung 5).
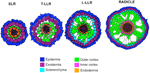
Abbildung 5. Schematische Darstellung des Seitenwurzel- und Radikulargewebes.
Schlussfolgerungen
Es wurden bereits verschiedene Begriffe verwendet, um subkortikale Bereiche in Pflanzen zu bezeichnen. Zum Beispiel wurde das Vorhandensein einer „inneren“ verholzten Rindenschicht, vergleichbar mit der hier untersuchten, bereits bei Wildreis beschrieben (Yang et al., 2014). Bei Mais sind die beiden kortikalen Domänen unterschiedlich definiert (Baluška et al., 1993). Die „innere“ Domäne bildet Aerenchym, was hier der äußeren Rinde entspricht, und die „mittlere-äußere“ Rinde ist ein verholztes Stützgewebe, das Sklerenchym sein könnte. Bei Arabidopsis wurde ebenfalls eine „mittlere Kortex“-Zellschicht beschrieben, die zwischen der kortikalen Monolage und der Endodermis liegt (Baum et al., 2002; Paquette und Benfey, 2005). Neuere Ergebnisse deuten darauf hin, dass diese Rindenschicht, deren Bildung unter anderem durch GA, oxidativen Stress sowie SHR und SCR reguliert wird, eine Rolle bei der abiotischen Toleranz spielt (Paquette und Benfey, 2005; Cui und Benfey, 2009; Pauluzzi et al., 2012; Wu und Gallagher, 2014). Interessanterweise wird diese Schicht auch als eine helixartige Schicht mit einer typischen Form beschrieben (Baum et al., 2002). Könnte diese „mittlere Rindenschicht“ von Arabidopsis funktionell und strukturell der inneren Rindenschicht der Reiswurzel ähnlich sein? In Längs- und Querschnitten von Reis bildet die innere Rindenschicht in der Regel ebenfalls eine Helix, was darauf schließen lässt, dass diese beiden Gewebeschichten vergleichbar sein könnten. Bei Arabidopsis stammt die „mittlere Rindenschicht“ von einer periklinalen Endodermis-Teilung ab, die zwischen 7 und 14 Tagen nach der Keimung vom QC entfernt erscheint (Paquette und Benfey, 2005). Um diese wichtigen Parameter bei Reis zu überprüfen, werden neue Instrumente erforderlich sein. So wurde beispielsweise bisher keine Mutante beschrieben, die den Zeitpunkt der Bildung dieser Schicht beeinflusst. Darüber hinaus sind auch technische Fortschritte bei der Bildgebung des Reis-QC erforderlich. Nichtsdestotrotz bieten unsere Kortex-spezifischen Marker ein neues Werkzeug, um die Funktion und das molekulare Netzwerk zu vergleichen, das an der Bildung des inneren Kortex (Reis) im Vergleich zum „mittleren Kortex“ (Arabidopsis) beteiligt ist. In unserem Labor wird derzeit an der Identifizierung der molekularen Determinanten der inneren und äußeren Rindenbildung gearbeitet, wobei SCR- und SHR-Reisorthologe als erste Kandidaten für die Regulierung der Rindenbildung in Reiswurzeln gelten (Pauluzzi et al, 2012).
Materialien und Methoden
Pflanzenmaterial
Sechs-Tage-alte Sämlinge
Samen der Oryza sativa L. ssp. japonica Nipponbare cultivar wurden vertikal in sterilen Petrischalen (Corning, 431301; 20 × 20 cm) unter kontrollierten Bedingungen (Tag/Nacht-Rhythmus: 12/12 h, 28/25°C, Lichtintensität: 500 μE m-2 s-1) angezogen. Zunächst wurden die Samen durch Spülen in 70%igem Ethanol für ~1 Minute oberflächensterilisiert. Dann wurde das Ethanol durch eine Lösung aus 40 % Bleichmittel in destilliertem Wasser mit drei Tropfen Tween 80 (Sigma-Aldrich P4780-500 mL) ersetzt. Die Samen wurden 30 Minuten lang unter leichtem Rühren in dieser Lösung eingeweicht und anschließend mindestens viermal mit sterilem destilliertem Wasser gespült. Heißes (~50°C) autoklaviertes, halbstarkes Murashige- und Skoog-Medium (MS/2) (250 mL) wird in Petrischalen gegossen und für ~45 Minuten fest werden gelassen. Das MS/2-Festmedium besteht aus 2,15 g.L-1 MS-Medium Basalsalzmischung (Duchefa Biochemie, M0221), 75 mg.L-1 MS-Vitaminmischung (Duchefa Biochemie, M0409) und 8 g.L-1 Agarose Typ II (Sigma-Aldrich, A6877). Die sterilen Samen werden dann mit der Keimwurzel nach unten in das verfestigte MS/2-Medium gedrückt. Die Wurzeln wurden nach 6 Tagen Wachstum geerntet.
Vier Wochen alte Pflanzen
Nach 3 Tagen Keimung in Wasser wurden die Sämlinge in ein hydroponisches System unter kontrollierten Bedingungen (Tag/Nacht-Rhythmus: 12/12 h, 28/25°C, Lichtintensität: 500 μE m-2 s-1, relative Luftfeuchtigkeit: 55%) überführt. Das hydroponische System besteht aus einem 50-Liter-Kunststoffkasten, der 30 Liter hydroponische Lösung enthält und auf den eine 1 cm dicke Schaumstoffmatratze gelegt wird. Die Schaumstoffmatratze ist mit Löchern versehen, um die Triebspitzen der Sämlinge zu erhalten. Das Hydrokulturmedium besteht aus (NH4)2SO4 (0,5 mM), MgSO4.7H2O (1,6 mM), Ca(NO3)2.4H2O (1,2 mM), KNO3 (0,7 mM), FeSO4 (0,1 mM), Na2EDTA (0,1 mM), MnSO4. H2O (1,7 μM), (NH4)6Mo7O24.4H2O (0,2 μM), ZnSO4.7H2O (0,2 μM), CuSO4.5H2O (0,2 μM), H3BO3 (1,4 μM) und KH2PO4 (0,6 mM). Die Lösung wird durch eine Pumpe am Boden der Kunststoffbox belüftet und alle 10 Tage ausgetauscht. Der pH-Wert wurde auf 5,4 ± 0,2 eingestellt und gehalten.
Fresh Root Sectioning
Die Spitzen wachsender Radicula oder Seitenwurzeln (2 cm) wurden mit einer scharfen Klinge abgeschnitten und parallel zueinander platziert, um die Wurzelspitzen auszurichten (ergänzende Abbildungen 1A,B). Sie wurden in einen Tropfen 3%iger geschmolzener Agarose (50°C; ergänzende Abbildung 1C) eingebettet. Die Blöcke mit den Wurzelspitzen wurden in eine 3 × 1 × 1 cm große Vertiefung eingelegt, die mit 3 % geschmolzener Agarose gefüllt war (ergänzende Abbildung 1D). Nach dem Erstarren wurden die Blöcke in der Größe verändert und auf eine Vibratomplatte geklebt, um sie zu schneiden. Die Parameter des Vibratoms (Hm650v (Thermo Scientific Microm)) waren Geschwindigkeit 30, Frequenz 70, Amplitude 0,8 und Dicke 60 μm (ergänzende Abbildung 1E). Die Schnitte wurden entweder auf Kammer-Objektträger (Lab-teak 177402) für die Immunfärbung (ergänzende Abbildung 1F) oder auf mit 1X alkalischem Phosphatpuffer (PBS, Sigma-Aldrich P3813) befeuchtete Objektträger für die Beobachtung übertragen.
Immunolokalisierung
Die auf den Kammer-Objektträgern platzierten Schnitte (drei pro Kammer) wurden zunächst in 0,1 M Glycin, ergänzt mit 1X PBS, und dann zweimal in 1X PBS, jeweils für 10 min, gespült. Die Gewebe wurden dann in eine PBS-Lösung mit 5 % fötalem Rinderserum (Blocking Solution, Thermo Fisher 37520) bei 4 °C über Nacht unter Rühren getaucht. Primäre Antikörper, 1/10 in dieser Blockierungslösung verdünnt, wurden über Nacht bei 4 °C unter Rühren aufgetragen. Die Schnitte wurden dann dreimal 10 Minuten lang in 1facher PBS gespült. Die Wurzelschnitte wurden 2 Stunden lang mit den 500-fach in Blockierlösung verdünnten sekundären Antikörpern unter Rühren inkubiert. Diese Antikörper waren an einen Fluorophor, Alexa 546 Anti-Ratten-Antikörper (Invitrogen A11081) oder Alexa 546 Anti-Maus-Antikörper (Invitrogen A11060), gekoppelt. Anschließend wurden die Schnitte dreimal in 1X PBS unter Schütteln für jeweils 10 Minuten gespült. Die Kammern wurden entfernt und einige Tropfen Mowiol-Einbettungsmedium (Sigma-Aldrich 81381) wurden hinzugefügt. Die Wurzelabschnitte wurden mit einem Deckglas versehen und 36 Stunden lang bei 4°C im Dunkeln getrocknet.
Paraplast-Fixierung
Die 6 Tage lang auf Petrischalen gewachsenen Radicula wurden über Nacht bei 4°C in 4% Paraformaldehyd (in PBS 1X) fixiert und zweimal mit PBS 1X gespült (Jackson, 1991). Die fixierten Gewebe wurden in Ethanol dehydriert, mit Histochoice Clearing Agent (HistoClear, Sigma Aldrich) geklärt und in Paraplast (Fisher) eingebettet. Die Gewebe wurden mit einem Leica RM2255 Mikrotom in 6 μm dicke Schnitte geschnitten und auf SuperfrostPlus-Objektträger (Fisher) aufgezogen.
Mikroskopie
Aufhellungs- und Autofluoreszenzbeobachtungen wurden mit einem Leica DM4500 Mikroskop durchgeführt. Für die Autofluoreszenz wurden die Bilder mit dem „A“-Filterwürfel (Anregungsbereich: UV; Anregungsfilter: BP 340-380; Unterdrückungsfilter: LP 425). Die immungefärbten Schnitte wurden mit konfokalen Mikroskopen betrachtet: Zeiss LSM 510 oder Leica SP8. Die Zellwände wurden zunächst durch Autofluoreszenz sichtbar gemacht. Der sekundäre Antikörper wurde mit einem Helium/Neon-Laser bei 543 bzw. 561 nm sichtbar gemacht. Die Bilder wurden mit einer Farbkamera Retiga 2000R (QIMAGING, Kanada) aufgenommen, auf der die Bildaufnahmesoftware Volocity (Improvision, UK) läuft.
Beiträge der Autoren
SH, FD, MB, CB: Erfassung der Daten; SH, CP, AD: Analyse der Daten; SH, EG, CP, AD: Abfassung des Manuskripts.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Wir danken MRI (Montpellier RIO Imaging plateform), PHIV und La Gaillarde Plateforms für ihre technische Unterstützung bei der Immunolokalisierung und/oder konfokalen und Multiphotonen-Bildgebung. SH wird durch ein CIRAD-Promotionsstipendium unterstützt.
Ergänzendes Material
Das ergänzende Material zu diesem Artikel finden Sie online unter: https://www.frontiersin.org/article/10.3389/fpls.2015.01139
Abkürzungen
ae, Aerenchym; c, Cortex; ed, Endodermis; ep, Epidermis; ex, Exodermis; gt, Grundgewebe; ic, innerer Cortex; L-LLR, Große Seitenwurzel vom Großtyp; oc, äußere Rinde; sc, Sklerenchym; SLR, Kleine Seitenwurzel; st, Stele; T-LLR, Große Seitenwurzel vom Dünntyp; x, Xylem.
Baluška, F., Brailsford, R. W., Hauskrecht, M., Jackson, M. B., and Barlow, P. W. (1993). Zellulärer Dimorphismus in der Maiswurzelrinde: Beteiligung von Mikrotubuli, Ethylen und Gibberellin an der Differenzierung des zellulären Verhaltens in postmitotischen Wachstumszonen. Bot. Acta 106, 394-403. doi: 10.1111/j.1438-8677.1993.tb00766.x
CrossRef Full Text | Google Scholar
Baum, S. F., Dubrovsky, J. G., and Rost, T. L. (2002). Apikale Organisation und Reifung der Rinde und des Gefäßzylinders in Wurzeln von Arabidopsis thaliana (Brassicaceae). Am. J. Bot. 89, 908-920. doi: 10.3732/ajb.89.6.908
PubMed Abstract | CrossRef Full Text | Google Scholar
Brundett, M. C., Enstone, D. E., and Peterson, C. A. (1988). A Berberine-aniline blue fluorescent staining procedure for suberin, lignin, and callose in plant tissue. Protoplasma 146, 133-142. doi: 10.1007/BF01405922
CrossRef Full Text | Google Scholar
Coudert, Y., Périn, C., Courtois, B., Khong, N. G., and Gantet, P. (2010). Genetische Kontrolle der Wurzelentwicklung bei der Modellgetreideart Reis. Trends Plant Sci. 15, 219-226. doi: 10.1016/j.tplants.2010.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., and Benfey, P. N. (2009). Interplay between SCARECROW, GA and LIKE HETEROCHROMATIN PROTEIN 1 in ground tissue patterning in the Arabidopsis root. Plant J. 58, 1016-1027. doi: 10.1111/j.1365-313X.2009.03839.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Laurenzio, L., Wysocka-Diller, J., Malamy, J. E., Pysh, L., Helariutta, Y., Freshour, G., et al. (1996). Das SCARECROW-Gen reguliert eine asymmetrische Zellteilung, die für die Bildung der radialen Organisation der Arabidopsis-Wurzel wesentlich ist. Cell 86, 423-433. doi: 10.1016/S0092-8674(00)80115-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Gregory, P. J. (2006). Plant Roots: Growth, Activity, and Interaction with Soils. Oxford; Ames, IA: Blackwell Pub.
Google Scholar
Heidstra, R., Welch, D., and Scheres, B. (2004). Mosaikanalysen unter Verwendung markierter Aktivierungs- und Deletionsklone entschlüsseln die Wirkung von Arabidopsis SCARECROW bei der asymmetrischen Zellteilung. Genes Dev. 18, 1964-1969. doi: 10.1101/gad.305504
PubMed Abstract | CrossRef Full Text | Google Scholar
Helariutta, Y., Fukaki, H., Wysocka-Diller, J., Nakajima, K., Jung, J., Sena, G., et al. (2000). Das SHORT-ROOT-Gen steuert die radiale Musterung der Arabidopsis-Wurzel durch radiale Signalübertragung. Cell 101, 555-567. doi: 10.1016/S0092-8674(00)80865-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, C. F., Yamaji, N., Ono, K., and Ma, J. F. (2012). Ein Leucin-reiches Repeat-Rezeptor-ähnliches Kinase-Gen ist an der Spezifikation der äußeren Zellschichten in Reiswurzeln beteiligt. Plant J. 69, 565-576. doi: 10.1111/j.1365-313X.2011.04824.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, D. (1991). „In-situ hybridization in plants“ in Molecular Plant Pathology: A Practical Approach, eds D. J. Bowles, M. McPherson, and S. J. Gurr (Totowa, NJ: Humana Press), 163-174.
Google Scholar
Justin, S. H. F. W., and Armstrong, W. (1991). Beweise für die Beteiligung von Ethylen an der Bildung von Aerenchymen in Adventivwurzeln von Reis (Oryza sativa L.). New Phytol. 118, 49-62. doi: 10.1111/j.1469-8137.1991.tb00564.x
CrossRef Full Text | Google Scholar
Kamiya, N., Nagasaki, H., Morikami, A., Sato, Y., and Matsuoka, M. (2003). Isolierung und Charakterisierung eines Homeobox-Gens vom Typ Reis WUSCHEL, das spezifisch in den zentralen Zellen eines Ruhezentrums im Wurzelapikalmeristem exprimiert wird. Plant J. 35, 429-441. doi: 10.1046/j.1365-313X.2003.01816.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kawai, M., Samarajeewa, P. K., Barrero, R. A., Nishiguchi, M., und Uchimiya, H. (1998). Cellular dissection of the degradation pattern of cortical cell death during aerenchyma formation of rice roots. Planta 204, 277-287. doi: 10.1007/s004250050257
CrossRef Full Text | Google Scholar
Kawata, S., Sasaki, O., and Yamazaki, K. (1977). Über die Struktur der Kronenwurzel und der Seitenwurzel und die Gefäßverbindung zwischen ihnen bei Reispflanzen. Jpn. J. Crop. Sci. 46, 569-579. doi: 10.1626/jcs.46.569
CrossRef Full Text | Google Scholar
Kawata, S., and Shibayama, B. (1965). On the lateral root primordia formation in the crown roots of rice plant. Proc. Crop Sci. Soc. Jpn. 33, 423-431. doi: 10.1626/jcs.33.423
CrossRef Full Text | Google Scholar
Kono, Y., Igeta, M., and Yamada, N. (1972). Studien über die Entwicklungsphysiologie der Seitenwurzeln in Reissamenwurzeln. Jpn. J. Crop. Sci. 41, 192-204. doi: 10.1626/jcs.41.192
CrossRef Full Text
Lartaud, M., Perin, C., Courtois, B., Thomas, E., Henry, S., Bettembourg, M., et al. (2014). PHIV-RootCell: a supervised image analysis tool for rice root anatomical parameter quantification. Front. Plant Sci. 5:790. doi: 10.3389/fpls.2014.00790
PubMed Abstract | CrossRef Full Text | Google Scholar
Lux, A., Luxova, M., Abe, J., and Morita, S. (2004). Wurzelrinde: strukturelle und funktionelle Variabilität und Reaktionen auf Umweltstress. Root Res. 13, 117-131. doi: 10.3117/rootres.13.117
CrossRef Full Text | Google Scholar
Paquette, A. J., and Benfey, P. N. (2005). Die Reifung des Bodengewebes der Wurzel wird durch Gibberellin und SCARECROW reguliert und erfordert SHORT-ROOT. Plant Physiol. 138, 636-640. doi: 10.1104/pp.104.058362
PubMed Abstract | CrossRef Full Text | Google Scholar
Pauluzzi, G., Divol, F., Puig, J., Guiderdoni, E., Dievart, A., and Périn, C. (2012). Surfing along the root ground tissue gene network. Dev. Biol. 365, 14-22. doi: 10.1016/j.ydbio.2012.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rebouillat, J., Dievart, A., Verdeil, J., Escoute, J., Giese, G., Breitler, J., et al. (2009). Molekulargenetik der Reiswurzelentwicklung. Rice 2, 15-34. doi: 10.1007/s12284-008-9016-5
CrossRef Full Text | Google Scholar
Sabatini, S., Heidstra, R., Wildwater, M., and Scheres, B. (2003). SCARECROW ist an der Positionierung der Stammzellennische im Wurzelmeristem von Arabidopsis beteiligt. Genes Dev. 17, 354-358. doi: 10.1101/gad.252503
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, C. A., Rasband, W. S., and Eliceiri, K. W. (2012). NIH Image to ImageJ: 25 years of image analysis. Nat. Methods 9, 671-675. doi: 10.1038/nmeth.2089
PubMed Abstract | CrossRef Full Text | Google Scholar
Sugimoto, K., Jiao, Y., and Meyerowitz, E. M. (2010). Die Regeneration von Arabidopsis aus mehreren Geweben erfolgt über einen Wurzelentwicklungspfad. Dev. Cell 18, 463-471. doi: 10.1016/j.devcel.2010.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Ten Hove, C. A., Willemsen, V., de Vries, W. J., Van Dijken, A., Scheres, B., and Heidstra, R. (2010). SCHIZORIZA kodiert für einen Kernfaktor, der die Asymmetrie der Stammzellteilungen in der Arabidopsis-Wurzel reguliert. Curr. Biol. 20, 452-457. doi: 10.1016/j.cub.2010.01.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., and Gallagher, K. L. (2014). Die Bewegung des nicht-zellautonomen Transkriptionsfaktors SHORT-ROOT ist auf das Endomembransystem angewiesen. Plant J. 80, 396-409. doi: 10.1111/tpj.12640
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Zhang, X., Li, J., Bao, M., Ni, D., and Seago, J. L. (2014). Anatomie und Histochemie von Wurzeln und Sprossen bei Wildreis (Zizania latifolia Griseb.). J. Bot. 2014, 9. doi: 10.1155/2014/181727
CrossRef Full Text | Google Scholar