Einführung
Die Infektion mit dem Hepatitis-B-Virus (HBV) ist in den meisten Teilen Asiens die häufigste Ursache für Leberzirrhose und hepatozelluläres Karzinom.1,2 Die Pathogenese der chronischen Hepatitis wird durch die Interaktion zwischen der Immunreaktion des Wirts und den Hepatozyten, die HBV-Antigene präsentieren, vermittelt.3,4 Frühere Studien haben gezeigt, dass die Expression von HBV-Antigenen durch Hepatozyten in engem Zusammenhang mit dem Stadium und der Aktivität der chronischen Lebererkrankung steht. In der Immuntoleranzphase befinden sich die Hepatitis-B-Kernantigene (HBcAg) hauptsächlich im Zellkern und korrelieren mit der HBV-Replikation, während in der anschließenden Immun-Clearance-Phase eine intrahepatische Verschiebung der HBcAg aus dem Zellkern in das Zytoplasma stattfindet und mit den histologischen Aktivitäten der chronischen Hepatitis in Verbindung gebracht wird.5,6 Bei der intrahepatischen Expression von Hepatitis-B-Oberflächenantigen (HBsAg) wurden drei Muster unterschieden – homogener Typ, Typ I Glasmehlhepatozyten (GGH) und Typ II GGH. Homogene Muster in gruppierter, diskreter oder schwacher Ausprägung wurden bei Patienten mit hoher Virämie oder aktiver Hepatitis beobachtet. GGHs vom Typ I sind typischerweise einzeln in Leberläppchen verstreut und weisen eine einschlussartige, dichte und homogene Expression auf, während GGHs vom Typ II Oberflächenantigene an der Peripherie von Hepatozyten exprimieren, die sich in Gruppen zusammenlagern und in der Regel während der niedrigen Replikationsphase vorhanden sind und von der aktiven Hepatitis bis zur Leberzirrhose und dem hepatozellulären Karzinom vorherrschend werden.7-10 Daher sind sowohl die intrahepatische HBcAg- als auch die HBsAg-Expression eng mit dem natürlichen Verlauf der Infektion und der HBV-Replikation verbunden.
Unter den Phasen der chronischen Hepatitis B trat die Phase der Immunabwehr, die auch als HBeAg-positive chronische Hepatitis B bezeichnet wird, häufig in jüngeren Bevölkerungsgruppen auf, wies weniger schwere histologische Aktivitäten auf und beherbergte eine geringere Rate an Precore-A1896-Mutationen und Basal-Core-Promoter (BCP) T1762/A1764-Mutationen als die HBeAg-negative chronische Hepatitis B.11-14 Der Verlauf der chronischen Hepatitis B ist dynamisch und ergibt sich aus dem Zusammenspiel von Virusreplikation und Wirtsimmunsystem. Daher werden bei HBeAg-positiven Patienten häufig unterschiedliche klinische Merkmale oder histologische Aktivitäten beobachtet. So weisen beispielsweise 34 bis 55 % der Patienten eine überbrückende Fibrose oder Zirrhose in der Leberhistologie auf, während die übrigen Patienten eine leichte Fibrose zeigen.15,16 Die HBsAg-Akkumulation in den Hepatozyten ist nachweislich mit spezifischen viralen Mutationen verbunden und steht in Zusammenhang mit der Krankheitsaktivität.8,9 Es ist interessant, die Merkmale der intrahepatischen HBsAg-Expression bei Patienten mit unterschiedlichem Schweregrad der Leberhistologie zu untersuchen.
Virale Mutanten entwickeln sich in der Regel unter dem Druck der Immunüberwachung des Wirts. Unter den natürlich vorkommenden HBV-Mutanten hat sich die BCP-Mutation T1762/A1764 mit fortschreitender Krankheit durchgesetzt und wurde häufig mit fortgeschrittener Lebererkrankung und hepatozellulärem Karzinom in Verbindung gebracht.17,18 Auch die Muster der intrahepatischen HBsAg-Expression änderten sich im natürlichen Verlauf der chronischen Hepatitis B. Der Zusammenhang zwischen BCP T1762/A1764-Mutationen und der intrahepatischen HBsAg-Expression ist noch unbekannt und muss noch untersucht werden.
Ziel dieser Studie war es daher, die Merkmale der intrahepatischen HBsAg-Expression zu bewerten und den Zusammenhang mit der Leberhistologie, den Markern für die virale Replikation und den HBV-Mutanten bei HBeAg-positiver chronischer Hepatitis B zu analysieren.
Material und MethodenPatienten
Insgesamt wurden 181 behandlungsnaive Hepatitis B e-Antigen (HBeAg)-positive Patienten, die die Einschlusskriterien erfüllten, retrospektiv in diese Studie aufgenommen. Die Einschlusskriterien waren ein Alter von mehr als 18 und weniger als 70 Jahren, positives Serum-HBsAg seit mehr als 6 Monaten und ein Serum-HBV-DNA-Spiegel ≥ 100.000 Kopien/ml, abnormale Serum-Alanin-Aminotransferase-Werte, keine andere erklärbare Ätiologie der chronischen Hepatitis, einschließlich Alkohol, Autoimmunhepatitis oder Marker für eine Infektion mit dem Hepatitis-C-Virus, dem Hepatitis-D-Virus oder dem humanen Immundefizienzvirus, sowie das Fehlen einer Anti-HBV-Behandlung in der Anamnese und einer Leberbiopsieprobe für die histologische Auswertung. Das Serum und die Leberbiopsie aller Patienten wurden vor der antiviralen Behandlung entnommen, und die Proben wurden bis zur Untersuchung bei -70 oC gelagert. Diese Studie wurde vom Institutional Review Board des National Cheng Kung University Hospital genehmigt (Nr.: ER-99-398). Es wurde eine informierte Zustimmung gemäß der Deklaration von Helsinki eingeholt.
HBV-virologische Tests
Die HBV-Genotypisierung wurde mit der Multiplex-Polymerase-Kettenreaktion durchgeführt, wie an anderer Stelle beschrieben.19 Der HBV-DNA-Spiegel im Serum wurde mit dem COBAS Amplicor HBV Monitor Test (COBAS-AM Assay, Roche Diagnostics, Branchburg, NJ) gemessen. Der HBsAg-Spiegel im Serum wurde mit dem Abbott Architect HB-sAg QT (Abbott Diagnostics, Rungis, Frankreich) mit einem dynamischen Bereich von 0,05-250,0 IU/mL quantifiziert. Proben mit HBsAg-Spiegeln > 250 IU/mL wurden in Verdünnungen von 1:20 und 1:1000 erneut getestet.
Polymerase-Kettenreaktion und Sequenzierung der Vorkern- und BCP-Regionen
HBV-DNA wurde aus 50 μl Serum mit dem Blood and Tissue Genomic Mini Kit (VIOGENE, Taipei, Taiwan) extrahiert. Die erste PCR-Runde wurde unter den folgenden Bedingungen durchgeführt: 96 oC für 2 min, 94 oC für 1 min, 54 oC für 1 min und 72 oC für 2 min mit den Primern 5′-ACCTCTGCACGTAGCATGG (vorwärts) und 3′-GGATTAAAGACAGGTACAGTAGAAG (rückwärts). Die zweite PCR-Runde wurde unter denselben Bedingungen mit den Primern 5′-ATGTCAACGACCGACCTTGA (vorwärts) und 3′-TTCCCACCTTATGAGTCCAAG (rückwärts) durchgeführt. Die gereinigten PCR-Produkte wurden dann mit einem automatisierten DNA-Sequenzer ABI 310 und dem ABI PRISM Big Dye Terminator Cycle Sequencing Ready Reaction Kit (Applied Biosystems) mit dem Vorwärtsprimer, der in der zweiten PCR-Runde verwendet wurde, direkt sequenziert.
Leberhistologie
Die Leberhistologie wurde von einem einzigen Pathologen beurteilt, der die Herkunft der Patienten nicht kannte. Nekroinflammation und Fibrose wurden anhand des Nekroinflammationsgrads nach Knodell (von 0 bis 18)20 bzw. des Fibrosestadiums nach Ishak (von 0 bis 6) bewertet.21
Die immunhistochemische Färbung wurde wie an anderer Stelle beschrieben durchgeführt.22 Kurz gesagt, wurden entparaffinierte 5 μm dicke Schnitte mit monoklonalem Maus-Anti-HBsAg (Klon 3E7, Dako Corp., Carpinteria, USA) und Anti-HBcAg (Novocastra Laboratories, Newcastle, UK) über Nacht bei 4°C inkubiert. Die optimale Verdünnung von Anti-HBsAg oder Anti-HBcAg wurde mit Lebergewebe von HBV-Trägern als Positivkontrolle bestimmt. Der StrAviGen Super Sensitive MultiLink Kit (BioGenex) wurde zum Nachweis des resultierenden Immunkomplexes verwendet. Die Peroxidase-Aktivität wurde mit einem Aminoethylcarbazol-Substrat-Kit (Zymed Laboratory, Inc, San Francisco, CA) sichtbar gemacht. Abschließend wurden die Schnitte mit Hämatoxylin gegengefärbt. Als Negativkontrolle wurde bei der Inkubation der primäre Antikörper durch nicht-immunes Maus-Immunglobulin ersetzt. Die Muster der HBcAg-Expression im Zellkern, im Zytoplasma oder in beiden wurden aufgezeichnet. Die Muster der HBsAg-Expression wurden als homogen, Typ I GGH, Typ II GGH klassifiziert.22 Homogen gefärbte Hepatozyten wurden als Hepatozyten mit mäßiger bis starker homogener zytoplasmatischer Färbung identifiziert; Typ I GGHs wurden als Hepatozyten mit dichter globulärer oder „einschlussartiger“ Färbung identifiziert, und Typ II GGHs wurden als Hepatozyten mit Oberflächenantigen-Färbung an den Zellrändern oder der Peripherie identifiziert.6,22 GGHs vom Typ I treten einzeln oder gehäuft in den Leberläppchen auf, während GGHs vom Typ II durchweg in Knötchen gehäuft auftreten. Die Expressionsniveaus von HBcAg und HBsAg wurden semiquantitativ nach dem Anteil der immunmarkierten Zellen auf einer Skala von 0 bis 4+ bewertet, was einer Positivität in 0, 1-10, 11-25, 25-50% und mehr als 50% der untersuchten Hepatozyten entspricht.
Statistische Analysen
Daten wurden als Mittelwert ± Standardabweichung angegeben. Kontinuierliche Variablen wurden mit dem Mann-Whitney U-Test oder der Kruskal-Wallis ANOVA für die univariate Analyse verglichen. Kategorische Variablen wurden mit dem χ2-Test oder dem exakten Test von Fisher analysiert. Unabhängige Faktoren, die mit der Höhe der intrahepatischen HBsAg-Expression assoziiert waren, wurden mittels multivariater logistischer Regressionsanalyse untersucht. Die Datenverarbeitung und die statistischen Analysen wurden mit der SPSS-Software für Windows, Version 17.0 (SPSS Inc., Chicago, IL) durchgeführt.
ErgebnisseCharakteristik der teilnehmenden Patienten
Tabelle 1 enthält die demografischen Merkmale der 181 teilnehmenden Patienten. Die meisten Patienten waren männlich (69,1 %) und 63,0 % von ihnen wiesen den HBV-Genotyp C auf. Die Precore-A1896-Mutation wurde bei 20 Patienten (11,0 %) und die BCP-T1762/A1764-Mutationen bei 38 Patienten (21,0 %) nachgewiesen. Von den 181 Patienten wurde bei 105 Patienten (58,0 %) eine positive HB-sAg-Färbung festgestellt. Patienten mit HBsAg-Färbung wiesen signifikant höhere Serum-HBsAg-Werte auf (P
Klinische, virologische und histologische Merkmale der 181 Patienten.
| Merkmale | Wert | |||
|---|---|---|---|---|
| HBsAg-Expression | P-Wert | |||
| Alle Patienten (n = 181) | Negativ (n = 76) | Positiv (n = 105) | ||
| Alter (J.) ± SD | 36.4 ± 10.5 | 34,2 ± 9,2 | 38,0 ± 11,2 | 0,009 |
| Geschlecht (männlich/weiblich) | 125/56 | 50/26 | 75/30 | 0.418 |
| Mittlerer AST-Wert (U/L) ± SD | 59,7 ± 51,2 | 58,7 ± 42,5 | 60,5 ± 56.8 | 0.634 |
| Mittelwert des ALT-Wertes (U/L) ± SD | 116.3 ± 124.2 | 120.2 ± 100.8 | 113.5 ± 139.1 | 0.282 |
| HBV-Genotyp (B/C) | 114/67 | 66/10 | 48/57 | |
| Precore: G1896/A1896 | 20/161 | 13/63 | 7/98 | 0.027 |
| BCP:* mutant/wild | 38/143 | 12/64 | 26/79 | 0.144 |
| HBV DNA (log Kopien/mL) | 8.4 ± 1.1 | 4,0 ± 0,7 | 4,3 ± 0,7 | |
| HBsAg-Spiegel ((log IU/mL) | 4,2 ± 0.7 | 8,1 ± 1,0 | 8,6 ± 1,1 | 0,003 |
| Mittlerer Knodell Nekroinflammationsgrad ± SD | 5.0 ± 3,0 | 5,3 ± 2,8 | 4,7 ± 3,0 | 0,128 |
| Mittelwert Ishak-Fibrosestadium ± SD | 1,8 ± 1,6 | 1,7 ± 1,2 | 1,9 ± 1,7 | 0.703 |
Mutant, T1762 und A1764; wild, A1762 und T1764. Der χ2-Test wurde für die Variablen Geschlecht, HBV-Genotyp, Precore- und basale Core-Promotor-Mutationen verwendet, während der Mann-Whitney-U-Test für die anderen Variablen verwendet wurde. AST: Aspartat-Aminotransferase. ALT: Alanin-Aminotransferase. BCP: Basaler Kernpromotor. HBV: Hepatitis-B-Virus.
Verteilungsmuster der HBsAg-Expression
Bei den 105 Patienten, die eine HBsAg-Expression aufwiesen, wurde ein homogenes Muster (Abbildung 1A) bei 34 (32.4%), Typ I GGH (Abbildung 1B) wurde bei 50 (47,6%), Typ II GGH (Abbildung 1C) bei sieben (6,7%) und ein gemischtes Muster bei 14 (13,3%) Patienten festgestellt. Wie aus Tabelle 2 hervorgeht, wurde eine höhere Prävalenz von BCP T1762/A1764-Mutationen bei Typ II GGH (P =0,001) im Vergleich zu anderen Mustern beobachtet. Es bestand eine reziproke Beziehung zwischen der HBsAg-Expression und den Serum-Virusreplikationsmarkern. Abbildung 1D zeigt, dass Patienten mit Typ II GGH-Expression niedrigere HBV-DNA-Werte und HBsAg-Titer, aber höhere intrahepatische HBsAg-Expressionswerte aufwiesen (Abbildung 1D). Außerdem wies die Leberhistologie von Patienten mit Typ II GGH eine deutlich stärkere Lebernekroinflammation und Fibrose sowie eine höhere intrahepatische HBsAg-Expression auf (Abbildung 1E).
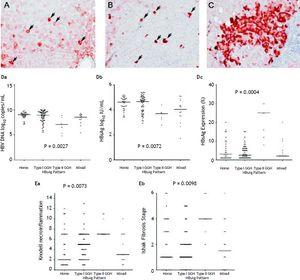
Gehaltsmuster von HBsAg. A. Einige mäßig bis stark mit homogenem Zytoplasma HBsAg-gefärbte Hepatozyten (Pfeile) vor einem Hintergrund schwach gefärbter Hepatozyten. Der Zellkern jedes homogen gefärbten Hepatozyten befand sich in der Mitte der Zelle. B. Typ-I-Glasmehlhepatozyten (GGH) mit dichter globulärer oder „einschlussartiger“ HBsAg-Färbung (Pfeile) waren im Leberparenchym verstreut. C. Ein Cluster von Typ-II-GGHs zeigte HBsAg-Färbung am Zellrand oder in der Peripherie. Korrelationen zwischen HBsAg-Expressionsmustern und Serum-HBV-DNA-Spiegel (Da), Serum-HBsAg-Spiegel (Db) und intrahepatischem HBsAg-Expressionsspiegel (Dc). Der Zusammenhang zwischen HBsAg-Expressionsmustern und dem Grad der Nekroinflammation nach Knodell (Ea) und dem Fibrosestadium nach Ishake (Eb). Vergleiche zwischen den Gruppen wurden durch Kruskal-Wallis ANOVA analysiert.
Demographische Merkmale nach Verteilungsmustern f HBsAg-Expression.
| HBsAg-Muster (n = 105) | |||||
|---|---|---|---|---|---|
| Gemischt (n = 14) | Homogen | Typ I GGH | Typ II GGH | P-Wert | |
| (n = 34) | (n = 50) | (n = 7) | |||
| Alter (J.) ± SD | 36.3 ± 9.2 | 36.3 ± 10.0 | 39.2 ± 12.7 | 40.0 ± 7.9 | 0.104 |
| Geschlecht (männlich/weiblich) | 11/3 | 26/11 | 35/15 | 6/1 | 0.720 |
| Mittlerer AST-Wert (U/L) ± SD | 64,9 ± 56,5 | 61,1 ± 38,6 | 49,9 ± 28,3 | 122.4 ± 168,7 | 0,474 |
| Mittelwert ALT-Spiegel (U/L) ± SD | 116,7 ± 112,4 | 114,6 ± 91,1 | 91,5 ± 63,8 | 259,1 ± 447.6 | 0.651 |
| HBV-Genotyp (B/C) | 10/4 | 15/19 | 22/28 | 1/6 | 0.085 |
| Precore: G1896/A1896 | 0/14 | 3/31 | 4/46 | 0/7 | 0.594 |
| BCP:* mutant/wild | 4/10 | 4/30 | 12/38 | 6/1 | 0.001 |
| HBV-DNA (log Kopien/ml) | 3,9 ± 1,0 | 4.5 ± 0,5 | 4,4 ± 0,7 | 3,6 ± 0,5 | 0,001 |
| HBsAg Spiegel ((log IU/mL) | 8,2 ± 1.1 | 8,9 ± 0,7 | 8,7 ± 1,1 | 6,9 ± 1,5 | |
| Knodellnekroinflammationsgrad ± SD | 4.2 ± 2.9 | 4.2 ± 3.3 | 4.7 ± 2.7 | 8.6 ± 2.0 | 0.003 |
| Ishak-Fibrosestadium ± SD | 1,9 ± 1,9 | 1,9 ± 1,9 | 1,5 ± 1,3 | 4,1 ± 1,5 | 0.007 |
Mutant, T1762 und A1764; wild, A1762 und T1764. Der χ2-Test wurde für die Variablen Geschlecht, HBV-Genotyp, Precore- und Basal-Core-Promotor-Mutationen verwendet, während der Mann-Whitney-U-Test für andere Variablen verwendet wurde. AST: Aspartat-Aminotransferase. ALT: Alanin-Aminotransferase. BCP: Basaler Kernpromotor. HBV: Hepatitis-B-Virus.
HBsAg-Expressionsniveau
Abbildung 2A bis 2D zeigt die Illustration der semiquantitativen Messung der HBsAg-Expression. In dieser Studie gab es keinen Patienten mit einer HBsAg-Expression der Skala 4+. Es wurde eine reziproke Beziehung zwischen Virusreplikation und Leberhistologie beobachtet. Patienten mit einer HBsAg-Expression der Skala 2+/3+ hatten niedrigere HBsAg-Titer und HBV-DNA-Werte, aber einen deutlich höheren Nekroinflammationsgrad und Fibrosestadium als Patienten mit einer HBsAg-Expression der Skala 1+ und einer negativen HBsAg-Färbung (Abbildung 2E). Diejenigen Patienten, die einen Knodell Nekroinflammationsgrad ≥ 5 oder ein Ishake-Fibrosestadium ≥ 1 aufwiesen, hatten signifikant höhere Prozentsätze an HBsAg-Expression (Abbildung 3).
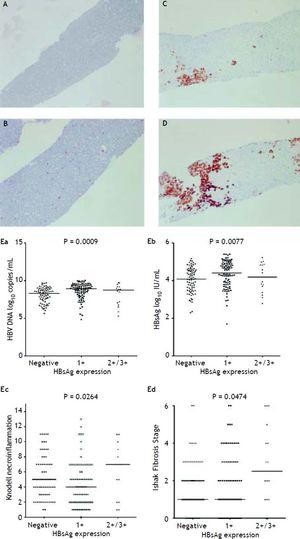
HBsAg-Expression, semiquantitativ gemessen anhand des Anteils der immunmarkierten Zellen auf einer Skala von 0 bis 3+, entsprechend der Positivität in (A) 0 % (0), (B) 1-10 % (C) 11-25 % (2+) und (D) 25-50 % (3+) der untersuchten Hepatozyten. Korrelationen des HBsAg-Expressionsniveaus mit der HBV-DNA im Serum (Ea) und dem HBsAg-Spiegel (Eb) sowie dem Nekroinflammationsgrad nach Knodell (Ec) und dem Fibrosestadium nach Ishak (Ed). Vergleiche zwischen den Gruppen wurden durch Kruskal-Wallis ANOVA analysiert.

Korrelation der Expression von intrahepatischem HBsAg mit dem Nekroinflammationsgrad nach Knodell (A) und dem Fibrosestadium nach Ishak (B). Vergleiche zwischen den Gruppen wurden mit dem Mann-Whitney-U-Test analysiert.
Klinische Merkmale der HBsAg-Expression
Zunächst untersuchten wir den Zusammenhang zwischen viralen Faktoren und HBcAg/HBsAg-Expression. Die HBsAg-Expression, nicht aber die HBcAg-Expression, war bei Vorliegen einer Precore-Mutation signifikant niedriger (P = 0,001). Patienten mit Genotyp C wiesen ein höheres Leberfibrosestadium auf (P = 0,004). Bei Patienten mit BCP T1762/A1764-Mutationen waren der Grad der Nekroinflammation und das Fibrosestadium signifikant höher und die HBcAg-Expression sowohl im Zytoplasma als auch im Zellkern niedriger. All diese Beobachtungen deuten auf eine aktive Leberschädigung hin. Außerdem wiesen Patienten mit BCP T1762/A1764-Mutationen eine höhere intrahepatische HBsAg-Expression auf (9,3 ± 8,0 % gegenüber 4,3 ± 5,0 %, P = 0,008) (Tabelle 3). Darüber hinaus untersuchten wir Faktoren, die mit der Höhe der HB-sAg-Expression zusammenhängen könnten. Tabelle 4 zeigt, dass 16 Patienten eine HBsAg-Expression der Skala 2+/3+ und 89 Patienten eine Skala 1+ aufwiesen. Eine univariate Analyse zeigte, dass eine HBsAg-Expression von 2+/3+ mit BCP T1762/A1764-Mutationen und einer schwereren Lebernekroinflammation und -fibrose verbunden war. Eine multivariate Regressionsanalyse ergab, dass die BCP T1762/A1764-Mutationen der unabhängige Faktor waren, der mit 2+/3+ Skalen der intrahepatischen HBsAg-Expression verbunden war.
Klinische, virologische und histologische Merkmale von Patienten mit oder ohne virale Mutationen.
| Vorkernmutation | P-Wert | BCP-Mutationen | P-Wert | |||
|---|---|---|---|---|---|---|
| Nein (n = 98) | Ja (n = 7) | Nein (n = 79) | Ja (n = 26) | |||
| Alter (J.) ± SD | 37.8 ±11.0 | 40.0 ± 13.7 | 0.541 | 36,0 ± 10,6 | 43,8 ±11,1 | 0,005 |
| Geschlecht (männlich/weiblich) | 70/28 | 5/2 | 1,000 | 54/25 | 21/5 | 0.318 |
| Mittlerer AST-Wert (U/L) ± SD | 60,0 ± 58,3 | 71,3 ± 30,5 | 0,072 | 51,5 ± 32,1 | 87,3 ± 95.6 | 0,007 |
| Mittlerer ALT-Wert (U/L) ±SD | 112,2 ± 143,6 | 131,6 ± 39,1 | 0,031 | 98,2 ± 77,9 | 160,0 ± 242.0 | 0.080 |
| HBV-Genotyp (B/C) | 45/53 | 3/4 | 1.000 | 44/35 | 4/22 | |
| Precore: G1896/A1896 | 6/73 | 1/25 | 0.678 | |||
| BCP:* mutant/wild | 25/73 | 1/6 | 0.678 | |||
| HBV-DNA (log Kopien/mL) | 3,9 ± 1,0 | 4,5 ± 0.5 | 0,959 | 4,5 ± 0,6 | 3,7 ± 0,6 | |
| HBsAg-Spiegel ((log IU/mL) | 8.2 ± 1,1 | 8,9 ± 0,7 | 0,892 | 8,8 ± 0,9 | 7,7 ± 1,4 | |
| Knodellnekroinflammationsgrad ± SD | 4,6 ± 3,0 | 6.1 ± 3,1 | 0,142 | 3,9 ± 2,7 | 7,2 ± 2,7 | |
| Ishak-Fibrosestadium ± SD | 1,8 ± 1,8 | 2,1 ± 0,9 | 0.286 | 1.3 ± 1.4 | 3.4 ± 1.6 | |
| HBcAg cytoplasmatische Expression (%) | 53.6 ± 25.8 | 44.3 ± 30.5 | 0.402 | 56.3 ± 25.4 | 42,7 ± 25,8 | 0,018 |
| HBcAg Kern-Expression (%) | 13,5 ± 17,3 | 17,6 ± 31,6 | 0,800 | 17,6 ± 20,0 | 2,3 ±4.1 | |
| HBsAg-Expression (%) | 5,8 ± 6,5 | 2,4 ± 1,5 | 0,274 | 4,3 ± 5,0 | 9,3 ± 8,0 | 0.003 |
Mutant, T1762 und A1764; wild, A1762 und T1764. Der χ2-Test wurde für die Variablen Geschlecht, HBV-Genotyp, Precore- und Basal-Core-Promotor-Mutationen verwendet, während der Mann-Whitney-U-Test für andere Variablen verwendet wurde. AST: Aspartat-Aminotransferase. ALT: Alanin-Aminotransferase. BCP: Basaler Kernpromotor. HBV: Hepatitis-B-Virus.
Der Zusammenhang zwischen demografischen Merkmalen und dem Grad der HBsAg-Expression.
| Univariat | Multivariat | ||||
|---|---|---|---|---|---|
| HBsAg-Expression, Skala | 1+ (n = 89) | 2+/3+ (n = 16) | P-Wert | Odds ratio (95% CI) | P-Wert |
| Alter | 38.2 ±11.2 | 36.6 ±11.1 | 0.608 | 0.963 (0.903-1.026) | 0.242 |
| Geschlecht (männlich/weiblich) | 63/26 | 12/4 | 1.000 | ||
| AST-Wert (U/L) | 55,0 ± 37,7 | 90,4 ± 113,2 | 0,234 | 1,026 (0,991∼1.063) | 0,142 |
| ALT-Spiegel (U/L) | 103,3 ± 84,4 | 170,1 ± 297,2 | 0,386 | 0,991 (0,978∼1.005) | 0.216 |
| HBV-Genotyp (B/C) | 42/47 | 6/10 | 0.589 | 0.994 (0.234∼4.231) | 0.994 |
| Precore A1896 Mutation (+/-) | 7/82 | 0/16 | 0.592 | 0.000 (0.000∼) | 0.999 |
| BCP:*Mutant/Wild | 17/72 | 9/7 | 0.003 | 6.356 (1.204∼33.356) | 0.029 |
| HBsAg-Spiegel (log10IU/mL) | 4,3 ± 0,7 | 4,2 ± 0,8 | 0,180 | 2,096 (0,598∼7,349) | 0.247 |
| Serum HBV-DNA (log10 Kopien/ml) | 8,6 ± 1,1 | 8,1 ± 1,4 | 0,135 | 0,731 (0,386∼1,383) | 0.335 |
| Knodell Nekroinflammationsgrad | 4,4 ± 2,9 | 6,3 ± 3,3 | 0,027 | ||
| Ishak Fibrose Stadium | 1.7 ± 1,6 | 2,9 ± 2,1 | 0,041 | ||
| HBcAg zytoplasmatische Expression (%) | 53.1 ± 25,8 | 52,3 ± 28,5 | 0,915 | ||
| HBcAg Kern-Expression (%) | 14,4 ± 18,3 | 10.1 ± 19,3 | 0,389 | ||
Mutant, T1762 und A1764; wild, A1762 und T1764. Univariate Analyse: Der χ2-Test wurde für die Variablen Geschlecht, HBV-Genotyp, Precore- und Basal-Core-Promotor-Mutationen verwendet, während der Mann-Whitney-U-Test für andere Variablen verwendet wurde. Multivariate Analyse: Logistische Regressionsanalyse, ausgedrückt als Odds Ratio mit 95% Konfidenzintervall und P-Werten. AST: Aspartat-Aminotransferase. ALT: Alanin-Aminotransferase. BCP: Basaler Kernpromotor. HBV: Hepatitis-B-Virus.
Diskussionen
Die intrahepatische HBsAg-Expression steht in Zusammenhang mit verschiedenen Replikationsstadien und der Krankheitsentwicklung im natürlichen Verlauf der chronischen Hepatitis B.7,10,23 Typ I GGH tritt vorwiegend im Stadium der aktiven Hepatitis auf, während Typ II GGH hauptsächlich im Stadium der inaktiven Hepatitis oder der Zirrhose auftritt.8 In dieser Studie haben wir gezeigt, dass Typ II GGH mit einer schwereren Leberhistologie einhergeht, begleitet von deutlich niedrigeren Serum-HBV-DNA-Spiegeln und HBsAg-Titern und relativ höheren Werten der intrahepatischen HBsAg-Expression. Diese wechselseitige Beziehung zwischen Leberhistologie und HBV-Replikation deutet darauf hin, dass das Auftreten von Typ II GGH ein Marker für eine fortgeschrittene Lebererkrankung während der Krankheitsentwicklung bei HBeAg-positiver chronischer Hepatitis B sein könnte. Typ II GGH enthielt durchweg Pre-S2-Deletionsmutationen, die die Synthese mittlerer Oberflächenproteine verringerten und dann zu einer Anhäufung großer Oberflächenproteine in Hepatozyten und einem Defekt der HBsAg-Sekretion führten.25 In dieser Studie haben wir eine Korrelation von Serum-HBsAg und HBV-DNA zwischen Patienten mit oder ohne Typ II GGH durchgeführt. Eine mäßige Korrelation zwischen den beiden HBV-Replikationsindikatoren zeigte sich bei Patienten ohne Typ II GGH (r = 0,686, P 26,27 Die Pre-S-Deletion könnte zu ER-Stress führen und die stressbedingte Signaltransduktion aktivieren. Die oxidative Schädigung der Hepatozyten-DNA und die Stimulierung der DNA-Reparaturmechanismen könnten zu einer genomischen Instabilität führen, die die Leberschädigung verschlimmert und für die Karzinogenese prädisponiert.28
Zusätzlich zu den Mustern der HBsAg-Expression fanden wir heraus, dass höhere Expressionsniveaus mit schwereren histologischen Aktivitäten der Leber und einer höheren Rate an BCP T1762/A1764-Mutationen einhergingen. BCP T1762/A1764-Mutationen werden stark mit schweren histologischen Leberaktivitäten und Leberkrebs in Verbindung gebracht.29,30 Unseres Wissens gibt es einen starken Zusammenhang zwischen dem Genotyp C und dem Vorhandensein von BCP T1762/A1764-Mutationen.30 In dieser Studie schien der Genotyp C keine Rolle bei der HBsAg-Expressionsmenge zu spielen. Im Gegensatz dazu zeigten BCP T1762/A1764-Mutationen einen starken Zusammenhang mit der HBsAg-Expression. Im Hinblick auf virale Mutationen können BCP T1762/A1764-Mutationen die Grundlage für andere HBV-Mutationen bilden, einschließlich der Prä-S-Deletion und komplexer Mutanten, die häufig bei Vorhandensein von BCP T1762/A1764-Mutationen auftreten. Komplexe HBV-Mutanten wiesen partielle oder vollständige Defekte bei der Expression und Sekretion von E-, Core- und Oberflächenproteinen auf.31 Die verringerte Sekretion des Hepatitis-B-Oberflächenantigens korrelierte mit einer abweichenden Lokalisierung der Oberflächenproteine im ER und führte zu einer hohen Expression von HBsAg. Darüber hinaus wird die BCP-Mutation T1762/A1764 als eine Folge der viralen Fitness betrachtet, die durch den Selektionsdruck der Immunüberwachung des Wirts bedingt ist. Ähnlich verhält es sich mit den Prä-S2-Mutationen, die in den Typ-II-GGHs beherbergt sind und mit den auf menschliche Leukozytenantigene beschränkten T- und B-Zell-Epitopen zusammenfallen.32 Um die Typ-II-GGHs herum gibt es in der Regel keine Zellnekrose oder T-Lymphozyten-Infiltration, was darauf hindeutet, dass es sich bei HBV mit dem Auftreten der Prä-S2-Deletionsmutation ebenfalls um eine möglicherweise neuartige Escape-Mutante handelt.33 Die Akkumulation von Oberflächenantigen in Hepatozyten könnte jedoch auch ohne eine der bekannten viralen Mutationen im Prä-S- oder S-Genom oder in den Oberflächenpromotoren erfolgen.31,34 Daher könnte die HBsAg-Expression eine Sequenz in Verbindung mit oder ohne virale Mutationen sein.
Diese Studie hatte mehrere potenzielle Einschränkungen. Die Beobachtungen in dieser Studie basierten auf einem retrospektiven Querschnittsdesign, aber es wurde keine longitudinale Nachbeobachtung durchgeführt. Das Expressionsniveau von HBsAg in Hepatozyten und der histologische Schweregrad können zwischen verschiedenen Teilen der Leber eines einzelnen Patienten variieren; eine Leberbiopsie an sich kann kein Lebergewebe mit Ausnahme des Biopsiekerns exakt repräsentieren.
Zusammenfassend lässt sich sagen, dass Patienten, die ein GGH-Muster vom Typ II oder ein höheres Niveau der intrahepatischen HBsAg-Expression aufwiesen, die reziproke Beziehung zwischen schwereren histologischen Aktivitäten der Leber und einer geringeren HBV-Replikationskapazität zeigten. Die starke Assoziation zwischen intrahepatischer HBsAg-Expression und BCP T1762/A1764-Mutationen deutete darauf hin, dass die HBsAg-Expression möglicherweise als histologische Manifestation während der genomischen HBV-Evolution unter dem Druck des Wirtsimmunsystems betrachtet werden könnte.
Abkürzungen
- –
BCP: basal core promoter.
- –
GGH: gemahlener Hepatozyt.
- –
HBcAg: Hepatitis B Core Antigen.
- –
HBeAg: Hepatitis B e Antigen.
- –
HBsAg: Hepatitis-B-Oberflächenantigen.
- –
HBV: Hepatitis-B-Virus.
Interessenkonflikte
T.-T. C. hat Forschungsmittel von Gilead Sciences, Bristol-Myers Squibb Company, Glaxo-SmithKline, Merck Sharp & Dohme (I.A.) Corporation und Pfizer Inc. erhalten. Für die übrigen Autoren besteht kein Interessenkonflikt.