Bei Exelead konzentrieren wir uns bei der Auftragsherstellung auf liposomale und PEGylierte Formulierungen zur Behandlung seltener Krankheiten und kleiner oder unterversorgter Bevölkerungsgruppen. Wir sind auf die Entwicklung und Herstellung von parenteralen Arzneimitteln auf Lipidbasis spezialisiert, und unser Team verfügt über mehr als 20 Jahre Erfahrung in der Zusammenarbeit mit einem breiten Spektrum von präklinischen, klinischen und kommerziellen Kunden im Bereich der Auftragsherstellung.
Was sind Liposomen und wie werden sie bei der Verabreichung von Arzneimitteln eingesetzt?
Liposomen sind spezialisierte Verabreichungsvehikel, die mehrere Funktionen erfüllen, um die Fähigkeiten von pharmazeutischen Wirkstoffen (APIs) zu verbessern. Erstens können sie ein Medikament vor der Erkennung durch das körpereigene Immunsystem schützen, indem sie biologische Membranen nachahmen und dem Medikament mehr Zeit geben, den vorgesehenen Bestimmungsort zu erreichen. Zweitens helfen sie bei der Solubilisierung stark lipophiler Wirkstoffmoleküle oder modulieren die Pharmakokinetik und Biodistribution des Wirkstoffs und tragen so dazu bei, Nebenwirkungen zu minimieren und das Sicherheitsprofil des Produkts zu verbessern.
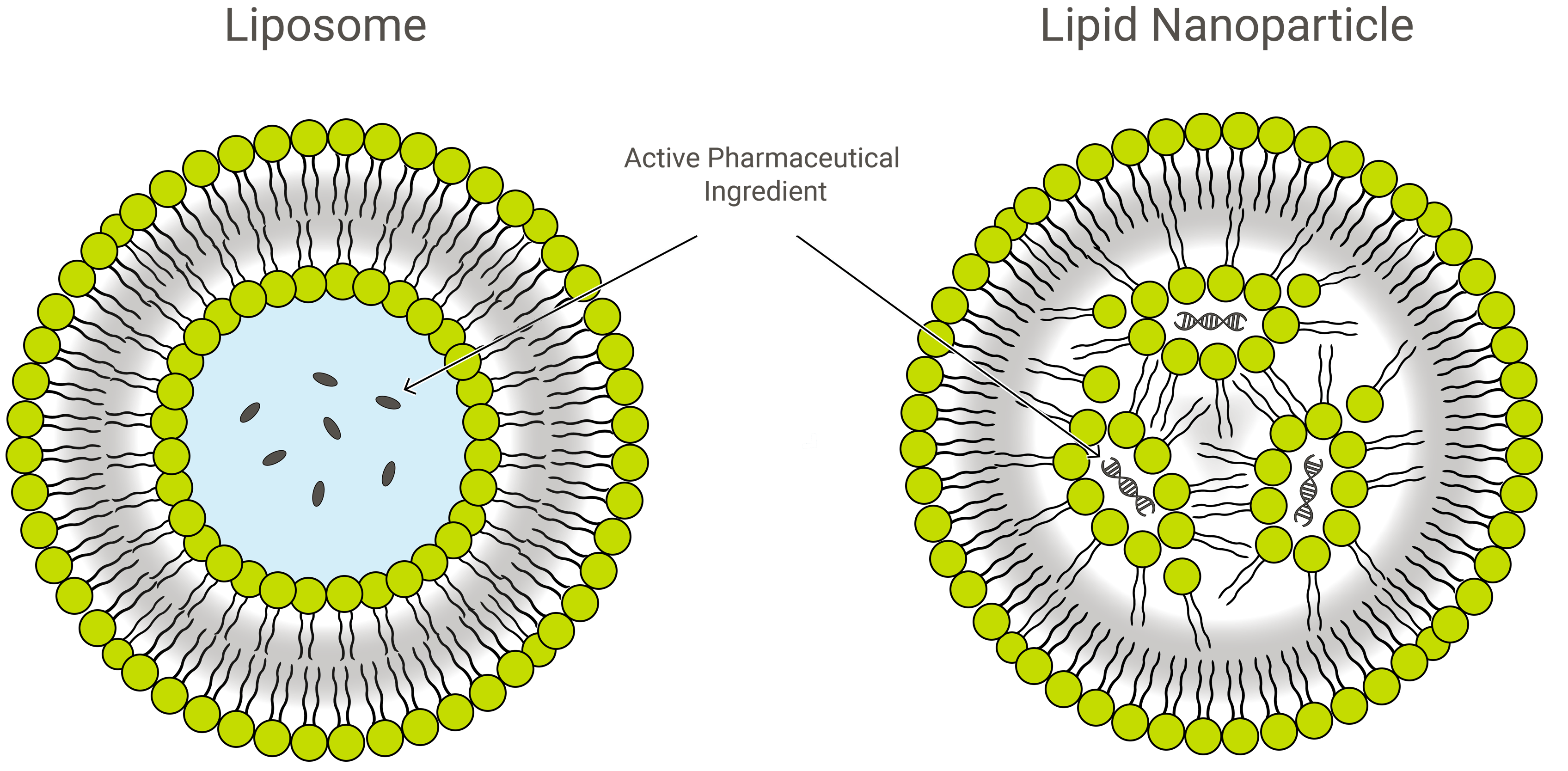
Liposomen besitzen eine einzigartige Bläschenstruktur. Diese Vesikel bestehen aus einer Lipiddoppelschicht, die sich in Form einer Hohlkugel bildet und eine wässrige Phase umschließt. Als solche kann jede Ladung von Interesse in Liposomen entweder im wässrigen Kompartiment (wenn sie wasserlöslich/hydrophil ist) oder innerhalb der Lipiddoppelschicht (wenn sie fettlöslich/lipophil ist) eingekapselt werden.
Einige der primären Lipide, die zur Herstellung von Liposomen verwendet werden, sind Phospholipide und Sphingolipide. Diese beiden Lipidkategorien zeichnen sich dadurch aus, dass sie eine wasserliebende/hydrophile Kopfgruppe und eine wasserabweisende/lipophile Schwanzgruppe haben. Aufgrund ihres amphiphilen Charakters ordnen sich diese Moleküle spontan zu Liposomen und anderen einzigartigen 3D-Strukturen an, wenn sie zu wässrigen Lösungen hinzugefügt werden. Die Form oder Morphologie der 3D-Strukturen hängt von einer Vielzahl verschiedener Faktoren ab – beispielsweise von der Lipidzusammensetzung, der Temperatur, dem pH-Wert oder dem Vorhandensein anderer Puffer, Salze und Zucker im Wasser.

Bildquelle: Chem Libre Texts
Wie interagiert ein Medikament mit dem Körper und wird für die Anwendung verfügbar, wenn es als liposomales Medikament formuliert ist?
In den letzten Jahren haben Liposomen als eine zuverlässige Klasse von Medikamentenverabreichungsvehikeln große Aufmerksamkeit erregt. Ihre selbstschließenden Strukturen können mehrere Arzneimittel auf einmal einkapseln und die eingeschlossene Fracht vor Hydrolyse und Abbau schützen. Darüber hinaus können Targeting-Proteine und oberflächenfunktionale Liganden auf der äußeren Hülle der Lipiddoppelschicht neue Funktionen hinzufügen, die ein gezieltes Eindringen von Liposomen in Zellen ermöglichen, entweder über Antikörper oder rezeptorgesteuerte Liganden. Diese Liganden binden an Zellrezeptoren, die in bestimmten kranken Zellen überexprimiert sind, und ermöglichen so den Eintritt des Medikaments durch die Zellmembran.
„Liposomen schützen beladene Medikamentenmoleküle vor externem Abbau, und ihre Ähnlichkeit mit biologischen Membranen bietet einzigartige Möglichkeiten, Medikamentenmoleküle in Zellen oder subzelluläre Kompartimente einzubringen … Darüber hinaus können verschiedene physikalisch-chemische Eigenschaften von Liposomen – einschließlich ihrer Größe, Ladung und der funktionellen Liganden an der Oberfläche – verändert werden, was zu Funktionalitäten führt, die bestimmte Aufgaben der Arzneimittelabgabe begünstigen. Diese Vorteile haben Liposomen zu einer führenden Plattform für die Verabreichung von Arzneimitteln gemacht, die in der Klinik vielseitig eingesetzt werden kann.“
– Liposomenähnliche Nanostrukturen für die Verabreichung von Arzneimitteln | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Typischerweise werden Liposomen als sterile Injektionsmittel für die Verabreichung in den Blutkreislauf hergestellt, und die Freisetzung des Arzneimittels erfolgt, wenn die Lipidhüllen zerfallen – was in extrazellulärer oder intrazellulärer Umgebung geschehen kann.
Es wurden verschiedene Strategien angewandt, um herkömmliche Liposomen mit der Fähigkeit zur getriggerten Freisetzung zu entwickeln, um die therapeutische Wirksamkeit zu erhöhen, indem die Liposomen veranlasst werden, den eingekapselten Wirkstoff oder die „Fracht“ auf der Grundlage einer Stimulusreaktion freizusetzen. Diese Freisetzung wird entweder durch den konventionellen Abbau der Liposomen oder durch aktive Stimuli und Umweltreize wie thermische Energie, pH-Gradient und Scherspannung ausgelöst.1
Formulierungen, die für die Freisetzung in intrazellulären Umgebungen ausgelegt sind, können pH-sensitive Lipide enthalten, die die liposomale Struktur verändern oder sich in sauren Kompartimenten abbauen und so die Freisetzung des eingekapselten Wirkstoffs ermöglichen. Alternativ werden manchmal thermo- oder lichtempfindliche Komponenten hinzugefügt, um den Abbau und die Strukturmodulation aufgrund von Temperaturänderungen oder Reaktion auf Licht bestimmter Wellenlängen zu ermöglichen.
Liposomenähnliche Arzneimittelträger gibt es in vielen verschiedenen Varianten, die ein breites Spektrum an biochemischen und biophysikalischen Eigenschaften aufweisen. Dies ist zwar vorteilhaft und ermöglicht diesen lipidbasierten Partikeln nützliche Anwendungen in Hunderten von verschiedenen Bereichen, doch die Anzahl der möglichen Variationen macht eine strenge Herstellungskontrolle unabdingbar.2
Exelead stellt seit Anfang der 1990er Jahre lipidbasierte Arzneimittel her, angefangen mit Abelcet. Amphotericin B, der Wirkstoff in Abelcet, befindet sich in einem Lipidkomplex und verschmilzt selektiv mit den Pilzmembranen, um auf die Krankheitszellen zu wirken.
Liposomen vs. Lipid-Nanopartikel
Liposomen und Lipid-Nanopartikel (LNPs) sind vom Design her ähnlich, unterscheiden sich aber leicht in ihrer Zusammensetzung und Funktion. Bei beiden handelt es sich um Lipid-Nanoformulierungen, die sich hervorragend für die Verabreichung von Arzneimitteln eignen, da sie die betreffende Ladung in einer schützenden Außenschicht aus Lipiden transportieren. In der Anwendung können LNPs jedoch eine Vielzahl von Formen annehmen.
LNPs sind liposomenähnliche Strukturen, die besonders für die Verkapselung einer Vielzahl von Nukleinsäuren (RNA und DNA) geeignet sind; als solche sind sie das beliebteste nicht-virale Gentransportsystem. Exelead entwickelt und produziert LNPs zur Verkapselung verschiedener Arten von genetischen Nutzlasten, einschließlich siRNA, mRNA und saRNA.
Traditionelle Liposomen umfassen einen oder mehrere Ringe aus einer Lipiddoppelschicht, die eine wässrige Tasche umgibt, aber nicht alle LNPs haben eine zusammenhängende Doppelschicht, die sie als Lipidvesikel oder Liposomen qualifizieren würde. Einige LNPs weisen eine mizellenartige Struktur auf und verkapseln Arzneimittelmoleküle in einem nichtwässrigen Kern.
PEGylierung von LNPs und liposomähnlichen Strukturen für die Verabreichung von Arzneimitteln
LNPs bestehen in erster Linie aus kationischen Lipiden (siehe Gentherapie unten) zusammen mit anderen Lipidbestandteilen. Dazu gehören in der Regel neutrale Phospholipidmoleküle, die zur Klasse der Phosphatidylcholine (PC) gehören, und Sterole, wie Cholesterin. Ein weiterer gängiger Lipidbestandteil ist ein so genanntes PEGyliertes Phospholipid – ein Polyethylenglykol (PEG)-Polymer, das kovalent an die Kopfgruppe eines Phospholipids gebunden ist.

PEGylierte Phospholipide werden in vielen lipidbasierten Arzneimittelträgern vor allem deshalb verwendet, weil sie einen so genannten Stealth-Effekt für das Arzneimittel bieten, wenn es im Körper zirkuliert. Das menschliche Immunsystem ist bestrebt, den Körper vor jedem fremden Objekt zu schützen, und medizinische Nanopartikel bilden da keine Ausnahme. Um die Effizienz der Verabreichung zu erhöhen und den Molekülen mehr Zeit für die Zirkulation zu geben, damit sie die vorgesehenen Krankheitsherde erreichen, wird PEG hinzugefügt, um diese Nanopartikel abzuschirmen, indem verhindert wird, dass Blutplasmaproteine von der Liposomenoberfläche absorbiert werden, wodurch die Lebensdauer der Zirkulation im Blutkreislauf verlängert wird.1
Der zweite Vorteil der PEGylierung ist eine Erhöhung der Stabilität von liposomenähnlichen Nanostrukturen. Herkömmliche Liposomen, insbesondere solche mit einer Größe von weniger als 200 nm, können von sich aus instabil sein und neigen dazu, miteinander zu verschmelzen, um die Oberflächenspannung zu verringern. Dies kann zu einem Verlust des eingekapselten Arzneimittels oder zu einer ungünstigen Vermischung der Ladung verschiedener Vesikel führen. Die Hersteller von Arzneimitteln haben gelernt, dieses Problem zu überwinden, indem sie das Äußere der Liposomen mit Polymeren wie PEG überziehen.
Diese mit Tarnkappen ausgestatteten Nanopartikel haben zu einer neuen Generation von Liposomenformulierungen und mehreren klinisch zugelassenen Produkten geführt. PEGylierte Liposomen und LNPs sind derzeit das neue Paradigma für die meisten Krebstherapeutika.
LNPs in der Gentherapie
Lange Zeit bestand die wirksamste Methode zur Verabreichung von genbasierten Therapeutika an menschliche Zellen darin, ein Virus zu verwenden, das so modifiziert worden war, dass es die medizinische Fracht und nicht die schädlichen, sich selbst replizierenden Gene trug. Diese Methode wird auch heute noch gelegentlich angewandt und wird als viraler Gentransfer bezeichnet. In den letzten 20 Jahren hat sich jedoch die nicht-virale Genübertragung aufgrund des besseren Sicherheitsprofils, der geringeren Rate an unerwünschten immunogenen Reaktionen und der einfachen Herstellung durchgesetzt. Eine der wichtigsten Triebkräfte dieser Bewegung war die Entwicklung von Trägern auf Lipid- und Polymerbasis, von denen LNPs die beliebtesten sind.
LNPs, die zur Übertragung von Genen verwendet werden, werden in erster Linie aus kationischen oder positiv geladenen Lipiden synthetisiert, die sich mit anionischen oder negativ geladenen Nukleinsäuren verbinden. Es können auch andere Komponenten auf Lipidbasis hinzugefügt werden, um die Effizienz der Freisetzung und den Ort der Freisetzung der genetischen Fracht zu beeinflussen. LNPs bieten auch mechanische Stabilität, eine kontrollierte Morphologie und eine enge Größenverteilung.1
Anorganische Materialien, organische Materialien und Hydrogele wurden als Kerne für liposomale Nanopartikel erforscht, die in einer unterschiedlichen Anzahl von Lipidschichten verkapselt sind, die die Hülle bilden. Eine der erfolgreichsten Varianten dieser hybriden Nanopartikel enthält PLA- oder PGLA-Polymere innerhalb einer Lipid-Monolage. Diese beiden Kern-Biopolymere sind besonders nützlich für die Verabreichung von Arzneimitteln, da sie eine kontrollierte Wirkstofffreisetzung ermöglichen.1

Die oben gezeigte Nanopartikelformulierung ist ein Lipid-Polymer-Hybrid mit einem hydrophoben PGLA-Kern und einer hydrophilen Lipid-PEG-Hülle.
Ein expandierendes Feld
„Liposomen haben einen weiten Weg zurückgelegt, um eine Klasse validierter Arzneimittelträger zu werden … Eine zunehmende Vielfalt liposomenähnlicher Nanostrukturen befindet sich in der Entwicklung, jede mit einzigartigen Stärken, die sich für spezifische Arzneimittelabgabeaufgaben eignen. Gleichzeitig macht das Verständnis der Wechselwirkungen zwischen diesen Nanostrukturen und biologischen Systemen rasche Fortschritte. Es wurden bereits zahlreiche Informationen über ihre Zirkulationszeit, Gewebeakkumulation und potenzielle Toxizität gewonnen. Es ist sicher, dass liposomenähnliche Nanocarrier in absehbarer Zukunft eine größere Rolle bei der Verabreichung von Arzneimitteln spielen werden.“
– Liposomenähnliche Nanostrukturen für die Verabreichung von Arzneimitteln | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Während die Entwicklung von Arzneimitteln mit kontrollierter Freisetzung und Nanokompartimentierung noch in vollem Gange ist, sind Liposomen und LNPs besonders vielversprechende Optionen. Diese Strukturen bieten eine einzigartige, von Natur aus stabile, zellähnliche Morphologie für Nanomedikamente und sind auf dem Weg zu fortschrittlicheren therapeutischen Strategien. Exelead stellt sich diesen Herausforderungen, einschließlich der Entwicklung von Nanogelen, die eine Reihe von Biologika und kleinen Molekülen enthalten.
Seitdem Liposomen in den späten 1960er Jahren erstmals als System zur Verabreichung von Arzneimitteln vorgeschlagen wurden, haben sich Variationen in Struktur und Funktionalität herausgebildet, die wertvolle Fortschritte in Bezug auf die gezielte Behandlung von Krankheiten ermöglichen. LNP-Arzneimittel sind in der gesamten pharmazeutischen Industrie als Therapien zur Verabreichung von Krebsmedikamenten, Antibiotika, Genmedikamenten, Anästhetika und entzündungshemmenden Medikamenten aufgetaucht.3
„In klinischen Anwendungen haben sich liposomale Arzneimittel als besonders nützlich erwiesen, da sie sich an Stellen mit erhöhter Gefäßdurchlässigkeit „passiv“ anreichern können, wenn ihr durchschnittlicher Durchmesser im ultrafiltrierbaren Bereich liegt (<200 nm Durchmesser), und da sie die Nebenwirkungen der eingekapselten Arzneimittel im Vergleich zu freien Arzneimitteln verringern können. Dies hat zu einer allgemeinen Erhöhung des therapeutischen Indexes geführt, der die Wirksamkeit gegenüber der Toxizität misst.“
– Liposomale Arzneimittelabgabesysteme: vom Konzept bis zur klinischen Anwendung | Allen TM, Cullis PR 3
Anwendungen in der personalisierten Medizin – eine neue Ära der therapeutischen Strategien
Im Gegensatz zu den traditionellen Big-Pharma-Ansätzen zur Behandlung von Krankheiten berücksichtigt die personalisierte Medizin individuelle Unterschiede in Lebensstil, Umwelt und Biologie – einschließlich der Genetik eines Patienten.
Dies ist bei Krankheiten wie Krebs besonders wichtig. Selbst innerhalb einer einzigen Krebsart unterscheiden sich die Tumortypen von Patient zu Patient, und das Wissen um die spezielle genetische Mutation, die ein Patient entwickelt hat, ermöglicht es den Ärzten, spezifischere und präzisere Behandlungen einzusetzen.4
Mit dem Aufkommen personalisierter Gentherapien können Ärzte und Wissenschaftler einen pharmazeutischen Wirkstoff – oft RNA oder DNA – wirksam auf das spezifische Krankheitsprofil eines bestimmten Patienten oder einer kleinen Gruppe von Patienten zuschneiden. Dieser Ansatz für eine hyper-spezifische Ausrichtung auf Krankheiten erhöht die Wirksamkeit und verringert unerwünschte Nebenwirkungen für Gruppen ähnlicher Patienten.
LNPs als Träger für Oligonukleotide
Da sich ein Großteil des wachsenden Feldes der personalisierten Medizin auf Gentherapien konzentriert, sind LNPs als Plattform für die Verabreichung von Medikamenten besonders nützlich geworden. Theoretisch könnte jedes Oligonukleotid in einem Liposom oder LNP eingekapselt werden, aber siRNA sind derzeit die häufigste Ladung in dieser Art von Arzneimitteln.
Theoretisch können siRNA-Segmente so gestaltet werden, dass sie jedes beliebige Gen zum Schweigen bringen, was sowohl für Ärzte als auch für Forscher ein spannendes Konzept ist. Leider ist es schwierig, freie, unverkapselte RNA in menschliche Zellen einzubringen, da sie groß, im Serum instabil und anfällig für den Abbau durch Nuklease sind.5
Zwar haben Forscher versucht, siRNA im Serum durch Hinzufügen von Phosphorothioat-Bindungen zu stabilisieren, doch sind hohe Dosen erforderlich, um Gene beim Menschen wirksam auszuschalten. LNPs bieten eine Lösung für dieses Problem, indem sie flexible und einfache Mittel zur Verkapselung bereitstellen, die die siRNA-Segmente schützen, bis sie ihren Bestimmungsort erreichen, und ihre Verabreichung in die Zielzellen erleichtern.5
„LNPs, die ionisierbare kationische Lipide enthalten, haben eine Reihe von Eigenschaften, die für die systemische Verabreichung von Polynukleinsäuren erforderlich sind, einschließlich kleiner Größen, Serumstabilität, niedriger Oberflächen-Zetapotenziale bei physiologischem pH-Wert und kationischer Ladung bei sauren pH-Werten (z. B. in Endosomen). Durch die Ausnutzung endogener“ Targeting-Prozesse aufgrund der Assoziation mit ApoE nach der Verabreichung kann außerdem eine hocheffiziente Aufnahme in Hepatozyten nach i.v.-Verabreichung erreicht werden, was zu hervorragenden Gen-Silencing-Möglichkeiten führt.“
– Lipid-Nanopartikel-Abgabesysteme für Therapeutika auf siRNA-Basis | Wan C, Allen TM, Cullis PR 5
Kleine Chargengrößen
Personalisierte Arzneimittel werden oft in kleinen Chargengrößen für einzelne Patienten oder kleine Populationen hergestellt und ergeben häufig weniger als einen Liter des Produkts. Im Gegensatz dazu werden bei der herkömmlichen Herstellung von Pharmazeutika oft Tausende von Litern eines Arzneimittels in großen Mengen produziert. Die personalisierte Medizin erfordert einen einzigartigen Ansatz, und jede Charge muss unter strengen cGMP-Bedingungen hergestellt werden.
Da die personalisierte Medizin zu einem wichtigen Schwerpunkt in der Arzneimittelentwicklung geworden ist, haben viele Unternehmen in der pharmazeutischen Fertigungsindustrie ihre Pipelines angepasst, um neben der herkömmlichen Arzneimittelproduktion im großen Maßstab auch kleinere Chargen für kleine Patientengruppen herzustellen.
Bei Exelead wurden umfangreiche Anstrengungen unternommen, um diese Therapeutika in kleinen Chargen herzustellen, die oft teure Wirkstoffe und eine kurze Durchlaufzeit erfordern. Bei patienten- oder antigenspezifischen Medikamenten bleibt nicht viel Zeit von der Sequenzierung des Oligonukleotids bis zur Formulierung des Produkts an unserem Standort. Diese kurzfristigen Vorhersagen, die manchmal nur sechs Wochen betragen, stellen eine Herausforderung dar, die wir durch die Verfeinerung unserer bestehenden Systeme und die Einbeziehung innovativer Formulierungstechniken bewältigen konnten.
Verbreitete Anwendungen
Während die personalisierte Medizin das Potenzial hat, fast jede Krankheit zu behandeln, hat sich die derzeitige Forschung vor allem auf 1) Immuntherapien, 2) konventionelle Therapien, die durch Pharmakogenomik ergänzt werden, und 3) biomarkerbezogene Krebsbehandlungen konzentriert. Liposomen und LNPs können als Träger für jede dieser Kategorien von Arzneimitteln eingesetzt werden, was sie zu einem unverzichtbaren Faktor in diesem neuen Bereich der pharmazeutischen Entwicklung macht.

Referenzartikel
- Gao W, Hu C-MJ, Fang RH, Zhang L. Liposome-like Nanostructures for Drug Delivery. Journal of materials chemistry B, Materials for biology and medicine. 2013;1(48):10.1039/C3TB21238F. doi:10.1039/C3TB21238F.
- Kraft JC, Freeling JP, Wang Z, Ho RJY. Emerging Research and Clinical Development Trends of Liposome and Lipid Nanoparticle Drug Delivery Systems. Journal of pharmaceutical sciences. 2014;103(1):29-52. doi:10.1002/jps.23773.
- Theresa M. Allen, Pieter R. Cullis. Liposomal drug delivery systems: From concept to clinical applications. Advanced Drug Delivery Reviews. 2013 Jan;65(1):36-48
- Esposito L. What Does Personalized Medicine Really Mean? US News: Health Care. 2018 Jan;
- Wan C, Allen TM, Cullis PR. Lipid nanoparticle delivery systems for siRNA-based therapeutics. Drug Deliv Transl Res. 2014 Feb;4(1):74-83. doi: 10.1007/s13346-013-0161-z.
- Vogenberg FR, Isaacson Barash C, Pursel M. Personalized Medicine: Teil 1: Evolution und Entwicklung zur Theranostik. Pharmacy and Therapeutics. 2010;35(10):560-576.