US Pharm. 2012;37(5):HS-2-HS-7.
Schmerzen sind der häufigste Grund dafür, dass Menschen einen Arzt aufsuchen.1 Eine aktuelle Studie schätzt, dass Schmerzen mehrere Millionen Amerikaner betreffen und die Vereinigten Staaten jährlich 635 Milliarden US-Dollar kosten, da sie zu einem erhöhten Verbrauch an medizinischer Versorgung und indirekten Kosten durch versäumte Arbeitstage und Produktivitätsverlust führen.2 Die Behandlung chronischer Schmerzen mit Medikamenten wie Opioiden ist eine gängige Strategie, aber chronische Schmerzen können trotz aggressiver Opioidtherapie anhalten oder sich verschlimmern. In diesem Artikel soll das Phänomen der Opioide beleuchtet werden, die zur Behandlung von Schmerzen verschrieben werden, aber neue oder paradoxerweise zunehmende Schmerzen verursachen, was als opioidinduzierte Hyperalgesie (OIH) bezeichnet wird. OIH kann formell als erhöhte nozizeptive Sensibilisierung definiert werden, die durch die Exposition gegenüber Opioiden verursacht wird.3 OIH unterscheidet sich deutlich von Toleranz, Sucht, Abhängigkeit und Krankheitsprogression. Die klinische Prävalenz von OIH ist nicht bekannt.4
Diagnose und Präsentation
Eines der Hauptprobleme bei der korrekten Diagnose von OIH ist die große Ähnlichkeit der Erkrankung mit der Opioidtoleranz. Toleranz und OIH haben das Merkmal einer verminderten analgetischen Reaktion auf die Opioiddosis gemeinsam, und wahrscheinlich beruhen sie auf denselben zellulären Mechanismen.5 Die Toleranz kann durch eine Erhöhung der Opioiddosis überwunden werden, während die gleiche Erhöhung bei einem Patienten mit OIH zu einer Verschlimmerung der Schmerzen führt.4 Darüber hinaus entwickelt sich die Toleranz in der Regel langsam im Laufe der Zeit, während die Zunahme der Schmerzen infolge der Opioidbehandlung bei einem OIH-Patienten relativ schnell eintritt. Oft unterscheidet sich OIH von Toleranz dadurch, dass die Schmerzintensität stärker ist als ursprünglich angegeben.6
Unterbehandelte Schmerzen sind eine weitere Möglichkeit, die ausgeschlossen werden sollte. Wenn die Opioidtherapie suboptimal ist, sollte eine Erhöhung der Dosis zu einer Schmerzlinderung führen; bei Vorliegen einer OIH sollte das Gegenteil der Fall sein. Für eine korrekte Diagnose von OIH müssen die Schmerzen verschwinden, sobald die Behandlung mit dem betreffenden Opioid abgesetzt wird.6 Erschwerend kommt hinzu, dass die Hyperalgesie infolge eines Opioidentzugs ein gut dokumentiertes Phänomen ist.7 Daher erfolgt die Schmerzlinderung nach Absetzen des Opioids bei OIH nicht sofort und erfordert Geduld. Dies stellt sowohl für den Arzt als auch für den Patienten eine Herausforderung dar.
OIH weist in der Regel noch weitere Merkmale auf (TABELLE 1): Schmerzen, die mit OIH assoziiert sind, sind in der Regel diffuser und von geringerer Qualität, und schädliche Reize sind in der Regel schmerzhafter als normalerweise zu erwarten wäre. Bei OIH treten die Schmerzen häufig in Bereichen auf, die über den Bereich der Verletzung oder des Gewebeschadens hinausgehen. Der Schmerz kann bei OIH trotz Beseitigung der ursprünglichen Schmerzquelle oder Heilung des geschädigten Gewebes anhalten. Bei OIH kann der Schmerz mit fortschreitender Opioidbehandlung den Eindruck erwecken, schlimmer zu werden als ursprünglich angegeben, obwohl Zeit, Ruhe und andere Maßnahmen normalerweise ein klinisch relevantes Maß an Heilung ermöglichen würden.5 Darüber hinaus wurde in einer Reihe von Human- und Tierstudien zu OIH Allodynie nachgewiesen.8

Etiologie
Es gibt eine Reihe von Theorien zur Ursache von OIH. Die Theorie, die am meisten erforscht wurde und derzeit die meiste Aufmerksamkeit erhält, ist das neuroexzitatorische Modell. Es wird angenommen, dass bestimmte Opioide und ihre Metaboliten den N-Methyl-D-Aspartat(NMDA)-Rezeptor agonisieren. Die Aktivierung des NMDA-Rezeptors führt zu einem Einstrom von Calcium, der die Erregbarkeit des Neurons stark erhöht. Wenn der NMDA-Rezeptor und die entsprechenden Neuronen aktiver sind, können sie schmerzhafte Impulse, die durch zirkulierende Substanzen oder andere schädliche Reize ausgelöst werden, besser weiterleiten. Glutamat ist der primäre endogene Agonist des NDMA-Rezeptors.9
Diese Theorie der Pronozizeption, die durch die Aktivierung des NMDA-Rezeptors moduliert wird, wird durch Studien gestützt, die eine Linderung der OIH nach der Verabreichung vonNMDA-Rezeptorantagonisten zeigen. Diese Antagonisten binden nichtkompetitiv an die Phencyclidin-Stelle des NMDA-Kanals und blockieren den Kalziumeinstrom, der auftreten würde, wenn der Rezeptor Glutamat oder einen anderen Antagonisten bindet.10 Tier- und Humanstudien haben gezeigt, dass Probanden mit OIH, denen Ketamin, ein NMDA-Rezeptorantagonist, verabreicht wurde, bei kontrollierten Schmerzreiztests besser abschnitten. In einer Studie wurden Ratten mehrere Tage lang intrathekale Morphininjektionen verabreicht, bis sie eine hitzeempfindliche OIH zeigten. Die Verabreichung von Dizocilpin, einem NMDA-Hemmer, konnte die thermische Hyperalgesie zumindest teilweise aufheben.5 Andere NMDA-Rezeptorantagonisten, wie z.B. Dextromethorphan, haben einige Beweise für die Linderung hyperalgetischer Zustände durch Hemmung des NMDA-Rezeptors erbracht.
Opioide, wie Codein, Hydromorphon und Morphin, durchlaufen im Rahmen des normalen Stoffwechselprozesses eine Reihe von Biotransformationen.Codein wird durch das CYP2D6-Enzym zu Morphin metabolisiert. Morphin wird in eine Reihe von Molekülen umgewandelt, aber es wird hauptsächlich durch Glucuronidierung zu Morphin-3-Glucuronid (M3G) und in geringerem Maße zu Morphin-6-Glucuronid (M6G) metabolisiert (ABBILDUNG 1).11
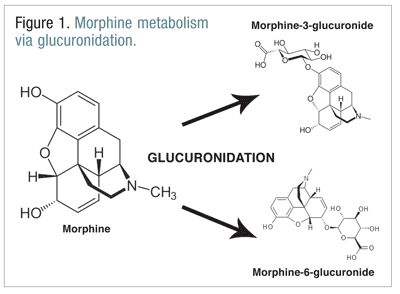
M6G ist ein therapeutisch wichtiger Metabolit. Er hat eine ähnliche Bindungsaffinität zum Mu-Rezeptor wie Morphin und kann Analgesie, Atemdepression und andere Wirkungen hervorrufen, die denen von Morphin ähneln. M3G ist jedoch kein Agonist am mu-Rezeptor, und seine Affinität zum mu-Rezeptor ist im Vergleich zu Morphin gering. Im Gegensatz zu Morphin, M6G und anderen Opioiden ist M3G ein NMDA-Agonist. Durch Glucuronidierung wird M3G etwa sechsmal schneller umgewandelt als M6G.12 Auch anderen Opioiden wird eine NMDA-Agonisten-Aktivität und paradoxe neuroexzitatorische Wirkung zugeschrieben.6
Die Theorie, dass OIH durch die Aktivität von Rezeptoren neben dem mu-Opioidrezeptor verursacht wird, wird durch den Nachweis gestützt, dass OIH durch die Verabreichung eines Opioidantagonisten (z. B. Naloxon) nicht gelindert wird. Bei Patienten, die während einer hochdosierten Opioidtherapie unter OIH litten, führte die Verabreichung von Naloxon zu einer Verschlimmerung der Schmerzen.13 Indem es das Opioid vom mu-Rezeptor verdrängte, verhinderte Naloxon, dass das Opioid die Analgesie bewirkte, die durch die Aktivierung des mu-Rezeptors möglich war, während gleichzeitig die Hyperalgesie unangefochten blieb.14
Dynorphin könnte ebenfalls an der Entstehung von OIH beteiligt sein.15Dynorphin ist ein endogenes Opioidpeptid, das in erster Linie an den Kappa-Opioidrezeptor und in geringerem Maße an den Mu-Opioid- und NMDA-Rezeptor bindet. Es wird vermutet, dass der Agonismus von Dynorphin am Kappa-Opioidrezeptor und am NMDA-Rezeptor eine Rolle bei der Pronozizeption von OIH spielt, obwohl reine Mu-Rezeptor-Agonisten vorhanden sind. Studien haben gezeigt, dass die Umkehrung von Dynorphin die analgetische Wirkung von Morphin wiederherstellen kann, wenn die Probanden ein Dynorphin-Antiserum erhalten. Außerdem ist bekannt, dass Dynorphin bei längerer Opioidverabreichung ansteigt. Dynorphin bewirkt auch die Freisetzung exzitatorischer Neuropeptide an verschiedenen Stellen des zentralen Nervensystems.
Behandlungsmöglichkeiten
Wenn die Diagnose OIH gestellt wurde, gibt es eine Reihe von Behandlungsmöglichkeiten, aus denen sorgfältig ausgewählt werden muss. Unter der Voraussetzung, dass die anfängliche schmerzhafte Verletzung oder Gewebeschädigung abgeklungen ist und die Schmerzen trotz – oder gerade wegen – der Opioidbehandlung weiter bestehen, besteht der direkteste Ansatz darin, das Opioid abzusetzen. Dies sollte schrittweise erfolgen, um nachteilige Entzugserscheinungen zu minimieren. Es ist zu beachten, dass sich die Hyperalgesie zu Beginn des Absetzprozesses wahrscheinlich verschlimmern wird.16 Dies stellt eine schwierige ethische Situation dar, in der es dem Arzt schwer fallen kann, den Patienten davon zu überzeugen, dass die zur Schmerzbehandlung verschriebenen Medikamente die Schmerzen möglicherweise verursacht oder verschlimmert haben und dass sich die Schmerzen noch verschlimmern können, bevor sie schließlich verschwinden.17
Wenn berechtigte Schmerzen fortbestehen und ein gewisses Maß an Analgesie mit Opioiden erforderlich ist, sollten andere Strategien als das vollständige Absetzen der Opioide geprüft werden. Patienten, die von OIH betroffen sind, können durch eine Verringerung der Opioiddosis Erleichterung erlangen.4 Es gibt Berichte über Patienten, die bei einer Verringerung der Opioiddosis ein akzeptables Gleichgewicht zwischen Analgesie und Linderung der Hyperalgesie finden.
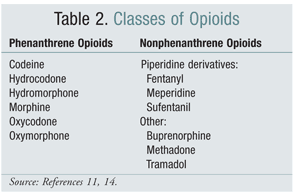
Der Wechsel von einer Strukturklasse von Opioiden zu einer anderen hat sich in einigen Studien als wirksame Option zur Linderung von OIH erwiesen. Bisherige Studien haben gezeigt, dass OIH stärker mit Opioiden aus der Phenanthren-Klasse assoziiert ist (TABELLE 2).4 Die Titration des Phenanthren-Opioids und die Umstellung auf ein anderes Opioid kann zur Behebung von OIH führen. Codein, Hydromorphon, Morphin und strukturell ähnliche Opioide unterliegen im Rahmen ihres Metabolismus einer Glucuronidierung. Die Vermeidung eines denNMDA -Rezeptor aktivierenden Glucuronid-Metaboliten ist möglich, indem man auf ein Opioid umsteigt, das strukturell einzigartig ist, wie z. B. Fentanyl. Zum Zeitpunkt der Erstellung dieses Berichts wurde OIH in Studien mit Oxymorphon nicht nachgewiesen.4
Die Ergänzung der Opioidtherapie mit einem Cyclooxygenase-2 (COX-2)-Hemmer ist eine weitere Strategie, die eine gewisse Unterstützung erfährt. Durch die Verringerung der Prostaglandinsynthese können COX-2-Hemmer die Sensibilisierung der pronezizeptiven Neuronen verringern. Nichtsteroidale Antirheumatika (NSAIDs) und COX-2-Hemmer scheinen unabhängig von ihrer Fähigkeit, die Prostaglandinsynthese peripher zu unterdrücken, analgetische Wirkungen zu haben.9 COX-2-Hemmer haben auch die Fähigkeit gezeigt, den NMDA-Rezeptor zu antagonisieren. Zentral sind NSAIDs in der Lage, den NMDA-Rezeptor durch Blockierung von Glutamat, Substanz P und anderen erregenden Aminosäuren zu antagonisieren. Unabhängig davon kann die Aktivierung des NMDA-Rezeptors die COX-2-Expression hochregulieren.18
In Anbetracht der Aufmerksamkeit, die dem NMDA-Rezeptor wegen seiner Rolle bei der OIH zuteil wurde, scheint die Antagonisierung dieses Rezeptors eine vernünftige Behandlungsstrategie zu sein. Ketamin wurde viel erforscht, hat jedoch mitunter schwerwiegende unerwünschte Wirkungen. Ketamin antagonisiert zwar den NMDA-Rezeptor und hat eine anästhetische Wirkung, die eine Analgesie begünstigen würde, doch sind die Nebenwirkungen häufig, vielfältig und schwerwiegend.19 Zu diesen Wirkungen gehören Tachyarrhythmie, Bluthochdruck, kognitive Beeinträchtigungen und psychomimetische Reaktionen, einschließlich Stimmungsschwankungen, lebhafte Träume, Delirium, Halluzinationen und Sedierung. Ketamin ist wirksam bei der Umkehrung von Hyperalgesie und der Verstärkung der Wirkung von Opioiden bei Patienten, die hohe Dosen erhalten, aber seine unerwünschten Wirkungen verhindern, dass es eine brauchbare Behandlungsoption ist.
Dextromethorphan ist ein weiterer NMDA-Rezeptor-Antagonist, der für die Behandlung von OIH untersucht wurde. Ein Kombinationspräparat, das eine 1:1-Mischung aus Morphin und Dextromethorphan enthält, wurde untersucht.20 In den Studien konnte nicht nachgewiesen werden, dass die Kombinationstherapie im Vergleich zu Morphin allein eine bessere Analgesie erzielen kann. In einer Studie, in der eine 2:1-Mischung derselben Wirkstoffe verwendet wurde, kam es zu einem ähnlichen Therapieversagen. Die Studien wurden kritisiert, weil die Dextromethorphan-Menge nicht ausreichte, um den NMDA-Rezeptor adäquat zu antagonisieren.21Unbekannt bleibt die Dosis von Dextromethorphan, die erforderlich ist, um entweder die Analgesie eines Opioids zu verstärken oder die durch die NMDA-Rezeptoraktivierung verursachte OIH zu verhindern.
Methadon ist ein Opioid mit einzigartigen Eigenschaften, die es zu einer überzeugenden Option für die Schmerzbehandlung von Patienten mit OIH machen. Zusätzlich zu seiner analgetischen Wirkung durch die Bindung an den Mu-Opioid-Rezeptor ist Methadon ein schwacher NMDA-Rezeptor-Antagonist.4 Es wurde berichtet, dass selbst eine niedrige Methadon-Dosis eine Verringerung der Hyperalgesie bewirken kann. In einem Fall führte die Gabe von Methadon in niedriger Dosierung (10 mg zweimal täglich) zu einer deutlichen Verbesserung der Schmerzempfindung und zu einer Verringerung der Gesamtopioiddosis um 40 % bis 50 %.22 Die Umstellung von dem Opioid, das den Schmerz verursacht, auf Methadon ist eine beliebte Behandlungsstrategie. Tramadol und Meperidin haben auch eine gewisse NMDA-Rezeptorantagonisten-Aktivität.
Eine weitere Behandlungsmethode, die ein gewisses Potenzial für die Behandlung von OIH hat, ist Buprenorphin.23,24 Buprenorphin ist ein partieller Opioid-Agonist am Mu-Rezeptor und hat auch eine Kappa-Rezeptor-Antagonisten-Aktivität.4Dynorphin, ein Kappa-Rezeptor-Agonist, steigt bekanntermaßen während der Behandlung mit Opioiden an. Die Aktivierung des Kappa-Rezeptors hebt die durch den Mu-Rezeptor vermittelten Wirkungen von Opioiden weitgehend auf.25 Der klinische Nutzen von Buprenorphin bei der Behandlung von OIH ist noch nicht vollständig geklärt.
Abschluss: Ein Blick in die Zukunft
Es bleibt noch viel zu tun, bevor man sagen kann, dass OIH verstanden ist. Der genaue zelluläre Mechanismus und die Signalwege, die für dieses Phänomen verantwortlich sind, sind nicht definiert. Erschwerend kommt hinzu, dass es widersprüchliche Berichte darüber gibt, ob bestimmte Komponenten eine Schlüsselrolle oder überhaupt eine Rolle spielen. Der Großteil der Forschung zur Aufklärung der Pathophysiologie der OIH wurde am Tiermodell durchgeführt. Dies hat einen gewissen Wert, aber die Informationen aus dem menschlichen Modell sind spärlich.
Ein unzureichendes Verständnis der Ursache einer Erkrankung führt zu einem unsicheren Arsenal an Behandlungsmöglichkeiten. Die beste verfügbare Strategie ist das völlige Absetzen des problematischen Opioids, doch nützt dies dem Patienten, der eine opioidartige Schmerzlinderung benötigt, nur wenig.
Es wurden mehrere andere Behandlungsmodalitäten untersucht, die jedoch alle von weiteren Studien profitieren würden. Die meisten Studien, die am Menschen durchgeführt wurden, betreffen perioperative Patienten, drogenabhängige Rehabilitanden und experimentelle Schmerzmodelle. Diese Studien sind nicht uninteressant, doch spiegeln diese Populationen nicht die chronische Schmerzpopulation wider. Zu den weiteren Einschränkungen der verfügbaren Behandlungsmöglichkeiten gehören unzureichende Ergebnisse, übermäßige Toxizität trotz mäßigem Erfolg und kleine Studien mit schwachen Schlussfolgerungen.
Zurzeit laufen mehrere klinische Studien mit dem NMDA-Rezeptor-Antagonisten Memantin zur Behandlung von OIH oder sind geplant.26 Noch immer gibt es widersprüchliche Berichte über die genaue Rolle der NMDA-Rezeptoren bei OIH. Weitere Forschungsarbeiten müssen durchgeführt werden, um die wichtigsten verantwortlichen Rezeptoren und Mechanismen bei OIH zu bestimmen. Eine Vergrößerung der Stichprobengröße von Studien wird dazu beitragen, die bereits gezogenen Schlussfolgerungen darüber zu untermauern, welche Behandlungsmittel für die OIH verantwortlich sind und wie sie wirksam behandelt werden können. Die Durchführung von Studien, die sich auf chronische Schmerzen und nicht auf Modelle akuter Schmerzen konzentrieren, kann dem Arzt klinisch relevante Informationen liefern.
Chapman und Kollegen haben spezifische Fragen aufgeworfen, die beantwortet werden müssen, bevor eine OIH-Diagnose gestellt und eine wirksame Behandlung durchgeführt werden kann.27 Welche Beziehungen bestehen zwischen Opioiddosis und -dauer und OIH? Bei welcher Art von Schmerzen bzw. bei welcher Art von Patienten entwickelt sich eher eine OIH? Dies sind die Fragen, die die künftige klinische Forschung leiten müssen.
1. Parselis Kelly J, Cook SF, Kaufman DW, et al. Prevalence and characteristics of opioid use in the US adult population. Pain. 2008;138:507-513.
2. Institute of Medicine. Relieving Pain in America: A Blueprint for Transforming Prevention, Care, Education, and Research. Washington, DC: The National Academies Press; 2011.
3. Chu LF, Angst MS, Clark D. Opioid-induced hyperalgesia in humans: molecular mechanisms and clinical considerations. Clin J Pain. 2008;24:479-496.
4. Lee M, Silverman SM, Hansen H, et al. A comprehensive review of opioid-induced hyperalgesia. Pain Physician. 2011;14:145-161.
5. Mao J. Opioid-induzierte abnorme Schmerzempfindlichkeit: Implikationen für die klinische Opioidtherapie. Pain. 2002;100:213-217.
6. Raffa RB, Pergolizzi JV Jr. Opioid-induzierte Hyperalgesie: ist sie klinisch relevant für die Behandlung von Schmerzpatienten? Pain Manage Nurs. 2011;1-17.
7. Li X, Clark JD. Hyperalgesia during opioid abstinence: mediation by glutamate and substance P. Anesth Analg. 2002;95:979-984.
8. Pud D, Cohen D, Lawental E, Eisenberg E. Opioids and abnormal painperception: new evidence from a study of chronic opioid addicts andhealthy subjects. Drug Alcohol Depend. 2006;82:218-223.
9. Malmberg AB, Yaksh TL. Durch spinalen Glutamat- oder Substanz-P-Rezeptor vermittelte Hyperalgesie, blockiert durch spinale Cyclooxygenase-Hemmung. Science. 1992;257:1276 -1279.
10. Fisher K, Coderre TJ, Hagen NA. Targeting theN-methyl-D-aspartate receptor for chronic pain management. Präklinische Studien an Tieren, aktuelle klinische Erfahrungen und zukünftige Forschungsrichtungen. J Pain Symptom Manage. 2000;20:358-373.
11. Lötsch J. Opioid Metabolites. J Pain Symptom Manage. 2005;29:S10-S24.
12. Skarke C, Lötsch J. Morphine metabolites: clinical implications. Semin Anesth, Perioperative Med Pain. 2002;21:258-264.
13. Juni A, Klein G, Kest B. Morphine hyperalgesia in mice isunrelated to opioid activity, analgesia, or tolerance: evidence formultiple diverse hyperalgesic systems. Brain Res. 2006;1070:35-44.
14. Angst M, Clark JD. Opioid-induzierte Hyperalgesie: eine qualitative systematische Überprüfung. Anesthesiology. 2006;104:570-587.
15. Vanderah TW, Gardell LR, Burgess SE, et al. Dynorphin fördert abnormale Schmerzen und antinozizeptive Toleranz bei spinalen Opioiden. J Neurosci. 2000;20:7074-7079.
16. Hooten WM, Mantilla CB, Sandroni P, Townsend CO. Associationsbetween heat pain perception and opioid dose among patients with chronicpain undergoing opioid tapering. Pain Med. 2010;11:1587-1598.
17. Silverman S. Opioid-induzierte Hyperalgesie: klinische Implikationen für den Schmerzmediziner. Pain Physician. 2009;12:679-684.
18. Li SQ, Xing YL, Chen WN, et al. Activation of NMDA receptor isassociated with up-regulation of COX-2 expression in the spinal dorsalhorn during nociceptive inputs in rats. Neurochem Res. 2009;34:1451-1463.
19. Okon T. Ketamin: eine Einführung für den Schmerz- und Palliativmediziner. Pain Physician. 2007;10:493-500.
20. Galer BS, Lee D, Ma T, et al. MorphiDex (Morphinsulfat/Dextromethorphan-Hydrobromid-Kombination) in der Behandlung chronischer Schmerzen: Drei multizentrische, randomisierte, doppelblinde, kontrollierte klinische Studien zeigen keine verbesserte Opioid-Analgesie oder Verringerung der Toleranz. Pain. 2005;115:284-295.
21. Wiesenfeld-Hallin Z. Kombinierte Opioid-NMDA-Antagonisten-Therapien.Welche Vorteile bieten sie für die Kontrolle von Schmerzsyndromen? Drugs. 1998;55;1-4.
22. Vorobeychik Y, Chen L, Bush MC, Mao J. Improved opioid analgesic effect following opioid dose reduction. Pain Med. 2008;9:724-727.
23. Baron MJ, McDonald PW. Signifikante Schmerzreduktion bei chronischen Schmerzpatienten nach der Entgiftung von hochdosierten Opioiden. J Opioid Manag. 2006;2:277-282.
24. Koppert W, Ihmsen H, Körber N, et al. Different profiles ofbuprenorphine-induced analgesia and antihyperalgesia in a human painmodel. Pain. 2005;118:15-22.
25. Pan ZZ. Mu-opposing actions of the kappa-opioid receptor. Trends Pharmacol Sci. 1998;19:94-98.
26. Ballantyne JC, Mao J. Opioidtherapie bei chronischen Schmerzen. N Engl J Med. 2003;349:1943-1953.
27. Chapman CR, Lipschitz DL, Angst MS, et al. Opioid-Pharmakotherapie bei chronischen Nicht-Krebs-Schmerzen in den Vereinigten Staaten: ein Forschungsleitfaden zur Entwicklung einer Evidenzbasis. J Pain. 2010;11:807-829.