Wasserstoffbindung Definition
Die Wasserstoffbindung ist eine anziehende Kraft zwischen einem teilweise positiv geladenen Wasserstoff und einem teilweise negativ geladenen Atom (Sauerstoff und Stickstoff). Es handelt sich um eine sehr schwache Bindung, und die Stärke der Wasserstoffbrückenbindung (5-10 kcal pro Bindung) ist viel geringer als die Stärke der kovalenten Bindung. Wasserstoffbrücken werden in der Regel als gestrichelte Linien zwischen zwei Atomen dargestellt. Zum Beispiel ist die Wasserstoffbindung zwischen zwei Wassermolekülen wie folgt dargestellt:
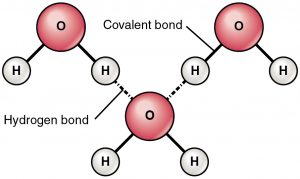
Grund der Wasserstoffbindung
Durch das Vorhandensein von sehr elektronegativen Atomen wie Sauerstoff oder Stickstoff wird das gemeinsame Elektronenpaar zwischen Sauerstoff und Wasserstoff zum elektronegativeren Atom hin gezogen. Diese ungleiche Verteilung der Elektronenpaare führt zur Bildung von zwei partiellen Dipolen. Der teilweise positiv geladene Wasserstoff wird dann von dem anderen teilweise negativ geladenen Sauerstoff oder Stickstoff angezogen, was als Wasserstoffbindung bekannt ist.
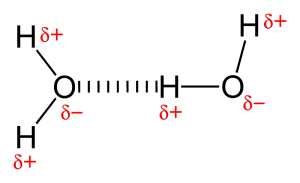
Arten von Wasserstoffbindungen
Wasserstoffbindungen können zwischen zwei Atomen desselben Moleküls oder zwischen zwei Atomen verschiedener Moleküle auftreten. Je nachdem gibt es zwei Arten von Wasserstoffbrückenbindungen:
- Intermolekulare Wasserstoffbrückenbindungen
- Intramolekulare Wasserstoffbrückenbindungen
Intermolekulare Wasserstoffbrückenbindungen
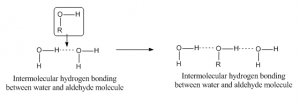
Wenn Wasserstoffbrückenbindungen zwischen zwei Atomen verschiedener Moleküle auftreten, nennt man sie intermolekulare Wasserstoffbrückenbindungen. Für eine solche Bindung sollte ein Molekül ein teilweise positives Wasserstoffatom als Akzeptoratom und ein anderes ein teilweise negatives oder Donoratom haben. Ein Beispiel für eine Wasserstoffbindung zwischen einem Aldehyd- und einem Wassermolekül ist unten aufgeführt:
2. intramolekulare Wasserstoffbindung
Wenn eine Wasserstoffbindung zwischen zwei teilweise geladenen Atomen desselben Moleküls auftritt, nennt man dies intramolekulare Wasserstoffbindung. Sie tritt auf, wenn zwei funktionelle Gruppen im selben Molekül vorhanden sind und sich gegenseitig anziehen können, um eine Wasserstoffbindung zu bilden. Zum Beispiel hat Salicylsäure zwei funktionelle Gruppen, Alkohol und Carbonsäure. Hier kommt es zu einer intramolekularen Wasserstoffbindung zwischen dem Wasserstoffatom der Alkoholgruppe und dem Sauerstoffatom der Carbonsäuregruppe.
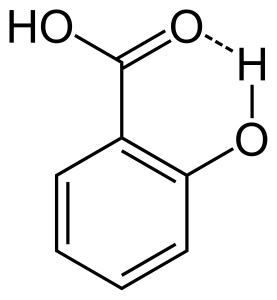
Auswirkungen der Wasserstoffbindung
auf den Siedepunkt
Es wird erwartet, dass der Siedepunkt von Substanzen mit gleichem oder ähnlichem Molekulargewicht den gleichen oder ähnlichen Siedepunkt haben sollte. Der Siedepunkt von Ether und Alkanen mit ähnlichem Molekulargewicht liegt nicht weit auseinander. Der Siedepunkt von Alkoholen ist jedoch viel höher als der von Äther mit ähnlichem Molekulargewicht. Dies lässt sich mit den Wasserstoffbrückenbindungen erklären. Aufgrund der Wasserstoffbrückenbindungen im Alkohol steigt der Siedepunkt an. Es wird zusätzliche Energie benötigt, um die Wasserstoffbrückenbindung zu brechen, bevor der Alkohol siedet. Da es keine Wasserstoffbrücken gibt, haben Alkane und Ether einen niedrigen Siedepunkt.

Zur Löslichkeit
Alkohole sind in Wasser löslich, Alkane jedoch nicht. Das liegt daran, dass sich intermolekulare wasserstoffgebundene Verbindungen in intermolekularen wasserstoffgebundenen Lösungsmitteln auflösen können. Ein polares Molekül wie Alkohol kann mit zwei Wassermolekülen eine Wasserstoffbindung eingehen, während eine unpolare Substanz wie Alkane dies nicht kann. Mit zunehmender Kohlenstoffkette in Alkoholen nimmt die Löslichkeit jedoch ab, da die lange Kette der Bildung der Wasserstoffbrückenbindung im Wege steht.
Zusammenfassung
- Wasserstoffbindung ist eine Anziehungskraft zwischen einem teilweise positiv geladenen Wasserstoffatom und einem teilweise negativ geladenen Atom.
- Wenn Wasserstoffbindung zwischen zwei Atomen verschiedener Moleküle auftritt, nennt man sie intermolekulare Wasserstoffbindung.
- Wenn Wasserstoffbindung zwischen zwei teilweise geladenen Atomen desselben Moleküls auftritt, nennt man das intramolekulare Wasserstoffbindung.
- Aufgrund der intermolekularen Wasserstoffbindung ist der Siedepunkt von polaren Verbindungen höher als der von unpolaren Verbindungen mit demselben a.
- Aufgrund der Wasserstoffbindung zwischen organischer Verbindung und Wasser ist die Löslichkeit bis zu einem gewissen Grad möglich.