Cada electrón en un átomo puede ser identificado de forma única por un conjunto de cuatro números cuánticos.

Aunque su descubrimiento requirió matemáticas avanzadas, todos ellos son números convencionales: tres de ellos sólo pueden tomar valores enteros simples; el cuarto es una fracción simple.
Los tres primeros números cuánticos surgen de la función de onda, Ψ, obtenida al resolver la ecuación de Schrödinger.
El cuarto número cuántico, el espín del electrón, surge del descubrimiento de que los electrones tienen dos orientaciones posibles.
Los números y sus definiciones son los siguientes:
Los números cuánticos
| Número cuántico | Nombre | Valores posibles | Información |
|---|---|---|---|
| n | número cuántico principal | 1, 2, 3,…, n | Define la capa de energía ocupada por el electrón. Las cáscaras más cercanas al núcleo tienen el menor valor de n y la menor energía potencial.n es el primer número que se escribe en las configuraciones electrónicas como la del magnesio: 1s2 2s2 2p6 3s2 |
| l | número cuántico del momento angular orbital (también llamado número cuántico azimutal) |
0, 1, 2,…, (n-1) | Define la subcáscara de energía – en sistemas con más de un electrón, las subcáscaras tienen diferentes energías. l define la letra de la subcáscara en las configuraciones de electrones. Por ejemplo: 1s2 2s2 2p6 3s2 l = 0 da una subcapa s. l = 1 da una subcapa p. l = 2 da una subcapa d, etc. |
| ml | número cuántico magnético | l, (l+1), …, 0,… , (l+1), l | Define la orientación del orbital del subesfuerzo. El subesqueleto p, con l = 1, tiene tres valores ml: -1, 0, 1.Estos indican que existen tres orbitales p.es decir los orbitales px, py, y pz. El subesqueleto d, con l = 2, tiene cinco valores ml: -2, -1, 0, 1, 2.Estos indican que existen cinco orbitales d. |
| ms | número cuántico de espín del electrón | -½ o +½ | Los electrones tienen dos posibles orientaciones de espín. |
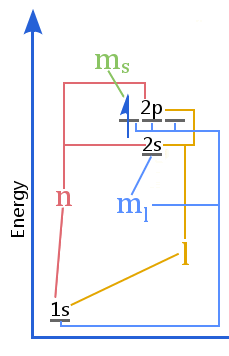
El diagrama de niveles de energía muestra la relación entre los números cuánticos frente a las cáscaras, las subcáscaras, los orbitales y el espín del electrón en un átomo.
Ningún electrón en un átomo comparte los cuatro números cuánticos.Cada electrón puede ser identificado de forma única por su número cuántico – véase el principio de exclusión de Pauli.
Las formas de los orbitales no vienen dadas por los números cuánticos, sino que son densidades de probabilidad -mapas tridimensionales del espacio alrededor del núcleo donde se encontrará un electrón el 99 por ciento de las veces.Las formas de los orbitales se obtienen a partir del cuadrado de la función de onda, Ψ2.La ubicación y el momento precisos de cualquier electrón nunca pueden conocerse – véase el principio de incertidumbre de Heisenberg.
