Definición de Enlace de Hidrógeno
El enlace de hidrógeno es una fuerza de atracción entre un hidrógeno parcialmente cargado positivamente y un átomo parcialmente cargado negativamente (oxígeno y nitrógeno). Es un enlace muy débil y la fuerza del enlace de hidrógeno (5-10 Kcal por enlace) es mucho menor que la fuerza del enlace covalente. Los enlaces de hidrógeno suelen mostrarse como líneas punteadas entre dos átomos. Por ejemplo, el enlace de hidrógeno entre dos moléculas de agua se muestra a continuación:
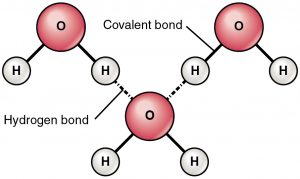
Razón del enlace de hidrógeno
Debido a la presencia de un átomo muy electronegativo como el oxígeno o el nitrógeno, el par de electrones compartido entre el oxígeno y el hidrógeno es atraído hacia el átomo más electronegativo. Esta distribución desigual del par de electrones conduce a la formación de dos dipolos parciales. El hidrógeno parcialmente cargado positivamente es entonces atraído por el otro oxígeno o nitrógeno parcialmente cargado negativamente, lo que se conoce como enlace de hidrógeno.
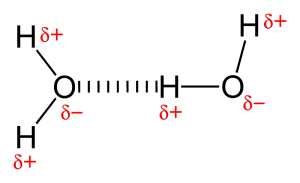
Tipos de enlace de hidrógeno
El enlace de hidrógeno puede producirse entre dos átomos de la misma molécula o entre dos átomos de distinta molécula. Dependiendo de esto, los enlaces de hidrógeno son de dos tipos:
- Enlace de hidrógeno intermolecular
- Enlace de hidrógeno intramolecular
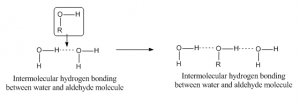
Enlace de hidrógeno intermolecular
Cuando el enlace de hidrógeno se produce entre dos átomos de diferentes moléculas, se llama enlace de hidrógeno intermolecular. Para este tipo de enlace una molécula debe tener un hidrógeno parcialmente positivo como átomo aceptor y otra debe tener un átomo parcialmente negativo o donante. Por ejemplo, el enlace de hidrógeno entre el aldehído y la molécula de agua es el siguiente:
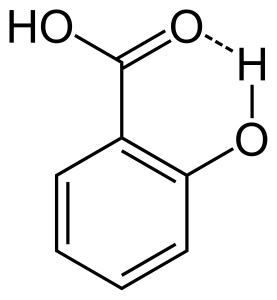
2. Enlace de hidrógeno intramolecular
Cuando el enlace de hidrógeno se produce entre dos átomos parcialmente cargados de la misma molécula, se denomina enlace de hidrógeno intramolecular. Esto ocurre cuando dos grupos funcionales están presentes en la misma molécula y están de tal manera que pueden atraerse entre sí para formar un enlace de hidrógeno. Por ejemplo, el ácido salicílico tiene dos grupos funcionales, el alcohol y el ácido carboxílico. En este caso, el enlace de hidrógeno intramolecular se produce entre el átomo de hidrógeno del grupo alcohol y el átomo de oxígeno del grupo ácido carboxílico.
Efectos del enlace de hidrógeno
En el punto de ebullición
Se espera que el punto de ebullición de sustancias con un peso molecular igual o similar tenga un punto de ebullición igual o similar. El punto de ebullición del éter y del alcano de peso molecular similar no están muy alejados. Pero el punto de ebullición de los alcoholes es mucho mayor que el del éter de peso molecular similar. Esto puede explicarse en términos de enlaces de hidrógeno. Debido a los enlaces de hidrógeno en el alcohol, el punto de ebullición aumenta. Se necesita energía adicional para romper el enlace de hidrógeno antes de que hierva. Como no hay enlaces de hidrógeno el alcano y el éter tienen un punto de ebullición bajo.

Sobre la solubilidad
Los alcoholes son solubles en agua pero los alcanos no. Esto se debe a que, los compuestos con enlaces de hidrógeno intermoleculares pueden disolverse en disolventes con enlaces de hidrógeno intermoleculares. Una molécula polar como el alcohol puede entrar en dos moléculas de agua para formar enlaces de hidrógeno, mientras que una sustancia no polar como los alcanos no puede. Sin embargo, con el aumento de la cadena de carbono en los alcoholes, la solubilidad disminuye ya que la cadena larga se interpone para formar el enlace de hidrógeno.
Resumen
- El enlace de hidrógeno es una fuerza de atracción entre un hidrógeno parcialmente cargado de forma positiva y un átomo parcialmente cargado de forma negativa.
- Cuando el enlace de hidrógeno se produce entre átomos de diferentes moléculas se llama enlace de hidrógeno intermolecular.
- Cuando el enlace de hidrógeno se produce entre dos átomos parcialmente cargados de la misma molécula se denomina enlace de hidrógeno intramolecular.
- Debido al enlace de hidrógeno intermolecular el punto de ebullición de los compuestos polares es mayor que el de los compuestos no polares con el mismo a.
- Debido al enlace de hidrógeno entre el compuesto orgánico y el agua, la solubilidad es posible hasta cierto punto.