El espacio interpalpebral de la conjuntiva desarrolla con frecuencia cambios tisulares irregulares que son, en su mayoría, mínimamente patológicos o no lo son en absoluto. Esta localización está expuesta a la radiación ultravioleta (UV) y a los irritantes atmosféricos y es susceptible a la sequedad; por lo tanto, las lesiones como las pinguéculas y las pterigias son irregularidades de la superficie ocular que se encuentran con frecuencia y que, por lo general, llaman mínimamente la atención en el examen.
Sin embargo, la enfermedad neoplásica escamosa se encuentra ocasionalmente. El carcinoma escamoso conjuntival invasivo suele estar precedido histológicamente por una neoplasia intraepitelial conjuntival (NIC), que representa el crecimiento neoplásico conjuntival más frecuente. Estas lesiones -a menudo mal diagnosticadas como crecimientos más típicos de la superficie ocular- son lentamente progresivas, localmente invasivas y no tienen potencial metastásico. Sin embargo, ocasionalmente pueden causar un daño local importante en la superficie ocular y pueden progresar a un carcinoma de células escamosas más invasivo. Tanto el diagnóstico como el tratamiento de la NIC pueden ser un reto. Este artículo ofrece información para los oftalmólogos que no se enfrentan a la NIC con demasiada frecuencia y desean una visión general clínica.
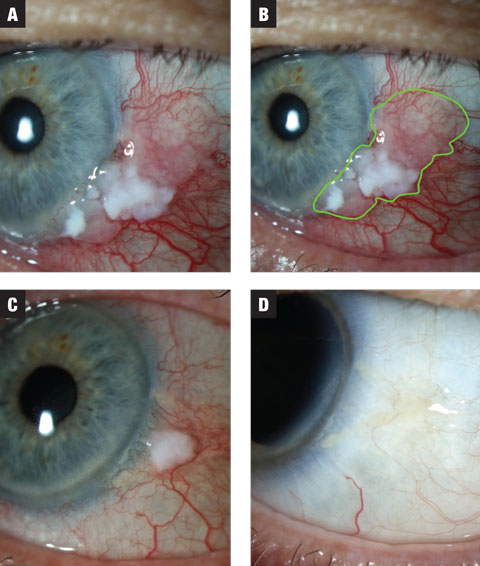
Fig. 1a. En el caso 1, la lesión presenta zonas leucoplásicas y gelatinosas. Se inició el tratamiento con MMC 0,02% QID. Fig. 1b. Extensión estimada de la lesión resaltada. Fig. 1c. Tras el primer tratamiento de tres semanas, la lesión muestra una drástica reducción de tamaño. El paciente fue puesto en un período de lavado de dos semanas y se le instruyó para anticipar un segundo curso de MMC. Fig. 1d. La lesión mostró una resolución completa tras el lavado. Haga clic en la imagen para ampliarla.
Desarrollo de la NIC
La génesis de una población celular epitelial cancerosa, o carcinoma, requiere una serie de cambios en el comportamiento de las células. Las células que presentan esta displasia muestran un crecimiento y maduración desorganizados, lo que da lugar a una sobreabundancia de células inmaduras que contrasta con una relativa escasez concomitante de células maduras de esta línea. Aunque la displasia es un proceso reversible, las células displásicas pueden sufrir más mutaciones, dando lugar a una transformación neoplásica, por la que las células se vuelven insensibles a los inhibidores del crecimiento y se vuelven invasivas.
Los carcinomas neoplásicos pueden estar confinados localmente por la membrana basal -conocido como carcinoma in situ- o pueden ser invasivos, caracterizados por la lesión que atraviesa la respectiva membrana basal y se extiende localmente. Sin embargo, esta estadificación no se refiere a dos entidades distintas, sino que el carcinoma in situ representa un paso previo en el mismo continuo de la neoplasia. Si se deja solo, el carcinoma in situ puede acabar convirtiéndose en invasivo.
Aunque es posible que el carcinoma escamoso se salte el paso de la NIC, con frecuencia es el punto medio en la etiología de la enfermedad. La NIC es una línea anormal de células epiteliales conjuntivales (y posiblemente corneales) y representa una displasia simple (espesor parcial del tejido epitelial) o un carcinoma in situ cuando la lesión es de espesor total.1-4 La NIC forma parte del espectro de trastornos neoplásicos de la conjuntiva y la córnea conocidos colectivamente como neoplasia escamosa de la superficie ocular (NESO). Si la NIC se vuelve invasiva al atravesar la membrana basal, se reclasifica como carcinoma de células escamosas (CCE) invasivo.
Aunque poco común, la NIC es la neoplasia conjuntival más frecuente en los Estados Unidos.4 Los factores de riesgo para el desarrollo de la NIC, y de todas las formas de NSE, son la exposición a los rayos UV (especialmente a los UV-B), el sexo masculino, la exposición a productos derivados del petróleo, el humo de tabaco intenso, el virus de la inmunodeficiencia humana (VIH) y el virus del papiloma humano (VPH) de tipo 16, aunque este último riesgo sigue siendo controvertido.1,3-5 El pronóstico de la NIC suele ser bueno, excepto en los casos en que el crecimiento es inusualmente grande. Una vez que la lesión rompe la membrana basal y se vuelve invasiva, el pronóstico es peor y suele requerir un tratamiento agresivo, como la enucleación o la extirpación. Incluso en estos casos, el riesgo de metástasis a distancia es bajo.
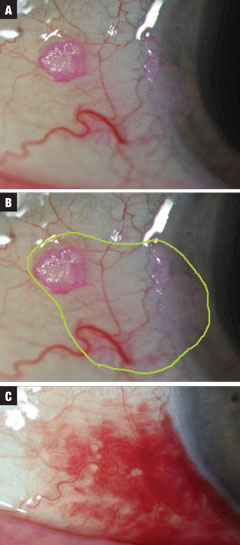
Figs. 2a-c (de arriba a abajo). En el caso 2 se trataba de una pequeña lesión sospechosa de NIC descubierta incidentalmente en un examen. Se inició el tratamiento con INF-a2b QID hasta que se agotó el frasco de 10mL. La extensión total estimada de los márgenes neoplásicos está resaltada en verde. Finalmente, se observó una resolución, con SCH concurrente relacionada con la valsalva (no inducida por la medicación). El tratamiento requirió un mes a un millón de UI QID y luego 10 días QID a tres millones de UI de INF-a2b. Haga clic en la imagen para ampliarla.
Presentación clínica
El aspecto clínico de la NIC es el de una masa anormal, ligeramente elevada y carnosa, localizada típicamente en la zona limbal interpalpebral (95% de todas las lesiones).6 La predilección por esta zona se debe probablemente a sus características. La exposición a los rayos UV-B es mayor en la zona interpalpebral, y la zona de células madre del limbo es un espacio de transición entre el epitelio corneal y el conjuntival. Esta zona de transición probablemente confiere un riesgo especial al tejido para sufrir displasia.
Las lesiones conjuntivales pueden ser gelatinosas, papilares o, con menor frecuencia, leucoplásicas, que se producen como resultado de la hiperqueratosis. Estas lesiones suelen estar bien definidas y mostrarán algún grado de vasculatura de alimentación.3,7,8 El 95% de los casos afectarán al limbo.6 Las manifestaciones corneales muestran un blanqueamiento similar y pueden mostrar proyecciones epiteliales grises y fimbriadas (es decir, en forma de dedo) desde el limbo. Clásicamente, las lesiones mostrarán una tinción positiva o punteada con rosa de bengala, que puede ser útil en la diferenciación clínica de la NIC de otras lesiones conjuntivales.8,9
A pesar de los hallazgos relativamente prominentes sobre el papel, las lesiones de NIC y CCE pueden ser difíciles de diferenciar de crecimientos más normales de la conjuntiva, como pinguéculas, pterigias y nevos. Esto puede llevar a un diagnóstico erróneo en hasta el 60% de los casos, incluso cuando son evaluados por clínicos experimentados, lo que hace que la biopsia con evaluación histológica sea potencialmente valiosa.3
Pruebas de diagnóstico
Históricamente, las pruebas incluían la biopsia por escisión realizada en el momento de la extirpación quirúrgica. Sin embargo, los médicos utilizan ahora la quimioterapia como modalidad de tratamiento primario, lo que puede limitar el acceso a la biopsia.
Una herramienta de diagnóstico más reciente es la citología de impresión, que se realiza aplicando un papel de filtro a la lesión, eliminando el epitelio superficial y permitiendo estudios histológicos mínimamente invasivos. Tiene una sensibilidad de aproximadamente el 80%, aunque los falsos negativos siguen siendo su punto débil, ya que el papel recolector puede verse obstaculizado por el exceso de queratosis de la lesión; los intentos repetidos suelen tener más éxito.8 Un estudio muestra que la OCT de ultra alta resolución, aunque no está disponible actualmente, es muy sensible en la diferenciación de OSSN y pterigión sobre la base del grosor epitelial de la lesión.10
Tratamiento
El tratamiento tradicional de la NIC es la escisión con márgenes de 1 mm a 5 mm, dependiendo de la extensión y los antecedentes de las lesiones primarias y recurrentes. La afectación corneal se desbrava con una cuchilla quirúrgica y se aplica crioterapia en el lecho y los bordes conjuntivales. La esclerótica se deja desnuda. Esto suele tener éxito, pero se han notificado recidivas entre el 10% y el 52%, dependiendo de la tasa de márgenes quirúrgicos claros determinada por la histología postoperatoria.6-11 La tasa desciende al 5% si se consiguen márgenes claros; lamentablemente, los estudios muestran que es difícil garantizar márgenes claros.8,9 Estas cifras parecen apoyar el uso de los márgenes más amplios posibles; sin embargo, la escisión conjuntival extensa tiene consecuencias: cambios cicatriciales, deficiencia de células madre limbales, fusión escleral, alteración significativa de la película lagrimal y cambios irregulares en el astigmatismo corneal.
Opciones tópicas
Más recientemente, los quimioterapéuticos tópicos se han hecho populares para el manejo de la NIC, ya que tienen la ventaja de tratar toda la superficie ocular y, cuando se utilizan con criterio, parecen ser bien tolerados.
Mitomicina. Descubiertas en la década de 1950, las mitomicinas son subproductos de la fermentación del Streptomyces caespitosus. La mitomicina-C (MMC), la última de estas moléculas descubierta, es un antimetabolito utilizado fuera del ámbito oftalmológico como agente quimioterápico antitumoral.12,13 La MMC funciona como un agente alquilante que impide la división del ADN durante la mitosis celular, una alteración que es extremadamente tóxica.1 Incluso uno de estos entrecruzamientos puede ser mortal para una célula.13 Además, la MMC puede generar especies reactivas de oxígeno y aumentar la síntesis del factor de necrosis tumoral (TNF).
Aunque tiene sus raíces en la oncología, el uso de la MMC se ha generalizado, especialmente en el ámbito de la atención oftalmológica, en un intento de limitar la formación excesiva de cicatrices postoperatorias. Los optometristas que comanejan pacientes de cirugía pueden estar familiarizados con su uso intraoperatorio para prevenir la formación de cicatrices en pacientes que se han sometido a un procedimiento de filtrado de glaucoma y su uso en la PRK para prevenir la opacidad de la córnea. Desde su primer uso asociado a la OSSN a mediados de la década de 1990, el MMC ha demostrado su eficacia, con tasas de éxito de entre el 82% y el 100%. La dosificación suele ser una concentración del 0,04% administrada QID en ciclos de una semana de duración, una semana de duración, o una concentración del 0,02% se dosifica de forma continua en tratamientos de cuatro semanas.4 La toxicidad de la medicación es mayor con tratamientos prolongados o concentraciones más altas
Como la MMC es una medicación especialmente potente y potencialmente peligrosa, sus efectos secundarios -deficiencia de las células madre de la córnea y derretimiento escleral, por ejemplo- pueden ser graves. Los efectos secundarios más frecuentes, como la epiteliopatía corneal y conjuntival y la inyección conjuntival, son transitorios.4,14 Cuando se utiliza, la MMC requiere un seguimiento cuidadoso y la interrupción de la medicación cuando se sospecha cualquier efecto secundario significativo.
5-Fluorouracilo (5-FU). Se trata de otro antimetabolito utilizado en el tratamiento de tumores dermatológicos y también por los cirujanos de glaucoma. Su mecanismo bloquea la síntesis de ADN al interferir con la enzima timidilato sintasa. En el tratamiento de la OSSN, el 5-FU se administra generalmente a una concentración del 1% QID un mes sí y un mes no hasta la resolución. La mayoría de los casos se resuelven con uno o dos ciclos, aunque algunos tardan hasta cinco. La toxicidad epitelial, que provoca erosión o descamación, es frecuente. En un estudio, la duración del tratamiento se fijó en el tiempo que transcurría hasta que se producía la descamación, y el tiempo de interrupción del tratamiento duraba hasta la reepitelización. A pesar de esta dolorosa complicación, los efectos secundarios del 5-FU no parecen ser tan graves como los de la MMC, y las tasas de recurrencia suelen ser equivalentes.4,14
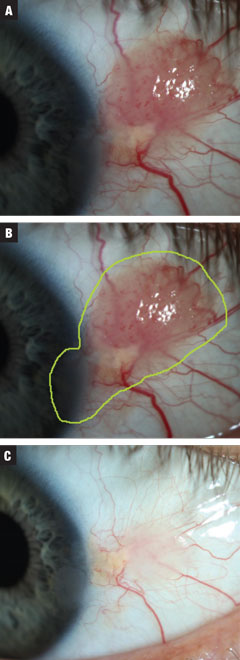
Fig. 3a. En el caso 3 se trataba de una presunta NIC papilomatosa de tamaño moderado. Se inició el tratamiento con INF-a2b tres millones de UI durante 10 días. Fig. 3b. Tamaño total estimado de la lesión. Fig. 3c. Post-tratamiento. Resolución casi completa del crecimiento con epitelio corneal irregular continuado. En contra del consejo, el paciente optó por observar en este momento. Haga clic en la imagen para ampliarla.
Interferón alfa 2b (INF-a2b). Los interferones son un subgrupo de proteínas inflamatorias de origen natural conocidas como citoquinas. Los producen las células inmunitarias activadas y tienen efectos antineoplásicos, antivirales y antimicrobianos variables. El primer uso notificado de INF-a2b en 1994 dio lugar a la resolución satisfactoria de una lesión de NIC con su uso tópico.5 Desde entonces, el INF-a2b se ha utilizado tanto por vía tópica como subconjuntival, con buen efecto, en el tratamiento de la NSO.
La dosis por vía tópica es la más eficaz, con una resolución del 87% al 100% en un período de cinco semanas (con inyecciones administradas hasta tres veces por semana).4,14,15 Son necesarias múltiples inyecciones para obtener este nivel de eficacia, lo que hace que hasta el 100% de los pacientes desarrollen mialgias sistémicas y fiebre.5,14 La dosis tópica es aproximadamente equivalente a la MMC en cuanto a eficacia.14,15 Se administra a una concentración de un millón de unidades internacionales (UI) por milímetro y se dosifica QID durante un mes más allá de la resolución clínica. Cuando no se produce la resolución, la concentración puede aumentarse hasta tres millones de UI, también QID. Por lo general, independientemente de la concentración del tratamiento, las farmacias especializadas prepararán el frasco a partir de una única preparación de un millón de UI. Esta preparación de un millón de UI puede concentrarse aún más reduciendo la cantidad de portador en el frasco. Los efectos secundarios del INF-a2b tópico son leves, siendo frecuentes la hiperemia y la conjuntivitis folicular; la queratitis es menos frecuente.4
Tópico frente a cirugía
Aunque la biopsia y la escisión quirúrgica han sido el tratamiento histórico de elección, los quimioterápicos tópicos, que tienen algunas ventajas teóricas sobre la cirugía, han ganado cierta aceptación como terapia de primera línea. Con la cirugía, es imposible garantizar márgenes claros, una característica necesaria para el mejor pronóstico. Cuanto mayor sea la cantidad de tejido extirpado para garantizar unos márgenes claros, mayor será el potencial de alteración a largo plazo de la superficie ocular. Los agentes tópicos tratan toda la superficie ocular, lo que elimina la necesidad de identificar los márgenes y permite un tratamiento eficaz de las poblaciones celulares neoplásicas que no podrían identificarse claramente con el análisis microscópico, una ventaja que puede llevar a combinar los agentes tópicos con la escisión quirúrgica como protocolo de tratamiento total para las lesiones grandes. El inconveniente de la terapia tópica, por supuesto, es que como toda la superficie ocular está expuesta a la medicación -técnicamente un sobretratamiento- pueden surgir complicaciones y, en el caso de la MMC en particular, esas complicaciones, aunque raras, pueden ser graves.
En lo que respecta a la eficacia, todos los agentes quimioterapéuticos tópicos para el tratamiento del OSSN funcionan razonablemente bien. El INF-a2b se ha sometido a estudios de eficacia en comparación con la resección quirúrgica y ha demostrado que elimina la lesión en tasas comparables, y las tasas de recurrencia pueden ser realmente menores para el INF-a2b en relación con la resección.4 Los estudios de seguimiento informan de que su uso es más apropiado en las lesiones simples o pequeñas, mientras que la cirugía es preferible en los casos de lesiones más avanzadas, aunque la terapia tópica puede ser preferible para las lesiones recurrentes.4,15
La MMC generalmente tiene el curso de tratamiento más corto, pero es la más tóxica y conlleva el mayor riesgo de complicaciones. El 5-FU tiene un perfil de efectos secundarios y una duración del tratamiento medianos; también es el menos caro del grupo. El INF-a2b tiene una tolerabilidad superior, pero a menudo se asocia con un tratamiento más largo y un mayor coste.4,13-16
El coste puede ser ciertamente una consideración a la hora de decidir el uso de quimioterapéuticos tópicos. Las compañías de seguros a veces se niegan a cubrir estos medicamentos, informando de su uso como experimental. En cursos cortos de tratamiento y comparando sólo el gasto sanitario total, los quimioterápicos tópicos son menos costosos que la cirugía; sin embargo, pueden superar el gasto de la cirugía después de varios cursos.
Aparte de este posible escollo, dada la eficacia, la posibilidad de evitar la cirugía y la tolerabilidad general, cuando se utilizan de forma monitorizada los quimioterápicos tópicos parecen ser una buena opción para el tratamiento de las lesiones de neoplasias intraepiteliales conjuntivales.
El Dr. Bronner es optometrista del Pacific Cataract and Laser Institute en Kennewick, Wash.
1. Kiire CA, Dhillon B. La etiología y las asociaciones de la neoplasia intraepitelial conjuntival. Br J Ophthalmol. 2006:90(1);109-13.
2. Birkholz ES et al. Tratamiento de la neoplasia intraepitelial de células escamosas de la superficie ocular con y sin mitomicina C. Cornea. 2011;30:37-41.
3. Lee GA, Hirst LW. Neoplasia escamosa de la superficie ocular. Estudio de oftalmología. 1995; 39:429-50.
4. Nelson KD, McSoley JJ. Hallazgos clínicos y manejo de la neoplasia intraepitelial conjuntival. Optometría. 2011; 82:15-21.
5. Nanji AA, Sayyad FE, Karp CL. Quimioterapia tópica para la neoplasia escamosa de la superficie ocular. Opinión actual en oftalmología. 2013; 24:336-42.
6. Warner M, Jakobiec F. Neoplasias escamosas de la conjuntiva. En: Krachmer JH, Mannis MJ, Holland EJ eds. Cornea. 2nd ed. St Louis: Mosby; 2004:557-70.
7. Rapuono CJ, Luchs JI, Kim T. Conjunctival and External Disease. Segmento anterior: los requisitos. Ed. Krachmer, JH. Mosby. 2000;33-6.
8. Huerva V y Ascaso FJ. Neoplasia intraepitelial conjuntival: presentación clínica, diagnóstico y posibilidades de tratamiento. Srivstava S (Ed.) ISBN: 978-953-307-987-5, InTech.
9. Nelson KD, McSoley JJ. Clinical findings and management of conjunctival intraepithelial Neoplasia. Optometría. 2011;82:15-21.
10. Kieval JZ1, Karp CL, Abou Shousha M, et al. Tomografía de coherencia óptica de ultra alta resolución para la diferenciación de la neoplasia escamosa de la superficie ocular y la pterigia. Invest Ophthalmol and Vis Sci. 2011; 52:1741.
11. Peksayar G, Soyturk MK, Demiryont M: Resultados a largo plazo de la crioterapia en tumores epiteliales malignos de la conjuntiva. Amer J of Ophthalmol. 1989;107: 337.
12. Santhiago MR, Netto MV, Wilson SE. Mitomycin C: Efectos biológicos y uso en cirugía refractiva. Cornea. 2012; 31:311-21.
13. Tomaz M. Mitomicina C: pequeña, rápida y mortal (pero muy selectiva). Chem and Biol. 1995; 2:575-9.
14. Majmudar PA, Epstein RJ. Antimetabolitos en la neoplasia de la superficie ocular. Curr Opin in Ophthalmol. 1998; 9:35-9.
15. Besley J, Pappalardo J, Lee GA. Factores de riesgo de recurrencia de la neoplasia escamosa de la superficie ocular después del tratamiento con mitomicina C tópica e interferón alfa 2b. Amer J of Ophthalmol 2014; 157:287-93.
16. Boehm M y Huang AJW. Tratamiento de la neoplasia intraepitelial corneal y conjuntival recurrente con interferón alfa-2b tópico. Ophthalmol. 2004; 111:1755-61.