Estructura de Kekulé para el benceno
Se sabía que el benceno tenía la fórmula molecular C6H6, pero se desconocía su fórmula estructural.
Si el benceno era un hidrocarburo insaturado de cadena recta debería sufrir fácilmente reacciones de adición (al igual que otros alquenos y alquinos).
Por ejemplo, el bromo, Br2, debería añadirse a través del doble o triple enlace como se muestra a continuación:
| posible reacción de adición de estructura de cadena recta: | |||
| CH3-C≡C-C≡C-CH3 | + Br2 | → | CH3-CBr=CBr-C≡C-CH3 |
Pero, cuando se añade bromo al benceno a 25°C y 1 atm (101.3 kPa), no parece producirse ninguna reacción.
Así pues, las posibles estructuras para el benceno que implican dobles y/o triples enlaces dispuestos en cadena parecían muy improbables, ya que éstas deberían sufrir reacciones de adición.
Si se añade bromo al benceno en presencia de FeBr3, éste sufre una reacción de sustitución en la que uno de los átomos de hidrógeno se sustituye por un átomo de bromo para producir un compuesto con la fórmula C6H5Br, como se muestra a continuación:
| reacción de sustitución conocida: | ||||||||
| C6H6 | + Br2 | FeBr3 → |
C6H5Br | + HBr | ||||
En este sentido, el benceno se comportaba mucho más como un hidrocarburo saturado (sólo enlaces simples entre átomos de carbono).
Así, la primera estructura propuesta por Kekulé para el benceno en 1865 no contenía ningún doble enlace pero sí disponía los 6 átomos de carbono en un anillo como el que se muestra a continuación:
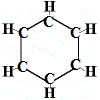
Kekulé se dio cuenta de que esta molécula rompe la regla de tetravalencia del carbono, es decir, cada átomo de carbono está formando sólo 3 enlaces en lugar de 4.
Así, en 1872 Kekulé propuso una estructura de benceno compuesta por tres enlaces simples y dobles alternados como se muestra a continuación:

Nótese que aunque los átomos de carbono no están escritos dentro de la estructura, siempre se entiende que existe un átomo de cabón donde se unen dos líneas del hexágono, por lo que hay 6 «uniones», 6 ángulos, y por tanto 6 átomos de carbono.
En esta estructura cada átomo de carbono está unido a un átomo de hidrógeno, y, a otros dos átomos de carbono. Uno de los enlaces carbono-carbono es un enlace simple, el otro enlace carbono-carbono es un enlace doble. Cada átomo de carbono ha hecho 4 enlaces.
Si bien esta estructura no explica por qué el benceno no sufre reacciones de adición, podría explicar por qué el benceno forma sólo un isómero estructural cuando el benceno reacciona con el bromo en una reacción de sustitución como se muestra a continuación:
 estructura propuesta del benceno |
+ Br2 | → |  sólo 1 isómero estructural |
. | + HBr |
Las otras estructuras de anillo propuestas para el benceno habrían predicho más de un isómero estructural para el producto de la reacción de sustitución como se muestra a continuación:
| otra estructura de anillo propuesta reacción: | 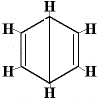 |
Br2 → |
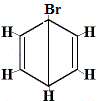 Isómero estructural 1 |
+ | 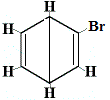 isómero estructural 2 |
¿Qué ocurriría si se reemplazara (sustituyera) otro átomo de hidrógeno por un átomo de bromo?
| C6H5Br | + Br2 | FeBr3 → |
C6H4Br2 | + HBr |
¿Cuántos isómeros estructurales de C6H4Br2 se producirían?
 |
Br2 → FeBr3 |
 Isómero estructural 1 |
+ | 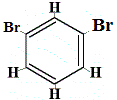 Isómero estructural 2 |
+ | 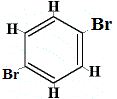 isómero estructural 3 |
+ |  isómero estructural 4 |
Los isómeros estructurales 1 y 4 son diferentes porque en el isómero 1 los dos átomos de Br están unidos a átomos de carbono en un enlace C-C, mientras que en el isómero 4 los dos átomos de Br están unidos a átomos de carbono en un enlace C=C.
Sin embargo, cuando el C6H5Br hecho de benceno reacciona con bromo en una reacción de sustitución, ¡sólo se producen 3 isómeros estructurales de C6H4Br2!
Para resolver este problema, Kekulé propuso que el anillo de benceno está en rápido equilibrio entre estructuras en las que los dobles enlaces están en las posiciones alternativas como se muestra a continuación:
 |
⇋ | 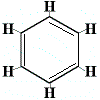 |
Así, cuando el bromo reacciona con C6H5Br en una reacción de sustitución para producir C6H4Br2, los pares de isómeros estructurales de C6H4Br2 están en equilibrio entre sí.
Esto significa que los isómeros estructurales 1 y 4 mostrados anteriormente, que sólo difieren en que los átomos de Br están unidos a través de un enlace simple o un enlace doble, están ahora en rápido equilibrio entre sí como se muestra a continuación:
| Átomos de Br en átomos de C adyacentes, el isómero estructural 1 tiene átomos de Br a través de C-C el isómero estructural 4 tiene átomos de Br a través de C=C |
 el isómero estructural 1 |
⇋ |  el isómero estructural 4 |
Según Kekulé, estos dos isómeros estructurales de C6H4Br2 están en un equilibrio tan rápido que no pueden separarse como dos moléculas distintas, por lo que parece que sólo hay 3 isómeros en lugar de 4.
Aunque esta estructura de equilibrio rápido para el benceno, conocida como estructura de Kekulé, resultó ser útil, no explica la estabilidad única (falta de reactividad) del anillo de benceno, no explica por qué el benceno no experimenta fácilmente reacciones de adición pero puede ser inducido a experimentar reacciones de adición.
¿Entiendes esto?
¡Únete a AUS-e-TUTE!
¡Haz el test ahora!