Introducción
Los meningiomas son la neoplasia primaria más frecuente del sistema nervioso central (SNC) y representan más del 37% de todos los tumores cerebrales primarios (1). Las opciones de tratamiento de los meningiomas incluyen la observación, la cirugía y la radioterapia (2, 3). Aunque una minoría de los meningiomas son agresivos, incluidos los grados II y III de la Organización Mundial de la Salud (OMS), más del 80% son de grado I de la OMS, y a menudo se denominan «benignos» (4). Sin embargo, incluso los meningiomas de grado I de la OMS pueden reaparecer, y estudios anteriores destacan una tasa de recidiva de hasta el 47% con un seguimiento a largo plazo (4, 5). La recidiva del meningioma suele requerir un tratamiento con cirugía adicional o radioterapia de rescate, lo que conlleva una posible morbilidad (6, 7). En consecuencia, la capacidad de predecir la recidiva es un componente crucial del tratamiento del meningioma de grado I de la OMS para hacer recomendaciones sobre la frecuencia de las imágenes de vigilancia o el uso de radioterapia adyuvante.
Además del grado de Simpson alcanzado en la resección, se han evaluado varias características del tumor como posibles predictores de la recidiva, centrándose en los hallazgos histopatológicos (8). Estos incluyen el índice MIB-1 (un marcador de proliferación celular), la invasión cerebral y la presencia de características histológicas atípicas, como el aumento de la celularidad, las láminas, los focos de necrosis espontánea y la atipia nuclear (9-13). De hecho, las clasificaciones de la OMS de 2016 utilizan exclusivamente los hallazgos patológicos para determinar el grado del tumor, con el grado II definido por la invasión cerebral y el aumento de mitosis en más de 4/10 campos de alta potencia (4). Además, tres características atípicas dan lugar a un aumento del grado del tumor (4). De cara al futuro, las características moleculares de los meningiomas se han asociado recientemente con el riesgo de recidiva y probablemente se utilizarán en la clasificación de los meningiomas en el futuro (14-16).
Aunque las clasificaciones de la OMS sintetizan la literatura disponible para crear delineadores claros entre los grados de los tumores, la literatura en torno a la recidiva de los meningiomas de grado I de la OMS sigue siendo contradictoria. Por ejemplo, aunque la invasión cerebral por sí sola puede dar lugar a un aumento del grado del tumor desde el grado I-II de la OMS, varios estudios posteriores no han encontrado una relación entre la invasión cerebral y la recidiva, lo que pone de manifiesto la necesidad de realizar investigaciones adicionales sobre los factores predictivos de la recidiva (10, 17, 18). La utilidad del índice MIB-1 para predecir la recidiva del meningioma también es controvertida; un estudio en meningiomas de grado I de la OMS sólo sugirió un mayor riesgo de recidiva con un índice MIB-1 de >3%, pero otras publicaciones que incluyen todos los grados de la OMS han demostrado una mayor incidencia de recidiva con >5% o >10% (9-11). Estudios anteriores también han propuesto un punto de corte del MIB-1 de >3% sólo en pacientes con una resección Simpson II o III, lo que demuestra aún más la variedad de puntos de corte del MIB-1 y su uso (13). En comparación, un número limitado de estudios ha investigado el impacto de las características atípicas en la recurrencia de los meningiomas de grado I de la OMS; aunque han sugerido un mayor riesgo de recurrencia en los tumores de grado I de la OMS que presentan características atípicas en el análisis patológico (9).
Por lo tanto, el objetivo de este estudio fue investigar los predictores clínicos, radiográficos y patológicos de recurrencia en los meningiomas de grado I de la OMS. Dada la falta de consenso sobre el uso del MIB-1 en los meningiomas de grado I de la OMS, también utilizamos el análisis de partición recursiva para identificar un punto de corte clínicamente relevante para el índice MIB-1. A continuación, identificamos los predictores de recurrencia temprana y posterior a la media en los tumores de grado I de la OMS.
Métodos
Población de pacientes
Los pacientes que se sometieron a tratamiento por un meningioma de grado I de la OMS entre 2007 y 2017 se identificaron retrospectivamente utilizando una base de datos institucional. Este estudio fue aprobado formalmente por la Junta de Revisión Institucional de la Universidad de California, San Francisco (IRB#13-12587). Se excluyeron los pacientes sin valores del índice MIB-1 disponibles en la historia clínica electrónica. Al principio del período de estudio, el MIB-1 se obtuvo a discreción del neuropatólogo encargado, pero, a medida que avanzaba el tiempo, el MIB-1 se obtuvo en todos los pacientes con meningioma de grado I de la OMS.
Datos clínicos
Se revisaron y recopilaron retrospectivamente las características demográficas, clínicas y de tratamiento de los pacientes, los datos histopatológicos y los resultados clínicos. Los datos clínicos recogidos incluyeron la edad del paciente, el sexo, el estado de rendimiento de Karnofsky (KPS) en el momento del tratamiento, la presentación clínica y los antecedentes de tratamiento de meningioma. Los datos histopatológicos incluían el índice MIB-1, las láminas/pérdida de arquitectura, el aumento de la celularidad, la necrosis, la atipia nuclear y la presencia de invasión ósea. Se recogieron los resultados de las tinciones para el receptor de progesterona (PR), el antígeno de la membrana epitelial (EMA), el CD34, el S100 y la proteína glial fibrilar y ácida (GFAP) cuando estaban disponibles. Los datos patológicos se extrajeron del informe patológico generado en el momento de la intervención quirúrgica. La localización del tumor, su tamaño y la presencia de edema peritumoral preoperatorio se determinaron mediante imágenes de RMN preoperatorias. Se recogieron los diámetros anteroposterior (AP), superior-inferior (SI) y transversal (TV). El volumen tumoral preoperatorio se calculó mediante la ecuación del volumen tumoral no esférico. El tipo de tratamiento se recogió de forma similar. El grado de Simpson se determinó mediante el informe operatorio. La resección total bruta (RTB) y la resección subtotal (RTS) se determinaron mediante escáneres de resonancia magnética (RM) postoperatorios.
Los resultados primarios de interés fueron la recidiva tumoral y el tiempo hasta la recidiva. La recidiva se determinó en la radiografía postoperatoria como una recidiva local o una progresión del tumor residual. El tiempo hasta la recidiva se determinó a partir de la fecha de tratamiento del paciente. La duración del seguimiento se calculó desde la fecha del tratamiento hasta la última visita a la clínica de neurocirugía. Los resultados secundarios incluyeron la recidiva temprana y la recidiva posterior. La recidiva precoz se definió como en los 2 años siguientes al tratamiento inicial (19). La recurrencia postmediana se definió como la que se produjo >2 años después del tratamiento inicial.
Análisis estadístico
Se utilizó la prueba de la ji-cuadrado y la prueba de la t de Student para la comparación de las variables categóricas y continuas, respectivamente. Se construyó un modelo multivariante de regresión de Cox para la recurrencia utilizando variables con p < 0,200 en el análisis univariante. Del mismo modo, se construyeron modelos logísticos binarios multivariantes de verosimilitud hacia atrás para predecir la recurrencia temprana y posterior a la media utilizando variables con p < 0,200 en el análisis univariante. Se utilizó el análisis de partición recursiva (RPA) para identificar aún más los factores de riesgo clave de la recidiva general, temprana y posterior a la mediana del meningioma. Se utilizó una p < 0,050 como umbral de significación estadística. Todos los análisis estadísticos se realizaron con SPSS 26.
Resultados
Demografía general de los pacientes y resultados clínicos
La demografía general de los pacientes, las características histopatológicas y los resultados clínicos pueden verse en la Tabla 1. En total, se incluyeron en el estudio 239 pacientes con meningiomas de grado I de la OMS. La edad media era de 60,0 años y el 69,5% de los pacientes eran mujeres. El síntoma de presentación más frecuente fue la cefalea (30,5%), seguido de un déficit neurológico focal (27,6%). La mayoría de los pacientes fueron sometidos sólo a cirugía (98,3%), con 2 pacientes que recibieron tratamientos adyuvantes de radioterapia (0,8%) o gamma knife (0,8%). El edema peritumoral estaba presente en las RMN preoperatorias del 38,1% de los pacientes. El volumen tumoral medio calculado fue de 30,6 cm3 (rango = 0,23-215,73 cm3), y la dimensión media del tumor más grande fue de 3,8 cm (rango = 0,6-11,3 cm). En general, 91 (38,1%) tumores estaban localizados en la base del cráneo, 57 (23,8%) eran tumores de convexidad, 43 (18,0%) tenían una localización falx/parasagital, y 55 (23,0%) tenían otra localización. La mayoría de los pacientes recibieron una resección total bruta (63,6%). La incidencia de resección Simpson I, II, III y IV fue de 31,4, 29,7, 2,5 y 35,6%, respectivamente. Los rasgos atípicos estaban presentes en un número de pacientes; los rasgos atípicos más comunes eran la invasión ósea (18,0%) y las láminas/pérdida de arquitectura (8,4%). El seguimiento medio fue de 41,1 meses (rango: 0-147 meses).
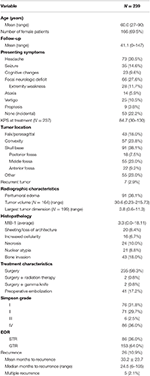
Tabla 1. Características de los pacientes, características histopatológicas, radiografía y resultados.
Predictores de recurrencia de meningioma de grado I de la OMS
Un total de 26 pacientes recurrieron con una mediana de tiempo hasta la recurrencia de 24,5 meses (Tabla 1). Una comparación entre los pacientes con recidiva y los que no la tuvieron se puede encontrar en la Tabla 2. No hubo diferencias en la edad (60,2 frente a 58,8, p = 0,582) ni en el sexo femenino (61,5 frente a 70,4%, p = 0,353) entre los pacientes con tumores recidivados y los no recidivados. Las características del tratamiento fueron similares entre los grupos, y la mayoría de los pacientes de cada grupo recibieron sólo cirugía (100,0 frente a 98,1%, p = 1,000). Sin embargo, los pacientes con tumores recidivantes tenían una mayor incidencia de RTS (61,5 frente al 32,7%, p = 0,004) y una menor incidencia de resección de grado I de Simpson (11,5 frente al 34,1%, p = 0,019). La incidencia de edema peritumoral, el tamaño y el volumen del tumor fueron similares entre los grupos. En el análisis histopatológico, los pacientes con recidiva tendían a una mayor atipia nuclear (19,2 vs. 7,5%, p = 0,061). Las pacientes con recidiva también tuvieron una media de seguimiento mayor (68,9 frente a 37,7 meses, p = 0,001).
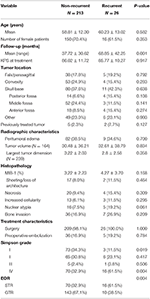
Tabla 2. Comparación de pacientes con meningiomas recurrentes frente a meningiomas no recurrentes.
Un posterior análisis de cox-regresión de probabilidad inversa puso de manifiesto una relación independiente entre la recurrencia y la localización del tumor en la fosa posterior (HR = 5.25, IC 1,71-16,17, p = 0,004), el índice MIB-1 (HR = 1,18, IC 1,05-1,34, p = 0,008), la atipia nuclear (HR = 5,24, IC 1,73-15,92, p = 0,003) y el STR (HR = 5,66, IC 1,30-13,92, p < 0,001; Tabla 3). Las curvas de Kaplan-Meier que destacan la supervivencia libre de recidiva para la localización en la fosa posterior (p = 0,007), la atipia nuclear (p = 0,137), la extensión de la resección (p = 0,001) y el MIB-1 >4,5% (p = 0,001) se muestran en las Figuras 1A-D.
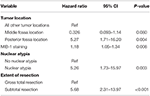
Tabla 3. Análisis de regresión de Cox para la recurrencia.

Figura 1. Curvas de Kaplan Meier de los factores de riesgo de recurrencia de meningioma de grado I de la OMS. (A) Atipia nuclear (línea azul) frente a ausencia de atipia nuclear (línea roja) (X2 = 2,21, p = 0,137). (B) Localización del tumor en la fosa posterior (línea azul) frente a otras localizaciones (línea roja) (X2 = 10,36, p = 0,001). (C) Índice MIB-1 >4,5% (línea azul) frente a ≤4,5% (línea roja) (X2 = 6,17, p = 0,013). (D) STR (línea azul) vs. GTR (línea roja) (X2 = 10,46, p = 0,001).
Predictores de recurrencia de meningiomas de grado I de la OMS tempranos vs. posteriores a la mediana
En la tabla 4 se presenta una comparación entre los pacientes no recurrentes y los pacientes con tumores que recurrieron de forma temprana o posterior a la mediana. Los pacientes con una recidiva temprana tuvieron una mayor incidencia de resección subtotal (76,9 frente a 32,7%, p = 0,001). También tendieron a una mayor incidencia de atipia nuclear (23,1 vs. 7,5%, p = 0,084) en la histopatología (Tabla 4). Los pacientes con una recidiva posterior a la media tendieron hacia una mayor incidencia de localización del tumor en la fosa posterior (23,1 frente a 6,6%, p = 0,063) y una mayor incidencia de invasión ósea (38,5 frente a 16,9%, p = 0,064), así como un mayor índice MIB-1 (5,55 frente a 3,22%, p = 0,098). No hubo diferencias significativas entre las tasas de clasificación de Simpson o GTR en los pacientes con recidiva post-mediana frente a los pacientes no recidivantes (Tabla 4).
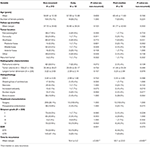
Tabla 4. Recurrencia precoz frente a post-medial.
Se utilizaron dos modelos logísticos binarios de probabilidad inversa multivariante para identificar los predictores de recurrencia precoz frente a post-medial (Tabla 5). Los predictores independientes de recurrencia tumoral temprana incluyeron la atipia nuclear en la histopatología (OR = 6,45, IC 1,34-31,07, p = 0,020) y el STR (OR = 8,92, IC 2,18-36,46, p = 0,002). El único predictor independiente de la recidiva post-medial fue el índice MIB-1 (OR = 1,24, IC 1,05-1,45, p = 0,010), aunque la localización de la fosa posterior se acercó a la significación (OR = 4,42, IC 0,954-20,49, p = 0,058; Tabla 5).

Tabla 5. Modelo logístico binario para la recurrencia tumoral post-medial y temprana.
Se realizó un análisis de partición recursiva de la recurrencia
RPA para identificar los factores de riesgo clave de la recurrencia del meningioma (Figura 2). En consonancia con el análisis de regresión de Cox, el STR fue la primera partición al predecir la recurrencia global: El 18,6% de los pacientes con una resección por RTS recidivaron en comparación con el 6,5% con una RGT. El siguiente nodo de decisión dentro de los pacientes con GTR fue el punto de corte del MIB-1 del 4,5%, ya que el 18,8% de los pacientes con un MIB-1 >4,5% recurrieron frente al 3,3% de los pacientes con un MIB-1 ≤4,5% (Figura 2A). En lo que respecta a la recidiva post-mediana específicamente, el RPA identificó el primer nodo de decisión como un punto de corte de MIB-1 del 5,83%: El 22,2% de los pacientes con MIB-1 >5,83% recurrieron frente al 3,3% de los pacientes con un MIB-1 ≤5,83%. El nodo de decisión posterior utilizó una localización del tumor en la fosa posterior: El 13,3% de los pacientes con un tumor de la fosa posterior recurrió frente al 2,5% de otras localizaciones tumorales (Figura 2B). El RPA para la recidiva temprana identificó la extensión de la resección como el principal nodo de decisión: El 11,6% de los pacientes con STR recidivaron frente al 2,0% de los pacientes con GTR. El siguiente nodo de decisión utilizó la localización falx o parasagital: El 36,4% de los tumores falx o parasagitales recidivaron frente al 8,1% de otras localizaciones tumorales (Figura 2C).
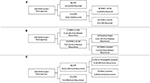
Figura 2. Análisis de partición recursiva que destaca los factores de riesgo clave para (A) la recidiva global, (B) la recidiva posterior a la media y (C) la recidiva temprana.
Discusión
Resultados clave
La recidiva del meningioma de grado I de la OMS se asocia de forma independiente con el índice MIB-1, la localización del tumor en la fosa posterior, la presencia de atipia nuclear y el STR. Más concretamente, se identificó un índice MIB-1 del 4,5% como un punto de corte clínicamente relevante para estratificar el riesgo de los pacientes con meningioma de grado I de la OMS tras la RTG. Los pacientes con un índice MIB-1 >4,5% y GTR de su meningioma de grado I de la OMS tenían un riesgo de recurrencia similar al de los pacientes con un STR. Un análisis más detallado puso de manifiesto que el MIB-1 era un factor crítico asociado a la recidiva posmoderna, mientras que la extensión de la resección era el principal impulsor de la recidiva temprana.
Predictores de la recidiva del meningioma de grado I de la OMS
Estudios anteriores han evaluado de forma similar la relación entre las características histopatológicas, las características clínicas y la recidiva en todos los grados de meningioma de la OMS. En un estudio de 901 pacientes (716 de grado I de la OMS, 174 de grado II y 11 de grado III), Gousias et al. demuestran un mayor riesgo de recidiva en los meningiomas con un índice MIB-1 de >10%, mayor grado de la OMS, tamaño del tumor >6 cm, localización petroclival o del seno cavernoso y multiplicidad (11). Sin embargo, Gousias et al. no evaluaron la relación entre la presencia de características atípicas en la histología y la recurrencia del tumor. En los meningiomas de grado I de la OMS específicamente, Marciscano et al. utilizaron una cohorte de 148 pacientes con meningioma de grado I de la OMS con un análisis patológico completo para identificar las variables asociadas a la recidiva, centrándose en el impacto de las características patológicas atípicas en el riesgo de recidiva (9). Curiosamente, identifican la presencia de características atípicas como un factor de riesgo independiente, además del índice MIB-1 >3% y la resección de Simpson. Nuestro estudio destaca de forma similar el RTG quirúrgico y la atipia nuclear, una característica atípica, como predictores independientes de recurrencia (Tabla 3), aunque evaluamos cada característica atípica de forma independiente. También consideramos la localización del tumor en nuestro modelo de regresión de Cox, identificando además la localización del tumor en la fosa posterior como un factor de riesgo independiente de recurrencia. Mientras que Marciscano et al. no incluyeron la localización del tumor en su análisis de predictores de progresión, Gousias et al. demuestran de forma similar que la localización petroclival del tumor es un factor de riesgo de recurrencia, aunque al considerar todos los grados de meningioma de la OMS (9, 11). El mayor riesgo de recidiva asociado a la localización en la fosa posterior puede deberse a la mayor prevalencia de mutaciones en la NF2 en la fosa posterior (14, 15, 20), aunque no podemos explorar plenamente este aspecto, ya que en nuestra institución no realizamos habitualmente pruebas genéticas de los meningiomas. En cualquier caso, se necesitan estudios adicionales con cohortes más amplias de pacientes con meningioma de grado I de la OMS para investigar esta relación.
Índice MIB-1 y recurrencia del meningioma de grado I de la OMS
De forma similar a estudios anteriores (9, 11, 13, 21) también evaluamos la relación entre el índice MIB-1 de un tumor y su riesgo de recurrencia. En primer lugar, evaluamos el índice MIB-1 en un modelo de regresión de Cox para la recidiva global, como se ha comentado anteriormente. De acuerdo con estudios anteriores, encontramos que un índice MIB-1 más alto se asociaba de forma independiente con un mayor riesgo global de recidiva. Dadas las discrepancias en los valores de corte para el MIB-1 entre la literatura y la variabilidad entre laboratorios, inicialmente evaluamos el MIB-1 como una variable continua. A continuación, tratamos de determinar el punto de corte para el índice MIB-1 en nuestra población de pacientes utilizando el RPA para modelar la recurrencia global, lo que identificó un valor de corte de MIB-1 del 4,5% en los pacientes con RTG (Figura 2A). Curiosamente, estos pacientes tenían un riesgo de recurrencia similar al de los pacientes con un RTS, lo que demuestra la utilidad del MIB-1 en los pacientes después de un RTG. Perry et al. identifican de forma similar un índice MIB-1 del 4,2% como asociado a la recidiva tras un RTG en un análisis univariante, aunque cuando se consideran todos los grados de meningioma (22).
La tasa de recidiva del 18,8% en pacientes con un RTG y un MIB-1 >4,5%, pone de manifiesto la necesidad de una estrecha vigilancia de estos pacientes o incluso la consideración de la radioterapia adyuvante, dependiendo de la preferencia del paciente. Se ha demostrado que la radioterapia adyuvante tras la resección del meningioma de grado I de la OMS reduce la recidiva, especialmente tras la RTS (23-25), aunque la observación tras la RTS sigue siendo la práctica habitual (8). En un estudio de 92 meningiomas de grado I de la OMS, Soyuer et al. demostraron una supervivencia libre de progresión (SLP) del 91% en los pacientes que recibieron radioterapia adyuvante tras la RTS, que fue significativamente mayor que la SLP del 38% en aquellos pacientes que no habían recibido radioterapia adyuvante (24). Dado que los pacientes de nuestro estudio con una RTS tenían un riesgo similar de recidiva que los que tenían una RGT y una MIB-1 >4,5%, la radioterapia adyuvante para ambos grupos puede ser razonable. Sin embargo, se necesitan estudios más amplios para validar más nuestro punto de corte de MIB-1 y las implicaciones clínicas asociadas. También se necesitan estudios prospectivos que investiguen el uso de la radioterapia adyuvante en los meningiomas de grado I de la OMS.
Predictores de recurrencia de meningiomas de grado I de la OMS tempranos y posteriores
Dada la tendencia a una recurrencia más tardía en los pacientes con un MIB elevado >4.5% (Figura 1C), se buscó entonces investigar las diferencias en los predictores entre los pacientes que recidivaron de forma temprana (definidos como dentro de los 2 años posteriores al tratamiento) o posterior a la media (aquellos que recidivaron >2 años después del tratamiento). Pocos estudios en la literatura han investigado los predictores de recurrencia temprana en los meningiomas. Un estudio de Budohoski et al. identifica la localización parafalcínica, la RTS y el edema peritumoral en las imágenes radiográficas como predictores de recurrencia temprana en una cohorte de 220 meningiomas atípicos (26). Un estudio similar realizado por Maillo et al., en meningiomas de grado I de la OMS, utiliza la hibridación fluorescente in situ (FISH) interfase y las características patológicas para identificar los factores de riesgo de recidiva temprana (definida como 2,5 años después del tratamiento) y encontró que el mayor tamaño del tumor, las anomalías del cariotipo, la edad del paciente y las anomalías del cromosoma 10 se asocian con un mayor riesgo de recidiva (19). Sin embargo, los autores no tuvieron en cuenta la presencia de atipia en la patología ni el índice MIB-1. Utilizando una cohorte de pacientes con meningioma de grado I de la OMS con datos patológicos y clínicos más granulares, identificamos la extensión de la resección y la atipia nuclear en la patología como predictores independientes de recurrencia temprana en el modelo de regresión logística binaria (Tabla 5). La RPA reveló de forma similar la importancia de la extensión de la resección en la estratificación del riesgo de recurrencia temprana en los pacientes (Figura 2C). Curiosamente, también puso de manifiesto el mayor riesgo asociado a la localización del tumor falx/parasagital, lo que coincide con los hallazgos de Budohoski et al. (26). El único predictor significativo de recurrencia tumoral post-medial en el modelo de regresión logística binaria fue el índice MIB-1, aunque la localización del tumor en la fosa posterior se acercó a la significación. Esto se demostró además en la RPA (Figura 2B). Sorprendentemente, la extensión de la resección no fue un factor predictivo independiente de la recidiva posmediana, ya que la mayoría de las recidivas posmedianas se habían sometido a una RTG. Las recidivas posteriores a la mediana pueden poner de manifiesto una categoría de meningioma de grado I de la OMS que es molecularmente más agresiva y que reaparece a pesar de la RTG, dado su elevado índice MIB-1 y su localización en la fosa posterior. Las recidivas tempranas están significativamente más afectadas por la extensión de la resección y, como resultado, probablemente representan el crecimiento continuado del tumor residual en contraposición a la recidiva del tumor previo completamente resecado, como se observa en las recidivas post-medianas. Así, nuestros resultados representan potencialmente dos subtipos moleculares diferentes de meningioma de grado I de la OMS. Sin embargo, se necesitan futuros estudios con cohortes de pacientes más grandes y datos moleculares del tumor para investigar más a fondo las diferencias subyacentes en las alteraciones moleculares entre las recidivas tempranas y las posteriores a la mediana.
Limitaciones
Las limitaciones de nuestro estudio incluyen su naturaleza retrospectiva y la baja incidencia de recidiva. Nuestro estudio también incluye pacientes a partir de 2007 y, como resultado, abarca los esquemas de clasificación del SNC de la OMS de 2007 y 2016. Sin embargo, el único cambio significativo entre las dos clasificaciones fue la adición de la invasión cerebral como único criterio para el grado II de la OMS. Sólo en dos de los pacientes incluidos en nuestra cohorte se observó invasión cerebral en el análisis patológico, y ninguno de ellos recurrió. En consecuencia, no creemos que la inclusión de pacientes clasificados según el esquema de clasificación de 2007 haya tenido un impacto significativo en nuestros resultados. Además, nuestro estudio se basa en los informes patológicos posteriores a la resección inicial, sin una revisión central de los cortes patológicos. Esto puede conducir a una mayor variabilidad en las variables patológicas, como la atipia nuclear y otros hallazgos patológicos similares que pueden demostrar la variabilidad interobservador (27, 28). Sin embargo, la MIB-1 es una medida relativamente objetiva con una menor variabilidad interobservador entre patólogos que utilizan el mismo método dentro de un laboratorio de patología (29). Los patrones de práctica relativos a la prueba MIB-1 también cambiaron durante el período de estudio, pasando de la preferencia individual de los patólogos, que variaba según el patólogo, a la prueba en todos los pacientes. Los factores considerados por los patólogos a la hora de decidir sobre la prueba MIB-1 incluyeron las características atípicas incluidas en nuestro estudio, minimizando así su posible impacto en nuestros resultados. Además, todos los meningiomas incluidos en nuestro estudio son de grado I de la OMS. Como resultado, creemos que cualquier sesgo introducido en el estudio basado en estos cambios en los patrones de prácticas es mínimo. Por último, aunque incluimos características clínicas y patológicas detalladas, nuestra cohorte de pacientes carece de información sobre los cambios genéticos y moleculares del tumor, que han demostrado tener un impacto significativo en los resultados del tumor (15, 30-32). Por lo tanto, sigue siendo necesario realizar más estudios multiinstitucionales de gran tamaño con datos moleculares/genéticos además de las variables patológicas y clínicas tradicionales a la hora de predecir la recurrencia global de los meningiomas de grado I de la OMS. Esto incluye la consideración de pronosticadores moleculares/genéticos, como los patrones de metilación de todo el genoma (33, 34), las mutaciones del promotor de TERT (35) y los datos moleculares tumorales adicionales dados nuestros hallazgos, también se garantizan las investigaciones futuras sobre los predictores genéticos/moleculares, clínicos y patológicos únicos de las recurrencias tempranas y posteriores, dado el impacto potencial en la toma de decisiones terapéuticas por parte de los médicos.
No obstante, nuestro estudio proporciona una visión detallada de los predictores clínicos e histopatológicos de recurrencia, específicamente en los meningiomas de grado I de la OMS. Además, identificamos a los pacientes con un MIB-1 >4,5% como de alto riesgo de recidiva tras la RTG. También aprovechamos nuestros datos para proporcionar información sobre las diferencias entre las recidivas de meningiomas de grado I de la OMS tempranas y posteriores, identificando potencialmente diferentes subgrupos moleculares de meningiomas de grado I de la OMS. Nuestros resultados sugieren que los pacientes con un índice MIB-1 elevado y atipia nuclear en el análisis patológico, la localización de su tumor en la fosa posterior y la RTS tienen un mayor riesgo de recurrencia y deben ser considerados para un seguimiento más estrecho o incluso para la radioterapia adyuvante. Además, los pacientes con un MIB-1 superior al 4,5% tienen un riesgo de recidiva similar al de los que se han sometido a RTS de sus tumores y también deberían considerarse potencialmente para la radioterapia adyuvante.
Conclusión
Sigue habiendo una escasez de literatura sobre los predictores específicos de recidiva en los meningiomas de grado I de la OMS. Los resultados de este estudio destacan la localización del tumor en la fosa posterior, el índice MIB-1, la atipia nuclear y la extensión de la resección como factores asociados de forma independiente a la recurrencia de los meningiomas de grado I. También demostramos que los pacientes con un MIB-1 >4,5% y GTR tienen un riesgo de recurrencia similar al de los pacientes con un STR. Por último, el análisis diferencial de las recidivas tempranas y posteriores a la mediana reveló la asociación del índice MIB-1 y la localización de la fosa posterior en las recidivas posteriores a la mediana, mientras que las recidivas tempranas se vieron más afectadas por la extensión de la resección. Se necesitan estudios adicionales que validen nuestros hallazgos e incluyan datos moleculares/genéticos para identificar predictores adicionales de recurrencia en los meningiomas de grado I de la OMS. Tales estudios podrían proporcionar un marco más preciso para estratificar el riesgo de los pacientes y ayudar en la toma de decisiones terapéuticas, incluyendo el potencial de la radioterapia adyuvante.
Declaración de disponibilidad de datos
Los datos brutos que apoyan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
Los estudios que involucran a participantes humanos fueron revisados y aprobados por la Junta de Revisión Institucional de la UCSF. El consentimiento informado por escrito para la participación no fue necesario para este estudio de acuerdo con la legislación nacional y los requisitos institucionales.
Contribuciones de los autores
AH: conceptualización, metodología, análisis formal, investigación, redacción-borrador original, redacción-revisión y edición, y visualización. JY: conceptualización, metodología y redacción-revisión y edición. IK y SS: investigación. J-SC: visualización y análisis formal. DR y MM: redacción-revisión y edición. SM: revisión y redacción, conceptualización y metodología. MA: redacción-revisión y edición, y supervisión. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
El revisor BB declaró una coautoría pasada con los autores DR, MM y SM al editor de manejo.
1. Ostrom QT, Cioffi G, Gittleman H, Patil N, Waite K, Kruchko C, et al. Informe estadístico de CBTRUS: tumores cerebrales primarios y otros tumores del sistema nervioso central diagnosticados en Estados Unidos en 2012-2016. Neuro Oncol. (2019) 21:v1-100. doi: 10.1093/neuonc/noz150
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Karsy M, Guan J, Cohen A, Colman H, Jensen RL. Manejo médico de los meningiomas. Estado actual, tratamientos fallidos y horizontes prometedores. Neurosurg Clin N Am. (2016) 27:249-60. doi: 10.1016/j.nec.2015.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Brastianos PK, Galanis E, Butowski N, Chan JW, Dunn IF, Goldbrunner R, et al. Avances en la terapia multidisciplinar de los meningiomas. Neuro Oncol. (2019) 21:I18-31. doi: 10.1093/neuonc/noy136
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. La clasificación de tumores del sistema nervioso central de la Organización Mundial de la Salud de 2016: un resumen. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Pettersson-Segerlind J, Orrego A, Lönn S, Mathiesen T. Seguimiento a largo plazo de 25 años de meningiomas parasagitales tratados quirúrgicamente. World Neurosurg. (2011) 76:564-71. doi: 10.1016/j.wneu.2011.05.015
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Van Alkemade H, De Leau M, Dieleman EMT, Kardaun JWPF, Van Os R, Vandertop WP, et al. Deterioro de la supervivencia y problemas neurológicos a largo plazo en el meningioma benigno. Neuro Oncol. (2012) 14:658-66. doi: 10.1093/neuonc/nos013
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Buerki RA, Horbinski CM, Kruser T, Horowitz PM, James CD, Lukas RV. Una visión general de los meningiomas. Futur Oncol. (2018) 14:2161-77. doi: 10.2217/fon-2018-0006
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Rogers L, Barani I, Chamberlain M, Kaley TJ, McDermott M, Raizer J, et al. Meningiomas: base de conocimientos, resultados del tratamiento e incertidumbres. A RANO review. J Neurosurg. (2015) 122:4-23. doi: 10.3171/2014.7.JNS131644
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Marciscano AE, Stemmer-Rachamimov AO, Niemierko A, Larvie M, Curry WT, Barker FG, et al. Meningiomas benignos (Grado I de la OMS) con características histológicas atípicas: correlación de las características histopatológicas con los resultados clínicos. J Neurosurg. (2016) 124:106-14. doi: 10.3171/2015.1.JNS142228
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Baumgarten P, Gessler F, Schittenhelm J, Skardelly M, Tews DS, Senft C, et al. La invasión cerebral en meningiomas por lo demás benignos no predice la recurrencia del tumor. Acta Neuropathol. (2016) 132:479-81. doi: 10.1007/s00401-016-1598-1
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gousias K, Schramm J, Simon M. The simpson grading revisited: aggressive surgery and its place in modern meningioma management. J Neurosurg. (2016) 125:551-60. doi: 10.3171/2015.9.JNS15754
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Matsuno A, Fujimaki T, Sasaki T, Nagashima T, Ide T, Asai A, et al. Análisis clínico e histopatológico de los potenciales proliferativos de los meningiomas recurrentes y no recurrentes. Acta Neuropathol. (1996) 91:504-10. doi: 10.1007/s004010050458
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Oya S, Kawai K, Nakatomi H, Saito N. Significado del sistema de clasificación de Simpson en la cirugía moderna del meningioma: integración del grado con el índice de etiquetado MIB-1 como clave para predecir la recurrencia de los meningiomas de grado I de la OMS – artículo clínico. J Neurosurg. (2012) 117:121-8. doi: 10.3171/2012.3.JNS111945
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Yuzawa S, Nishihara H, Tanaka S. Genetic landscape of meningioma. Brain Tumor Pathol. (2016) 33:237-47. doi: 10.1007/s10014-016-0271-7
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karsy M, Azab MA, Abou-Al-Shaar H, Guan J, Eli I, Jensen RL, et al. Clinical potential of meningioma genomic insights: a practical review for neurosurgeons. Neurosurg Focus. (2018) 44:E10. doi: 10.3171/2018.2.FOCUS1849
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Patel AJ, Wan YW, Al-Ouran R, Revelli JP, Cardenas MF, Oneissi M, et al. Molecular profiling predicts meningioma recurrence and reveals loss of DREAM complex repression in aggressive tumors. Proc Natl Acad Sci USA. (2019) 116:21715-26. doi: 10.1073/pnas.1912858116
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Spille DC, Heß K, Sauerland C, Sanai N, Stummer W, Paulus W, et al. Invasión cerebral en meningiomas: incidencia y correlaciones con variables clínicas y pronóstico. World Neurosurg. (2016) 93:346-54. doi: 10.1016/j.wneu.2016.06.055
PubMed Abstract | CrossRef Full Text | Google Scholar
18. PiŽem J, Velnar T, Prestor B, Mlakar J, Popović M. Brain invasion assessability in meningiomas is related to meningioma size and grade, and can be improved by extensive sampling of the surgery removed meningioma specimen. Clin Neuropathol. (2014) 33:354-63. doi: 10.5414/NP300750
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Maillo A, Orfao A, Espinosa AB, Sayagués JM, Merino M, Sousa P, et al. Las recidivas tempranas en meningiomas histológicamente benignos/de grado I se asocian a tumores de gran tamaño y a la coexistencia de monosomía 14 y del(1p36) en el clon celular ancestral del tumor. Neuro Oncol. (2007) 9:438-46. doi: 10.1215/15228517-2007-026
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Youngblood MW, Duran D, Montejo JD, Li C, Omay SB, Özduman K, Sheth AH, et al. Correlación entre subgrupo genómico y características clínicas en una cohorte de más de 3000 meningiomas. J Neurosurg. (2019). doi: 10.3171/2019.8.jns191266. .
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Chen WC, Magill ST, Wu A, Vasudevan HN, Morin O, Aghi MK, et al. Características histopatológicas que predicen el control local del meningioma atípico después de la cirugía y la radioterapia adyuvante. J Neurosurg. (2019) 130:443-50. doi: 10.3171/2017.9.JNS171609
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Perry A, Stafford SL, Scheithauer BW, Suman VJ, Lohse CM. The prognostic significance of MIB-1, p53, and DNA flow cytometry in completely resected primary meningiomas. Cancer. (1998) 82:2262-9. doi: 10.1002/(SICI)1097-0142(19980601)82:11<2262::AID-CNCR23>3.0.CO;2-R
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Ohba S, Kobayashi M, Horiguchi T, Onozuka S, Yoshida K, Ohira T, et al. Resultado quirúrgico a largo plazo y factores de pronóstico biológico en pacientes con meningiomas de la base del cráneo: artículo clínico. J Neurosurg. (2011) 114:1278-87. doi: 10.3171/2010.11.JNS10701
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Soyuer S, Chang EL, Selek U, Shi W, Maor MH, DeMonte F. Radiotherapy after surgery for benign cerebral meningioma. Radiother Oncol. (2004) 71:85-90. doi: 10.1016/j.radonc.2004.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Park S, Cha YJ, Suh SH, Lee IJ, Lee KS, Hong CK, et al. Radioterapia adyuvante adaptada al grupo de riesgo para el meningioma de la base del cráneo de grado I y II de la OMS. J Cancer Res Clin Oncol. (2019) 145:1351-60. doi: 10.1007/s00432-019-02891-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Budohoski KP, Clerkin J, Millward CP, O’Halloran PJ, Waqar M, Looby S, et al. Predictors of early progression of surgery treated atypical meningiomas. Acta Neurochir. (2018) 160:1813-22. doi: 10.1007/s00701-018-3593-x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. De La Monte SM, Flickinger J, Linggood RM. Histopathologic features predicting recurrence of meningiomas following subtotal resection. Am J Surg Pathol. (1986) 10:836-43. doi: 10.1097/00000478-198612000-00002
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Backer-Grøndahl. Backer-Grøndahl T, Moen BH, Torp SH. The histopathological spectrum of human meningiomas. Int J Clin Exp Pathol. (2012) 5:231-42.
PubMed Abstract | Google Scholar
29. Rezanko T, Akkalp AK, Tunakan M, Sari AA. MIB-1 counting methods in meningiomas and agreement among pathologists. Anal Quant Cytol Histol. (2008) 30:47-52.
PubMed Abstract | Google Scholar
30. Pérez-Magán E, Campos-Martín Y, Mur P, Fiaño C, Ribalta T, García JF, et al. Alteraciones genéticas asociadas a la progresión y recurrencia en meningiomas. J Neuropathol Exp Neurol. (2012) 71:882-93. doi: 10.1097/NEN.0b013e31826bf704
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Linsler S, Kraemer D, Driess C, Oertel J, Kammers K, Rahnenführer J, et al. Determinaciones biológicas moleculares de la progresión y recurrencia del meningioma. PLoS ONE. (2014) 9:e94987. doi: 10.1371/journal.pone.0094987
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Barbera S, Miguel TS, Gil-Benso R, Muñoz-Hidalgo L, Roldán P, González-Darder J, et al. Cambios genéticos con valor pronóstico en meningiomas histológicamente benignos. Clin Neuropathol. (2013) 32:311-7. doi: 10.5414/NP300580
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Gao F, Shi L, Russin J, Zeng L, Chang X, He S, et al. Metilación del ADN en la transformación maligna de los meningiomas. PLoS ONE. (2013) 8:e54114. doi: 10.1371/journal.pone.0054114
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Vengoechea J, Sloan AE, Chen Y, Guan X, Ostrom QT, Kerstetter A, et al. Marcadores de metilación de potencial maligno en meningiomas. J Neurosurg. (2013) 119:899-906. doi: 10.3171/2013.7.JNS13311
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Lu VM, Goyal A, Lee A, Jentoft M, Quinones-Hinojosa A, Chaichana KL. The prognostic significance of TERT promoter mutations in meningioma: a systematic review and meta-analysis. J Neurooncol. (2019) 142:1-10. doi: 10.1007/s11060-018-03067-x
PubMed Abstract | CrossRef Full Text | Google Scholar