Introducción
El arroz tiene una arquitectura radicular compleja con una mezcla de raíces embrionarias y post-embrionarias. La radícula emerge primero durante la germinación, seguida poco después por las raíces coronarias embrionarias (Rebouillat et al., 2009; Coudert et al., 2010). Las primeras raíces adventicias post-embrionarias resultantes de la actividad del meristemo apical del brote aparecen unos días después de la germinación de la plántula. Las raíces adventicias también se denominan raíces coronarias o de la corona y se producen a lo largo de toda la vida de la planta.
La anatomía interna de la raíz del arroz está bien descrita, especialmente en las fases de plántula (Rebouillat et al., 2009). Entre la epidermis y los tejidos vasculares se encuentran varios tejidos concéntricos (desde la periferia hasta la estela) (Figura 1). Estos tejidos, denominados colectivamente «tejido de fondo», a veces también se denominan «corteza» (Lux et al., 2004). Aquí mantenemos el término genérico, es decir, tejido básico, para describir los tejidos exodérmico, esclerénquima, cortical y endodérmico. Nos referimos a la «corteza» como el tejido situado entre la endodermis y el esclerénquima.
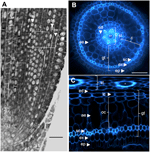
Figura 1. Anatomía de una radícula de Nipponbare de 6 días. (A) Sección longitudinal de una radícula fijada y paraplastada. Barra = 100 μm. (B) Sección transversal de una radícula fresca observada bajo luz UV. Barra = 50 μm. (C) Vista transformada polar de B. Las capas de tejidos están etiquetadas de la siguiente manera: estela (st), tejido de fondo (gt) compuesto por varias capas celulares: una capa de endodermis (ed), varias capas de corteza (c), una capa de esclerénquima (sc) y una capa de exodermis (ex). Las capas de endodermis (ed) y exodermis (ex) se identifican fácilmente por la ausencia/reducción de la fluorescencia en los centros de la pared celular de estas células. La radícula está protegida por una capa de epidermis (ep). Se pueden identificar dos tipos de capas corticales: la corteza interna (ic), que está junto a la endodermis (ed), y la corteza externa (oc), que acabará formando el aerenquima (ae). En la estela, nótese la presencia de un gran metaxilema central (cx) rodeado de 6 vasos metaxilemáticos (x).
El tejido del suelo está compuesto por varias capas de tejidos que tienen el mismo origen parenquimatoso pero diferentes características específicas que desempeñan diversos e importantes papeles estructurales y funcionales en las raíces. Por ejemplo, la exodermis y la endodermis son barreras apoplásticas que controlan el transporte radial de agua y nutrientes desde el suelo hasta los órganos fotosintéticos, una característica proporcionada principalmente por la deposición de láminas de suberina y la diferenciación de la pared celular secundaria (Gregory, 2006). Los esclerénquimas son células lignificadas que representan una barrera crítica para algunos metales y posiblemente desempeñan un papel de soporte mecánico (Huang et al., 2012). En contraste con estos tres tejidos monocapa, el tejido cortical de la radícula de arroz está compuesto por cuatro o cinco capas. Este tejido, también llamado córtex medio o mesodermis, se caracteriza por la formación esquizoide de espacios, lo que lleva a la formación de aerénquima en el arroz (Justin y Armstrong, 1991; Kawai et al., 1998). El aerenquima juega un papel importante en la tolerancia a las condiciones de inundación y asegura el flujo continuo de oxígeno desde el brote a la raíz, permitiendo el crecimiento de la raíz en condiciones anóxicas. La corteza tiene una función importante pero variable en la fisiología de las raíces de numerosas especies y está implicada en el almacenamiento, la tolerancia a la inundación o las interacciones simbióticas (Lux et al., 2004).
La radícula y las raíces de la corona producen tres tipos de raíces laterales: pequeñas raíces laterales (SLR) y dos tipos de grandes raíces laterales (Kawata y Shibayama, 1965; Kono et al., 1972; Rebouillat et al., 2009). Esta división se basa en (i) el diámetro de la raíz: Las SLR son las más pequeñas (50-60 μm) y las L-LLR son las más grandes (120-150 μm), (ii) las ramificaciones, que solo se observan en las LLR, (iii) la presencia de un vaso metaxilemático central solo en las LLR, y (iv) la presencia de una capa de esclerénquima solo en las L-LLR (Kono et al., 1972; Kawata et al., 1977; Rebouillat et al., 2009). A pesar de esta clasificación, la identidad de los tejidos internos de la raíz en las raíces laterales, especialmente en las SLR, sigue siendo incierta. De hecho, Rebouillat et al. (2009) y Kawata et al. (1977) afirmaron que el tejido del suelo de las SLR estaba compuesto por la endodermis, el esclerénquima y la exodermis (desde el interior hacia el exterior), mientras que en Kono et al. (1972), la capa celular esclerénquimatica de la corteza interna se describió como ausente en los SLR y los T-LLR.
Para resolver este dilema, y para estudiar el desarrollo y la función de tejidos particulares en general, se requiere el uso de marcadores de identidad. La mayoría de los marcadores tisulares utilizados hasta ahora son marcadores morfológicos o tinciones histoquímicas, que han proporcionado una forma útil de caracterizar la identidad celular. La berberina revela la presencia de suberina en las paredes celulares, que se encuentra casi exclusivamente en las tiras de Casparian que rodean cada célula individual de la endodermis y es, por tanto, un buen marcador indirecto de la identidad endodérmica (Brundett et al., 1988). En A. thaliana, también se desarrollaron marcadores específicos de tejido utilizando promotores específicos de tejido fusionados a genes reporteros (GUS y/o GFP) en plantas modificadas genéticamente. Por ejemplo, el promotor SCARECROW se utiliza como marcador de identidad endodérmica (Sugimoto et al., 2010). Las líneas GUS con trampa de potenciadores QC25 y QC46 (Sabatini et al., 2003) y QHB en arroz (Kamiya et al., 2003) también se identificaron como marcadores del centro quiescente (QC) en función de su expresión específica del QC. A pesar del interés por estos marcadores, sólo se dispone de unos pocos y casi exclusivamente en A. thaliana. También tienen inconvenientes. Por ejemplo, la idoneidad de utilizar el promotor SCARECROW (SCR) como marcador de «endodermis» es discutible cuando se abordan cuestiones específicas sobre las funciones de SCR y SHORT ROOT (SHR) en la diferenciación del tejido del suelo. De hecho, los genes SCR y SHR están implicados per se en la formación de la endodermis/corteza (Wu y Gallagher, 2014). En A. thaliana, los únicos marcadores de corteza radicular disponibles son los promotores Co2 y Co3 (Heidstra et al., 2004; Ten Hove et al., 2010). En el arroz, estos marcadores de corteza no se utilizan todavía porque no hay ortólogos claros para los genes Co2 y Co3. Hasta la fecha sólo se han utilizado marcadores morfológicos indirectos en el arroz, como la formación de aerenquima para la identidad cortical (Rebouillat et al., 2009).
Otra clase de marcadores son los anticuerpos disponibles comercialmente dirigidos contra las paredes celulares de las plantas (http://www.plantprobes.net/index.php). Estos marcadores se han utilizado escasamente en el pasado, pero se ha demostrado su eficacia. Por ejemplo, los anticuerpos contra la pared celular CCRC-M2 y JIM13 se utilizaron en A. thaliana para demostrar que la única capa de tejido interno presente en el mutante shr tenía identidad cortical, mientras que la capa de tejido de tierra del mutante scr presentaba identidades múltiples (Di Laurenzio et al., 1996; Helariutta et al., 2000). Estos marcadores tienen muchas ventajas: su simplicidad y la posibilidad de combinar anticuerpos secundarios acoplados a diferentes fluorocromos para limitar el solapamiento con la autofluorescencia, no requieren transformación genética y pueden utilizarse para complementar otras clases de marcadores.
En este trabajo, describimos en primer lugar un protocolo sencillo de rendimiento medio para el inmune-etiquetado de secciones de tejido fresco de vibratome. Utilizando este protocolo, examinamos secciones radiales de radículas de arroz con una gran biblioteca de 174 anticuerpos de pared celular. Entre ellos, identificamos ocho marcadores específicos de la corteza y demostramos que el arroz posee dos tipos de tejidos corticales con una identidad distinta. Llamamos a estas capas corteza interna y externa en base a su respectiva posición anatómica en las secciones de la raíz. Para demostrar la utilidad de estos marcadores específicos de la corteza, aclaramos las identidades de los tejidos del suelo de las raíces laterales utilizando tres de estos anticuerpos. En las SLR, en particular, demostramos que la capa de tejido interno tiene una identidad cortical externa. Nuestro protocolo es lo suficientemente genérico como para ser utilizado para el desarrollo de marcadores de tejido en cualquier especie sin necesidad de generar plantas transgénicas. Este protocolo se puede adaptar fácilmente con brotes frescos, hojas, raíces o cualquier tejido de otras plantas y representa una forma sencilla y fácil de identificar marcadores específicos de tejido. Además, estos marcadores pueden utilizarse junto con otros marcadores moleculares.
Resultados
El inmunoprofilado de anticuerpos de la pared celular en secciones radiales de la raíz de arroz revela anticuerpos específicos para las capas de la corteza
Con el objetivo de identificar marcadores basados en anticuerpos para las células corticales, primero establecimos un protocolo para el inmunoetiquetado de rendimiento medio de secciones radiales de raíces frescas de arroz (ver Materiales y Métodos y Figura Suplementaria 1 para más detalles). A continuación, realizamos un cribado con anticuerpos monoclonales contra componentes de la pared celular (del Centro de Investigación de Carbohidratos Complejos (CarboSource Services, Athens Georgia, EE.UU.) y del laboratorio de Paredes Celulares de Paul Knox (Universidad de Leeds, Reino Unido), ver Materiales y Métodos para más detalles)) para identificar marcadores de corteza. De los 174 anticuerpos probados, sólo 12 fueron retenidos como putativamente específicos de la corteza. Probamos su repetibilidad realizando dos experimentos adicionales y concluimos que ocho anticuerpos mostraban perfiles similares y robustos entre las tres réplicas (Figura 2). Cinco anticuerpos (JIM7, M14, M38, M130 y M131) proporcionaron el mismo patrón de inmunoetiquetado en la corteza. Sólo se marcaron las paredes celulares no adyacentes, lo que dio lugar a un etiquetado singular en «forma de diamante» de todas las células corticales. En el caso de los otros tres anticuerpos (LM5, M133 y M107), el etiquetado se detectó en la corteza y a veces en las células del esclerénquima, especialmente con los anticuerpos LM5 y M107. La señal era homogénea en la pared celular de la corteza, pero era mucho más débil en las capas internas de la corteza (la capa de la corteza adyacente a la capa endodérmica) que en las capas externas de la corteza. Así pues, todos estos anticuerpos con perfiles complementarios a los tejidos corticales son marcadores específicos que pueden utilizarse para analizar la identidad de las células corticales. Además, las dos etiquetas corticales diferentes, que definen dos áreas subcorticales, sugieren que las capas externas e internas tienen una identidad molecular distinta que fue revelada por estos anticuerpos.
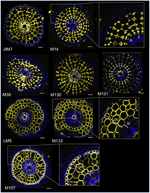
Figura 2. Identificación de ocho anticuerpos específicos de la corteza (JIM7, M14, M38, M130, M131, LM5, M133 y M107) entre los 174 examinados de la biblioteca de anticuerpos monoclonales de la pared celular. Para cada anticuerpo, se obtuvieron imágenes fusionadas de secciones transversales bajo un microscopio confocal después del etiquetado inmunohistológico: en amarillo, patrón del anticuerpo a 561 nm, y en azul, autofluorescencia de la pared celular bajo luz UV. Cinco anticuerpos (JIM7, M14, M38, M130 y M131) muestran un perfil similar en todas las capas celulares corticales teñidas (formas de diamante). Tres anticuerpos (LM5, M133 y M107) marcaron homogéneamente las paredes celulares corticales. Obsérvese que para estos anticuerpos, las capas corticales internas (ic) no se tiñen en comparación con las capas corticales externas (oc). Los recuadros son primeros planos de las imágenes correspondientes. Barras = 20 μm.
Algunas características específicas de estas dos capas subcorticales se destacaron cuando se utilizó el plugin «transformador polar» del software ImageJ (http://imagej.nih.gov/ij/) para ver las imágenes de las secciones de la raíz (Figuras 1B,C; Schneider et al., 2012; Lartaud et al., 2014). Las células internas se caracterizaban por una pared celular gruesa en comparación con las células externas, que mostraban varias cavidades que contenían aire como resultado de la fusión de la pared celular. Las células corticales internas también mostraban una forma aplanada que se asemejaba a las células endodérmicas, en contraste con las células externas, que eran más redondas. En esta imagen transformada, la pared celular radial que va desde el lado interno de la célula hasta el lado externo, la autofluorescencia de las células endodérmicas y exodérmicas no son visibles, presumiblemente debido a la presencia de tiras de Casparian. Del mismo modo, pero en menor medida, también eran visibles pequeños agujeros exentos de autofluorescencia en las paredes celulares radiales de las células corticales internas.
Todos los tipos de raíz lateral poseen sólo tejido cortical externo
Para demostrar la utilidad de los marcadores de corteza y caracterizar las identidades celulares, etiquetamos los tres tipos de raíz lateral de arroz (L-LLR, T-LLR y SLR) con tres de estos anticuerpos (M107, M133 y M14). Para este experimento, dado que las L-LLR no suelen desarrollarse en placas de Petri, se recogieron raíces laterales de plántulas de arroz cultivadas en condiciones hidropónicas durante 2 semanas. Primero analizamos la organización del tejido del suelo de cada tipo de raíz lateral observando la autofluorescencia de las paredes celulares en las vistas transversal y polar de las secciones de la raíz (Figura 3). Este primer análisis reveló una anatomía radial interna ligeramente distinta para los tres tipos de raíces laterales. Al igual que en las secciones de la radícula vistas bajo luz UV, los tejidos endodérmico y exodérmico pueden identificarse por la extinción de la fluorescencia en el centro de las paredes celulares radiales. Estos dos tejidos estaban presentes en todas las raíces laterales. Entre la endodermis y la exodermis, había varias capas de tejido en las L-LLR y las T-LLR, mientras que las SLR sólo tenían una capa celular (no identificada). La anatomía de los L-LLR se asemejaba a la de las raíces seminales y, fuera de la endodermis, se identificaban fácilmente varias capas de tejido cortical cuando se formaba el tejido aerenquimático. Además, también se observó una capa de esclerénquima formada por células estrechamente empaquetadas con paredes celulares anchas. Dependiendo del experimento, esta capa celular no siempre estaba completamente desarrollada. En las secciones del T-LLR, la capa externa se parecía al tejido cortical y la capa interna a la capa única (no identificada) del SLR.
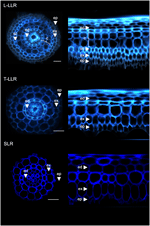
Figura 3. Composición tisular de los tipos de raíz lateral grande (Large-LLR y Thin-LLR) y de la raíz lateral pequeña (SLR). Las plántulas se cultivaron en condiciones hidropónicas durante 2 semanas. Autofluorescencia de la pared celular de secciones transversales y vista transformada polar bajo luz UV. Los tejidos están etiquetados como sigue: epidermis (ep), exodermis (ex), corteza (c), endodermis (ed). Obsérvese que la epidermis (ep) se fragmentó a menudo durante el transcurso del experimento. Barras = 20 μm.
Para identificar las capas celulares presentes en los tejidos del suelo del SLR y del T-LLR y para confirmar la identidad cortical en los L-LLR, inmunomarcamos secciones de raíces laterales con tres anticuerpos específicos de la corteza (M107, M133 y M14; Figura 4). Los anticuerpos M107 y M133 marcaron todas las capas celulares situadas entre la endodermis y la exodermis en todas las raíces laterales. Basándose en la tinción de la radícula para estos anticuerpos, esta observación indicaba que estas capas celulares podían tener identidad esclerénquica o cortical. Sin embargo, el hecho de que M14 también inmunomarcase estas capas, particularmente en las secciones SLR, demuestra claramente que estas capas tenían identidad cortical externa.

Figura 4. Imágenes fusionadas de los tipos de raíz lateral grande (Large-LLR y Thin-LLR) y secciones de raíz lateral pequeña (SLR) inmunomarcadas con M107, M133 y M14. Las plántulas se cultivaron en condiciones hidropónicas durante 2 semanas. En amarillo, etiquetado de anticuerpos a 561 nm, y en azul, autofluorescencia bajo luz UV. Los tejidos están etiquetados como sigue: epidermis (ep), exodermis (ex), corteza (c), endodermis (ed). Obsérvese que la epidermis (ep) se fragmentó a menudo en el transcurso del experimento. Barras = 20 μm.
Las variaciones en el número de capas celulares corticales externas (una en las SLR, dos en las T-LLR, tres en las L-LLR y de cuatro a cinco en la radícula) desempeñan un papel importante en los diámetros de las raíces de arroz (Figura 5).
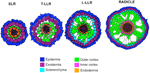
Figura 5. Representación esquemática de los tejidos de la raíz lateral y de la radícula.
Conclusiones
Ya se han utilizado diferentes términos para calificar las zonas subcorticales en las plantas. Por ejemplo, la presencia de una capa de corteza lignificada «interna», comparable a la estudiada aquí, ya se ha descrito en el arroz silvestre (Yang et al., 2014). En el maíz, los dos dominios corticales se definen de forma diferente (Baluška et al., 1993). El dominio «interno» forma el aerenquima, que corresponde aquí a la corteza externa, y la corteza «media-externa» es un tejido de soporte lignificado, que podría ser el esclerénquima. En Arabidopsis, también se ha descrito una capa celular de «corteza media», situada entre la monocapa cortical y la endodermis (Baum et al., 2002; Paquette y Benfey, 2005). Resultados recientes sugieren que esta capa cortical, cuya formación está regulada por GA, estrés oxidativo y SHR y SCR entre otros, juega un papel en la tolerancia abiótica (Paquette y Benfey, 2005; Cui y Benfey, 2009; Pauluzzi et al., 2012; Wu y Gallagher, 2014). Curiosamente, esta capa también se describe como una capa en forma de hélice con una forma típica (Baum et al., 2002). ¿Podría esta capa de «corteza media» de Arabidopsis ser funcional y estructuralmente similar a la capa de corteza interna de la radícula de arroz? En las secciones longitudinales y transversales del arroz, la capa cortical interna también suele formar una hélice, lo que sugiere que estas dos capas de tejido podrían ser comparables. En Arabidopsis, la capa de «corteza media» deriva de una división periclinal de la endodermis, que aparece alejada del QC entre 7 y 14 días después de la germinación (Paquette y Benfey, 2005). Serán necesarias nuevas herramientas para verificar estos importantes parámetros en el arroz. Por ejemplo, hasta ahora no se ha descrito ningún mutante que afecte al momento de formación de esta capa. Además, también son necesarios avances técnicos en la obtención de imágenes del QC del arroz. No obstante, nuestros marcadores específicos de la corteza ofrecen una nueva herramienta para comparar la función y la red molecular implicada en la formación de la corteza interna (arroz) frente a la «corteza media» (Arabidopsis). Se está trabajando en nuestro laboratorio para identificar los determinantes moleculares de la formación de la corteza interna y externa, con los ortólogos de arroz SCR y SHR como primeros candidatos para la regulación de la formación de la corteza en las raíces de arroz (Pauluzzi et al., 2012).
Materiales y métodos
Material vegetal
Semillas de seis días
Semillas de la especie Oryza sativa L. ssp. japonica Nipponbare se cultivaron verticalmente en placas de Petri estériles (Corning, 431301; 20 × 20 cm) en condiciones controladas (ritmo día/noche: 12/12 h, 28/25°C, intensidad luminosa: 500 μE m-2 s-1). En primer lugar, las semillas se esterilizaron superficialmente mediante un enjuague en etanol al 70% durante ~1 minuto. A continuación, se sustituyó el etanol por una solución compuesta de lejía al 40% en agua destilada que contenía tres gotas de tween 80 (Sigma-Aldrich P4780-500 mL). Las semillas se sumergieron en esta solución durante 30 minutos con una agitación suave, y luego se enjuagaron al menos cuatro veces con agua destilada estéril. Se vierte el medio Murashige y Skoog (MS/2) esterilizado en autoclave y caliente (~50°C) (250 mL) en placas de Petri, y se deja solidificar durante ~45 min. El medio sólido MS/2 está compuesto por 2,15 g.L-1 de mezcla de sales basales del medio MS (Duchefa Biochemie, M0221), 75 mg.L-1 de mezcla de vitaminas MS (Duchefa Biochemie, M0409) y 8 g.L-1 de agarosa tipo II (Sigma-Aldrich, A6877). Las semillas estériles se introducen en el medio MS/2 solidificado con la radícula orientada hacia abajo. Las raíces se cosecharon después de 6 días de crecimiento.
Plantas de cuatro semanas
Tras 3 días de germinación en agua, las plántulas se transfirieron a un sistema hidropónico en condiciones controladas (ritmo día/noche: 12/12 h, 28/25°C, intensidad luminosa: 500 μE m-2 s-1, humedad relativa: 55%). El sistema hidropónico consiste en una caja de plástico de 50 L que contiene 30 L de solución hidropónica sobre la que se coloca un colchón de espuma de 1 cm de espesor. El colchón de espuma está perforado con huecos para mantener las bases de los tallos de las plántulas. El medio hidropónico está compuesto por (NH4)2SO4 (0,5 mM), MgSO4.7H2O (1,6 mM), Ca(NO3)2.4H2O (1,2 mM), KNO3 (0,7 mM), FeSO4 (0,1 mM), Na2EDTA (0,1 mM), MnSO4. H2O (1,7 μM), (NH4)6Mo7O24.4H2O (0,2 μM), ZnSO4.7H2O (0,2 μM), CuSO4.5H2O (0,2 μM), H3BO3 (1,4 μM) y KH2PO4 (0,6 mM). La solución se airea mediante una bomba colocada en el fondo de la caja de plástico y se cambia cada 10 días. El pH se ajustó y se mantuvo en 5,4 ± 0,2.
Seccionamiento de raíces frescas
Las puntas de las radículas en crecimiento o de las raíces laterales (2 cm) se cortaron con una cuchilla afilada y se colocaron en paralelo para alinear las puntas de las raíces (Figuras suplementarias 1A,B). Se incrustaron en una gota de agarosa fundida al 3% (50°C; Figura suplementaria 1C). Los parches que contenían las puntas de las raíces se insertaron en un pozo de 3 × 1 × 1 cm lleno de agarosa fundida al 3% (Figura suplementaria 1D). Tras la solidificación, los bloques se redimensionaron y se pegaron en una placa de vibratomo para ser cortados. Los parámetros del vibratomo (Hm650v (Thermo Scientific Microm)) fueron velocidad 30, frecuencia 70, amplitud 0,8 y espesor 60 μm (Figura suplementaria 1E). Las secciones se transfirieron a portaobjetos de cámara (Lab-teak 177402) para la inmunotinción (Figura suplementaria 1F), o a portaobjetos humedecidos con tampón de fosfato alcalino 1X (PBS, Sigma-Aldrich P3813) para su observación.
Inmunolocalización
Las secciones colocadas en los portaobjetos de cámara (tres por cámara) se enjuagaron primero en glicina 0,1 M complementada con PBS 1X y luego dos veces en PBS 1X, cada una de ellas durante 10 min. A continuación, los tejidos se sumergieron en una solución de PBS que contenía un 5% de suero fetal bovino (solución de bloqueo, Thermo Fisher 37520) a 4°C durante toda la noche bajo agitación. Los anticuerpos primarios, diluidos 1/10 en esta solución de bloqueo, se aplicaron durante la noche a 4°C bajo agitación. Las secciones se enjuagaron 3 veces en PBS 1X durante 10 minutos. Las secciones de la raíz se incubaron durante 2 h con el anticuerpo secundario diluido 500 veces en la solución de bloqueo bajo agitación. Estos anticuerpos se acoplaron a un fluoróforo, el anticuerpo Alexa 546 anti-rata (Invitrogen A11081) o el anticuerpo Alexa 546 anti-ratón (Invitrogen A11060). A continuación, las secciones se volvieron a enjuagar tres veces en 1X PBS bajo agitación, durante 10 minutos cada una. Se retiraron las cámaras y se añadieron unas gotas de medio de montaje mowiol (Sigma-Aldrich 81381). Se colocó un cubreobjetos sobre las secciones de raíz, que se dejaron secar durante 36 h a 4°C en la oscuridad.
Fijación con paraplast
Las raíces cultivadas en placas de Petri durante 6 días se fijaron en paraformaldehído al 4% (en PBS 1X) durante la noche a 4°C y se enjuagaron dos veces con PBS 1X (Jackson, 1991). Los tejidos fijados se deshidrataron en etanol, se aclararon en Histochoice Clearing Agent (HistoClear, Sigma Aldrich) y se incrustaron en Paraplast (Fisher). Los tejidos se seccionaron (6 μm de grosor) en un microtomo Leica RM2255 y se montaron en portaobjetos SuperfrostPlus (Fisher).
Microscopía
Las observaciones de campo claro y de autofluorescencia se realizaron con un microscopio Leica DM4500. Para la autofluorescencia, se tomaron imágenes con el cubo de filtros «A» (rango de excitación: UV; filtro de excitación: BP 340-380; filtro de supresión: LP 425). Las secciones inmunotinadas se observaron con microscopios confocales: Zeiss LSM 510 o Leica SP8. Las paredes celulares se visualizaron primero mediante autofluorescencia. El anticuerpo secundario se visualizó utilizando un láser de Helio/Neón a 543 o 561 nm respectivamente. Las imágenes se tomaron con una cámara Retiga 2000R en color (QIMAGING, Canadá) con el software de adquisición de imágenes Volocity (Improvision, Reino Unido).
Contribuciones de los autores
SH, FD, MB, CB: adquisición de datos; SH, CP, AD análisis de datos; SH, EG, CP, AD: redacción del manuscrito.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Damos las gracias a MRI (Montpellier RIO Imaging plateform), PHIV y La Gaillarde Plateforms por su apoyo técnico para la inmunolocalización y/o la imagen confocal y multifotónica. SH cuenta con el apoyo de una beca de doctorado del CIRAD.
Material complementario
El material complementario de este artículo puede encontrarse en línea en: https://www.frontiersin.org/article/10.3389/fpls.2015.01139
Abreviaturas
ae, aerénquima; c, córtex; ed, endodermis; ep, epidermis; ex, exodermis; gt, tejido de fondo; ic, córtex interno; L-LLR, raíz lateral grande; oc, corteza externa; sc, esclerénquima; SLR, raíz lateral pequeña; st, estela; T-LLR, raíz lateral grande fina; x, xilema.
Baluška, F., Brailsford, R. W., Hauskrecht, M., Jackson, M. B., y Barlow, P. W. (1993). Cellular dimorphism in the maize root cortex: involvement of microtubules, ethylene and gibberellin in the differentiation of cellular behaviour in postmitotic growth zones. Bot. Acta 106, 394-403. doi: 10.1111/j.1438-8677.1993.tb00766.x
CrossRef Full Text | Google Scholar
Baum, S. F., Dubrovsky, J. G., and Rost, T. L. (2002). Organización apical y maduración de la corteza y el cilindro vascular en las raíces de Arabidopsis thaliana (Brassicaceae). Am. J. Bot. 89, 908-920. doi: 10.3732/ajb.89.6.908
PubMed Abstract | CrossRef Full Text | Google Scholar
Brundett, M. C., Enstone, D. E., and Peterson, C. A. (1988). A Berberine-aniline blue fluorescent staining procedure for suberin, lignin, and callose in plant tissue. Protoplasma 146, 133-142. doi: 10.1007/BF01405922
CrossRef Full Text | Google Scholar
Coudert, Y., Périn, C., Courtois, B., Khong, N. G., and Gantet, P. (2010). Genetic control of root development in rice, the model cereal. Trends Plant Sci. 15, 219-226. doi: 10.1016/j.tplants.2010.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., and Benfey, P. N. (2009). Interplay between SCARECROW, GA and LIKE HETEROCHROMATIN PROTEIN 1 in ground tissue patterning in the Arabidopsis root. Plant J. 58, 1016-1027. doi: 10.1111/j.1365-313X.2009.03839.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Laurenzio, L., Wysocka-Diller, J., Malamy, J. E., Pysh, L., Helariutta, Y., Freshour, G., et al. (1996). The SCARECROW gene regulates an asymmetric cell division that is essential for generating the radial organization of the Arabidopsis root. Cell 86, 423-433. doi: 10.1016/S0092-8674(00)80115-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Gregory, P. J. (2006). Plant Roots: Growth, Activity, and Interaction with Soils. Oxford; Ames, IA: Blackwell Pub.
Google Scholar
Heidstra, R., Welch, D., y Scheres, B. (2004). Mosaic analyses using marked activation and deletion clones dissect Arabidopsis SCARECROW action in asymmetric cell division. Genes Dev. 18, 1964-1969. doi: 10.1101/gad.305504
PubMed Abstract | CrossRef Full Text | Google Scholar
Helariutta, Y., Fukaki, H., Wysocka-Diller, J., Nakajima, K., Jung, J., Sena, G., et al. (2000). The SHORT-ROOT gene controls radial patterning of the Arabidopsis root through radial signaling. Cell 101, 555-567. doi: 10.1016/S0092-8674(00)80865-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, C. F., Yamaji, N., Ono, K., and Ma, J. F. (2012). A leucine-rich repeat receptor-like kinase gene is involved in the specification of outer cell layers in rice roots. Plant J. 69, 565-576. doi: 10.1111/j.1365-313X.2011.04824.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, D. (1991). «In-situ hybridization in plants» en Molecular Plant Pathology: A Practical Approach, eds D. J. Bowles, M. McPherson, and S. J. Gurr (Totowa, NJ: Humana Press), 163-174.
Google Scholar
Justin, S. H. F. W., and Armstrong, W. (1991). Evidence for the involvement of ethylene in aerenchyma formation in adventitious roots of rice (Oryza sativa L.). New Phytol. 118, 49-62. doi: 10.1111/j.1469-8137.1991.tb00564.x
CrossRef Full Text | Google Scholar
Kamiya, N., Nagasaki, H., Morikami, A., Sato, Y., and Matsuoka, M. (2003). Isolation and characterization of a rice WUSCHEL-type homeobox gene that is specifically expressed in the central cells of a quiescent center in the root apical meristem. Plant J. 35, 429-441. doi: 10.1046/j.1365-313X.2003.01816.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kawai, M., Samarajeewa, P. K., Barrero, R. A., Nishiguchi, M., and Uchimiya, H. (1998). Cellular dissection of the degradation pattern of cortical cell death during aerenchyma formation of rice roots. Planta 204, 277-287. doi: 10.1007/s004250050257
CrossRef Full Text | Google Scholar
Kawata, S., Sasaki, O., y Yamazaki, K. (1977). Sobre la estructura de la raíz de la corona y la raíz lateral, y la conexión de los vasos entre ellos, en las plantas de arroz. Jpn. J. Crop. Sci. 46, 569-579. doi: 10.1626/jcs.46.569
CrossRef Full Text | Google Scholar
Kawata, S., and Shibayama, B. (1965). On the lateral root primordia formation in the crown roots of rice plant. Proc. Crop Sci. Soc. Jpn. 33, 423-431. doi: 10.1626/jcs.33.423
CrossRef Full Text | Google Scholar
Kono, Y., Igeta, M., y Yamada, N. (1972). Estudios sobre la fisiología del desarrollo de las raíces laterales en las raíces seminales del arroz. Jpn. J. Crop. Sci. 41, 192-204. doi: 10.1626/jcs.41.192
CrossRef Full Text
Lartaud, M., Perin, C., Courtois, B., Thomas, E., Henry, S., Bettembourg, M., et al. (2014). PHIV-RootCell: una herramienta de análisis de imágenes supervisada para la cuantificación de parámetros anatómicos de la raíz del arroz. Front. Plant Sci. 5:790. doi: 10.3389/fpls.2014.00790
PubMed Abstract | CrossRef Full Text | Google Scholar
Lux, A., Luxova, M., Abe, J., y Morita, S. (2004). Root cortex: structural and functional variability and responses to environmental stress. Root Res. 13, 117-131. doi: 10.3117/rootres.13.117
CrossRef Full Text | Google Scholar
Paquette, A. J., and Benfey, P. N. (2005). La maduración del tejido del suelo de la raíz está regulada por la giberelina y por la escarcha y requiere de la raíz corta. Plant Physiol. 138, 636-640. doi: 10.1104/pp.104.058362
PubMed Abstract | CrossRef Full Text | Google Scholar
Pauluzzi, G., Divol, F., Puig, J., Guiderdoni, E., Dievart, A., and Périn, C. (2012). Navegando a lo largo de la red de genes del tejido del suelo de la raíz. Dev. Biol. 365, 14-22. doi: 10.1016/j.ydbio.2012.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rebouillat, J., Dievart, A., Verdeil, J., Escoute, J., Giese, G., Breitler, J., et al. (2009). Molecular genetics of rice root development. Rice 2, 15-34. doi: 10.1007/s12284-008-9016-5
CrossRef Full Text | Google Scholar
Sabatini, S., Heidstra, R., Wildwater, M., and Scheres, B. (2003). SCARECROW está implicado en el posicionamiento del nicho de células madre en el meristemo de la raíz de Arabidopsis. Genes Dev. 17, 354-358. doi: 10.1101/gad.252503
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, C. A., Rasband, W. S., and Eliceiri, K. W. (2012). De NIH Image a ImageJ: 25 años de análisis de imágenes. Nat. Methods 9, 671-675. doi: 10.1038/nmeth.2089
PubMed Abstract | CrossRef Full Text | Google Scholar
Sugimoto, K., Jiao, Y., and Meyerowitz, E. M. (2010). Arabidopsis regeneración de múltiples tejidos se produce a través de una vía de desarrollo de la raíz. Dev. Cell 18, 463-471. doi: 10.1016/j.devcel.2010.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Ten Hove, C. A., Willemsen, V., de Vries, W. J., Van Dijken, A., Scheres, B., and Heidstra, R. (2010). SCHIZORIZA codifica un factor nuclear que regula la asimetría de las divisiones de las células madre en la raíz de Arabidopsis. Curr. Biol. 20, 452-457. doi: 10.1016/j.cub.2010.01.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., and Gallagher, K. L. (2014). El movimiento del factor de transcripción no autónomo de la célula, SHORT-ROOT depende del sistema de endomembranas. Plant J. 80, 396-409. doi: 10.1111/tpj.12640
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Zhang, X., Li, J., Bao, M., Ni, D., y Seago, J. L. (2014). Anatomía e histoquímica de las raíces y los brotes del arroz silvestre (Zizania latifolia Griseb.). J. Bot. 2014, 9. doi: 10.1155/2014/181727
CrossRef Full Text | Google Scholar