US Pharm. 2012;37(5):HS-2-HS-7.
El dolor es la razón más común por la que las personas buscan atención médica.1Un estudio reciente estima que el dolor afecta a decenas de millones de estadounidenses y cuesta a los Estados Unidos 635 mil millones de dólares al año debido al aumento del consumo de atención médica y a los costes indirectos derivados de los días de trabajo perdidos y la pérdida de productividad.2 El tratamiento del dolor crónico con medicamentos como los opioides es una estrategia común, pero el dolor crónico puede persistir o empeorar a pesar de la terapia agresiva con opioides. Este artículo pretende arrojar luz sobre el fenómeno de los opiáceos que se recetan para tratar el dolor pero que provocan un dolor nuevo o que empeora paradójicamente. La OIH puede definirse más formalmente como un aumento de la sensibilización nociceptiva causado por la exposición a los opioides.3 La OIH difiere de la tolerancia, la adicción, la dependencia y la progresión de la enfermedad. Se desconoce la prevalencia clínica de la OIH.4
Diagnóstico y presentación
Uno de los principales problemas para diagnosticar correctamente la OIH es su gran parecido con la tolerancia a los opioides. La tolerancia y la OIH comparten la característica de una respuesta analgésica reducida a la dosis de opiáceos, y probablemente comparten muchos de los mismos mecanismos celulares.5 La tolerancia puede superarse aumentando la dosis de opiáceos, mientras que el mismo aumento en un paciente con OIH da lugar a un empeoramiento del dolor.4 Además, la tolerancia tiende a desarrollarse lentamente con el tiempo, mientras que el aumento del dolor resultante del tratamiento con opiáceos en el paciente con OIH se produce con relativa rapidez. A menudo, la OIH difiere de la tolerancia en que la intensidad del dolor es mayor de lo que se había informado inicialmente.6
El dolor subtratado es otra posibilidad que debe descartarse. Si el tratamiento con opiáceos no es óptimo, el aumento de la dosis debería conducir al alivio del dolor; si la OIH está presente, debería ocurrir lo contrario. Para que el diagnóstico de la OIH sea preciso, el dolor debe resolverse una vez que se interrumpa el tratamiento con el opioide infractor.6 Para complicar aún más las cosas, la hiperalgesia resultante de la abstinencia de opioides es un fenómeno bien documentado.7 Como tal, la resolución del dolor tras la interrupción de los opioides en la OIH no será inmediata y requerirá paciencia. Esto plantea sus propios retos tanto para el clínico como para el paciente.
La OIH tiende a presentarse con otras características distintas (TABLA 1).El dolor asociado a la OIH tiende a ser más difuso y de menor calidad, y los estímulos nocivos tienden a ser más dolorosos de lo que normalmente se esperaría. En la OIH, el dolor suele manifestarse en zonas que se extienden más allá de la región de la lesión o del daño tisular. El dolor puede persistir en la OIH a pesar de la eliminación de la fuente original de dolor o de la curación del tejido dañado. En la OIH, a medida que avanza el tratamiento con opiáceos, el dolor puede dar la impresión de empeorar más de lo que se había informado originalmente, a pesar del tiempo, el descanso y otras medidas que normalmente permitirían una curación clínicamente relevante.5 Además, se ha demostrado la existencia de alodinia en varios estudios sobre la OIH en humanos y animales.8

Etiología
Existen varias teorías sobre la causa de la OIH. La teoría que más se ha investigado y que más atención está recibiendo actualmente es el modelo neuroexcitatorio. Se cree que ciertos opioides y sus metabolitos agonizan el receptor de N-metil-D-aspartato (NMDA). La activación del receptor NMDA provoca una afluencia de calcio que aumenta considerablemente la excitabilidad de la neurona. Cuando el receptor NMDA y las neuronas correspondientes están más activos, pueden transmitir más fácilmente los impulsos dolorosos iniciados por la sustancia circulante Por otros estímulos nocivos. El glutamato es el principal agonista endógeno del receptor NMDA.9
Apoyando esta teoría de la pronocicepción modulada por la activación del receptor NMDA hay estudios que muestran el alivio de la OIH tras la administración de antagonistas del receptor NMDA. Estos antagonistas se unen de forma no competitiva al sitio de la fenciclidina en el canal NMDA y bloquean la afluencia de calcio que se produciría cuando el receptor se une al glutamato o a otro agonista.10 Los estudios en animales y humanos han demostrado que los sujetos con OIH a los que se les administró ketamina, un antagonista de los receptores NMDA, obtuvieron mejores resultados durante las pruebas de estímulo del dolor controlado. En un estudio, se administraron inyecciones de morfina intratecal a ratas durante varios días hasta que mostraron una OIH sensible al calor. La administración de dizocilpina, un inhibidor de NMDA, fue eficaz para revertir, al menos parcialmente, la hiperalgesia térmica.5 Otros antagonistas de los receptores NMDA, como el dextrometorfano, han demostrado algunas pruebas de alivio de los estados hiperalgésicos a través de la inhibición del receptor NMDA.
Los opiáceos, como la codeína, la hidromorfona y la morfina, sufren una serie de biotransformaciones como parte del proceso metabólico normal.La codeína se metaboliza en morfina mediante la enzima CYP2D6. La morfina se metaboliza en varias moléculas, pero se metaboliza principalmente a través de la glucuronidación en morfina-3-glucurónido (M3G) y, en menor medida, en morfina-6-glucurónido (M6G) (FIGURA 1).11
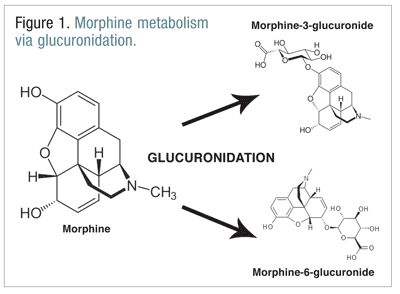
M6G es un metabolito terapéuticamente importante. Tiene una afinidad de unión al receptor mu similar a la de la morfina y es capaz de producir analgesia, depresión respiratoria y otros efectos similares a los de la morfina. El M3G, sin embargo, no es un agonista del receptor mu, y tiene poca afinidad por el receptor mu en comparación con la morfina. A diferencia de la morfina, la M6G y otros opioides, la M3G es un agonista del NMDA. A través de la glucuronidación, la M3G se convierte a una velocidad aproximadamente seis veces mayor que la de la M6G.12 Se ha implicado a otros opioides en la actividad agonista NMDA y en los efectos neuroexcitatorios paradójicos.6
Apoyando la teoría de que la OIH está causada por la actividad de receptores además del receptor opioide mu, hay pruebas de que la OIH no se alivia con la administración de un antagonista opioide (por ejemplo, naloxona). En pacientes que experimentan OIH mientras reciben un tratamiento con dosis altas de opioides, la administración de naloxona provocó un empeoramiento del dolor.13 Al desplazar el opioide del receptor mu, la naloxona impidió que el opioide proporcionara la analgesia que era posible a través de la activación del receptor mu, mientras que, al mismo tiempo, la hiperalgesia quedó sin respuesta.14
La dinorfina también puede estar implicada en el desarrollo de la OIH.15 La dinorfina es un péptido opioide endógeno que se une principalmente al receptor opioide kappa y, en menor medida, a los receptores opioide mu y NMDA. Se cree que el agonismo de la dinorfina del receptor opioide kappa y del receptor NMDA tiene un papel en la pronocicepción de la OIH a pesar de la presencia de agonistas puros del receptor mu. Los estudios han mostrado que la reversión de la dinorfina puede restaurar los efectos analgésicos de la morfina cuando los sujetos reciben un antisuero de dinorfina. Además, se sabe que la dinorfina aumenta durante la administración prolongada de opioides. La dinorfina también provoca la liberación de neuropéptidos excitatorios en diferentes lugares del sistema nervioso central.
Opciones de tratamiento
Una vez que se ha hecho el diagnóstico de OIH, hay una serie de opciones de tratamiento entre las que elegir cuidadosamente. Siempre que la lesión dolorosa inicial o el daño tisular se hayan resuelto y el dolor persista a pesar del tratamiento con opioides -y debido a él-, el enfoque más directo es suspender el opioide agresor. Esto debe hacerse gradualmente para minimizar los efectos adversos de la abstinencia. Debe tenerse en cuenta que es probable que la hiperalgesia empeore al principio del proceso de interrupción.16 Esto plantea una situación ética difícil en la que el médico puede tener dificultades para convencer al paciente de que la medicación prescrita para tratar el dolor puede haber estado causando o empeorando el dolor y que el dolor puede empeorar todavía antes de que finalmente se resuelva.17
Si el dolor legítimo persiste y se requiere algún tipo de analgesia con opioides, deben explorarse otras estrategias además de la interrupción total de los opioides. Los pacientes que experimentan OIH pueden obtener alivio reduciendo la dosis de opioides.4 Hay informes de pacientes que encuentran un equilibrio aceptable de analgesia y alivio de la hiperalgesia al reducir la dosis de opioides.
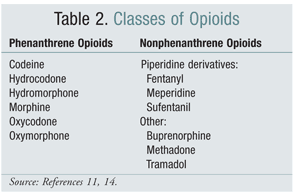
El cambio de una clase estructural de opioides a otra ha sido una opción eficaz para mitigar la OIH en algunos estudios. Los estudios realizados hasta la fecha han demostrado que la OIH está más fuertemente asociada a los opioides de la clase del fenantreno (TABLA 2).4 La titulación del opioide del fenantreno y la conversión a otro puede proporcionar la resolución de la OIH. La codeína, la hidromorfona, la morfina y los opioides estructuralmente similares sufren glucuronidación como parte de su metabolismo. Es posible evitar un metabolito glucurónido activador del receptor NMDA cambiando a un opioide estructuralmente único, como el fentanilo. En el momento de redactar este informe, no se ha demostrado la existencia de OIH en los ensayos con oximorfona.4
La complementación del tratamiento con opioides con un inhibidor de la ciclooxigenasa 2 (COX-2) es otra estrategia que cuenta con cierto apoyo. Al reducir la síntesis de prostaglandinas, los inhibidores de la COX-2 pueden disminuir la sensibilización de las neuronas pronociceptivas. Los antiinflamatorios no esteroideos (AINE) y los inhibidores de la COX-2 parecen tener efectos analgésicos independientes de su capacidad para suprimir la síntesis de prostaglandinas a nivel periférico.9 Los inhibidores de la COX-2 también han demostrado su capacidad para antagonizar el receptor NMDA. A nivel central, los AINE son capaces de antagonizar el receptor NMDA bloqueando el glutamato, la sustancia P y otros aminoácidos excitatorios. Independientemente de esto, la activación del receptor NMDA puede aumentar la expresión de la COX-2.18
Dada la atención que ha recibido el receptor NMDA por su papel en la HIO, antagonizar este receptor parece ser una estrategia de tratamiento razonable. La ketamina ha sido muy investigada, pero sus efectos adversos pueden ser graves. Aunque antagoniza el NMDA y proporciona un efecto anestésico que favorece la analgesia, los efectos secundarios son comunes, diversos y graves.19 Estos efectos incluyen taquiarritmia, hipertensión, trastornos cognitivos y reacciones psicomiméticas, como cambios de humor, sueños vívidos, delirio, alucinaciones y sedación. La ketamina es eficaz para revertir la hiperalgesia y aumentar los efectos de los opiáceos en pacientes que reciben grandes dosis, pero sus efectos adversos impiden que sea una opción de tratamiento viable.
El distrofano es otro antagonista del receptor NMDA que se ha investigado para el tratamiento de la OIH. Se ha estudiado un producto combinado que contiene una mezcla 1:1 de morfina y dextrometorfano.20 Los estudios no demostraron que la terapia combinada pudiera lograr una analgesia superior en comparación con la morfina sola. En un estudio que utilizó una mezcla 2:1 de los mismos agentes se produjeron fracasos terapéuticos similares.Los estudios han sido criticados por tener una cantidad insuficiente de dextrometorfano para antagonizar adecuadamente el receptor NMDA.21Lo que sigue sin conocerse es la dosis de dextrometorfano necesaria para aumentar la analgesia de un opioide o prevenir la OIH causada por la activación del receptor NMDA.
La metadona es un opioide con cualidades únicas que la convierten en una opción convincente para el tratamiento del dolor en el paciente con OIH. Además de sus efectos analgésicos a través de la unión al receptor opioide mu, la metadona es un débil antagonista del receptor NMDA.4 Se ha informado de que la adición de incluso una dosis baja de metadona ha sido eficaz para reducir la hiperalgesia. En un caso, la adición de una dosis baja de metadona (10 mg dos veces al día) mejoró notablemente los informes sobre el dolor, con una reducción de la dosis total de opiáceos de entre el 40% y el 50%.22 El cambio del opiáceo agresor por la metadona ha sido una estrategia de tratamiento popular. El tramadol y la meperidina también tienen cierta actividad antagonista del receptor NMDA.
Otra modalidad de tratamiento que tiene cierto potencial para tratar la OIH es la buprenorfina.23,24 La buprenorfina es un agonista parcial de los opioides en el receptor mu y también tiene actividad antagonista del receptor kappa.4 Se sabe que la dinorfina, un agonista del receptor kappa, aumenta durante el tratamiento con opioides. La activación del receptor kappa antagoniza en gran medida los efectos de los opioides mediados por el receptor mu.25 La utilidad clínica de la buprenorfina en el tratamiento de la OIH aún no se ha explicado completamente.
Conclusión: Mirando al futuro
Queda mucho trabajo por hacer antes de poder declarar que se entiende la OIH. El mecanismo celular exacto y las vías de señalización responsables de este fenómeno no están definidos. Para complicar esto, hay informes contradictorios sobre si los componentes específicos juegan un papel clave, o cualquier papel. La mayor parte de la investigación para dilucidar la fisiopatología de la OIH se ha realizado en el modelo animal. Esto tiene cierto valor, pero la información procedente del modelo humano es escasa.
Un escaso conocimiento de la causa de una enfermedad genera un armamento incierto de opciones de tratamiento. La mejor estrategia disponible es la interrupción total del opioide problemático, pero esto es poco útil para el paciente que requiere un alivio del dolor de tipo opioide.Se han explorado otras modalidades de tratamiento, pero todas ellas se beneficiarían de un mayor estudio. La mayoría de los estudios realizados en seres humanos se centran en pacientes periféricos, drogadictos en recuperación y modelos experimentales de dolor. Estos estudios no carecen de valor, pero estas poblaciones no reflejan la población con dolor crónico. Otras limitaciones de las opciones de tratamiento disponibles son los resultados mediocres, la toxicidad excesiva a pesar del éxito moderado y los estudios pequeños que producen conclusiones débiles.
En el momento de escribir este artículo, se están llevando a cabo o se han planificado varios estudios clínicos con el antagonista del receptor NMDA memantina para tratar la OIH.26 Sin embargo, existen informes contradictorios sobre el papel exacto de los receptores NMDA en la OIH. Hay que seguir investigando para determinar los principales receptores y mecanismos responsables presentes en la OIH. Ampliar el tamaño de la muestra de los estudios ayudará a respaldar las conclusiones que ya se han sacado sobre qué agentes de tratamiento son responsables de la OIH y eficaces para tratarla. La realización de estudios centrados en el dolor crónico, en lugar de en modelos de dolor agudo, puede aportar información clínicamente relevante para el profesional.
Chapman y sus colegas han planteado preguntas específicas que deben responderse antes de poder diagnosticar la OIH y ofrecer un tratamiento eficaz.27 ¿Qué relación existe entre la dosis y la duración de los opiáceos y la OIH? ¿Con qué tipo de dolor, o en qué tipo de paciente, es más probable que se desarrolle la IOH? Estas son las preguntas que deben guiar la futura investigación clínica.
1. Parselis Kelly J, Cook SF, Kaufman DW, et al. Prevalencia y características del uso de opioides en la población adulta de los Estados Unidos. Pain. 2008;138:507-513.
2. Instituto de Medicina. Relieving Pain in America: A Blueprint for Transforming Prevention, Care, Education, and Research. Washington, DC: The National Academies Press; 2011.
3. Chu LF, Angst MS, Clark D. Opioid-induced hyperalgesia in humans: molecular mechanisms and clinical considerations. Clin J Pain. 2008;24:479-496.
4. Lee M, Silverman SM, Hansen H, et al. A comprehensive review of opioid-induced hyperalgesia. Pain Physician. 2011;14:145-161.
5. Mao J. Sensibilidad al dolor anormal inducida por opioides: implicaciones en la terapia clínica con opioides. Pain. 2002;100:213-217.
6. Raffa RB, Pergolizzi JV Jr. Hiperalgesia inducida por opioides: ¿es clínicamente relevante para el tratamiento de los pacientes con dolor? Pain Manage Nurs. 2011;1-17.
7. Li X, Clark JD. Hiperalgesia durante la abstinencia de opioides: mediación por el glutamato y la sustancia P. Anesth Analg. 2002;95:979-984.
8. Pud D, Cohen D, Lawental E, Eisenberg E. Opioides y percepción anormal del dolor: nuevas pruebas de un estudio de adictos crónicos a los opioides y sujetos sanos. Drug Alcohol Depend. 2006;82:218-223.
9. Malmberg AB, Yaksh TL. Hiperalgesia mediada por el receptor espinal de glutamato o sustancia P bloqueada por la inhibición de la ciclooxigenasa espinal. Science. 1992;257:1276 -1279.
10. Fisher K, Coderre TJ, Hagen NA. Targeting theN-methyl-D-aspartate receptor for chronic pain management. Preclinicalanimal studies, recent clinical experience and future researchdirections. J Pain Symptom Manage. 2000;20:358-373.
11. Lötsch J. Opioid metabolites. J Pain Symptom Manage. 2005;29:S10-S24.
12. Skarke C, Lötsch J. Morphine metabolites: clinical implications. Semin Anesth, Perioperative Med Pain. 2002;21:258-264.
13. Juni A, Klein G, Kest B. Morphine hyperalgesia in mice isunrelated to opioid activity, analgesia, or tolerance: evidence formultiple diverse hyperalgesic systems. Brain Res. 2006;1070:35-44.
14. Angst M, Clark JD. Opioid-induced hyperalgesia: a qualitative systematic review. Anesthesiology. 2006;104:570-587.
15. Vanderah TW, Gardell LR, Burgess SE, et al. Dynorphin promotes abnormal pain and spinal opioid antinociceptive tolerance. J Neurosci. 2000;20:7074-7079.
16. Hooten WM, Mantilla CB, Sandroni P, Townsend CO. Associationsbetween heat pain perception and opioid dose among patients with chronicpain undergoing opioid tapering. Pain Med. 2010;11:1587-1598.
17. Silverman S. Opioid induced hyperalgesia: clinical implications for the pain practitioner. Pain Physician. 2009;12:679-684.
18. Li SQ, Xing YL, Chen WN, et al. Activation of NMDA receptor isassociated with up-regulation of COX-2 expression in the spinal dorsalhorn during nociceptive inputs in rats. Neurochem Res. 2009;34:1451-1463.
19. Okon T. Ketamine: an introduction for the pain and palliative medicine physician. Pain Physician. 2007;10:493-500.
20. Galer BS, Lee D, Ma T, et al. MorphiDex (morphinesulfate/dextromethorphan hydrobromide combination) in the treatment ofchronic pain: three multicenter, randomized, double-blind, controlledclinical trials fail to demonstrate enhanced opioid analgesia orreduction in tolerance. Pain. 2005;115:284-295.
21. Wiesenfeld-Hallin Z. Combined opioid-NMDA antagonist therapies.What advantages do they offer for the control of pain syndromes? Drugs. 1998;55;1-4.
22. Vorobeychik Y, Chen L, Bush MC, Mao J. Improved opioid analgesic effect following opioid dose reduction. Pain Med. 2008;9:724-727.
23. Baron MJ, McDonald PW. Reducción significativa del dolor en pacientes con dolor crónico tras la desintoxicación de altas dosis de opioides. J Opioid Manag. 2006;2:277-282.
24. Koppert W, Ihmsen H, Körber N, et al. Different profiles ofbuprenorphine-induced analgesia and antihyperalgesia in a human painmodel. Pain. 2005;118:15-22.
25. Pan ZZ. Mu-opposing actions of the kappa-opioid receptor. Trends Pharmacol Sci. 1998;19:94-98.
26. Ballantyne JC, Mao J. Opioid therapy for chronic pain. N Engl J Med. 2003;349:1943-1953.
27. Chapman CR, Lipschitz DL, Angst MS, et al. Opioid pharmacotherapyfor chronic non-cancer pain in the United States: a research guidelinefor developing an evidence-base. J Pain. 2010;11:807-829.