A szerves kémia kezdeti időszakában az alkéneket “telítetleneknek” nevezték, mivel a “telített” alkánokkal ellentétben könnyen reagáltak olyan anyagokkal, mint a halogének, hidrogénhalogenidek, oxidálószerek stb. Ezért az alkének “kémiai affinitását” kielégítetlennek vagy “telítetlennek” tekintették. (Lásd még az 1-1I. szakaszt.)
Az alkének és alkinek többek között azért reagálnak könnyebben, mint az alkánok, mert a többszörös kötés szén-szén kötései egyenként gyengébbek, mint a normál szén-szén egyszeres kötések. Tekintsük az érintett kötési energiákat. A 4-3. táblázat szerint a szén-szén egy-, kettős- és hármas kötések erőssége \(83\), \(146\), illetve \(200 \: \text{kcal}\). Ezekből az értékekből kiszámíthatjuk, hogy egy szén-szén kettős kötés felének felhasításához \(63 \: \text{kcal}\), egy szén-szén hármas kötés egyharmadának felhasításához pedig \(54 \: \text{kcal}\) szükséges:

Ebből következően a többszörös kötésekkel kapcsolatos addíciós reakciók várhatóan körülbelül \(20\)-\(30 \: \text{kcal}\) exotermebb, mint a szén-szén egykötések megfelelő hasadási reakciói, amint azt itt a brómmal való reakcióra becsüljük:
Az etán, etén és etin brómmal való reakcióhőinek jelentős különbségét tükrözi egy nagyon fontos gyakorlati szempont az etin (acetilén) kezelésében, nevezetesen a szilárd szénnel és hidrogéngázzal szembeni termodinamikai stabilitása. Az etánnal ellentétben mind az etén, mind az etin a kötési energiákból kimutatható, hogy instabil a szilárd szén és a gáznemű hidrogén képződésével szemben:
Bár úgy tűnik, hogy ez az etén esetében nem jelent különösebb problémát, az etén robbanásszerű bomlása szénné és hidrogénné történhet, ha a gázt \(10\)-\(20 \: \text{kg cm}^{-2}\) sűrítjük. Még a folyékony etilinnel (bp \sim 83^\text{o}\)) is óvatosan kell bánni. Az etin nem használható kereskedelmi forgalomban nyomás alatt, kivéve, ha inert gázzal keverik és robusztus berendezésekben kezelik. Az etin tiszta oxigénnel égve nagyon forró lángot ad, amelyet széles körben használnak hegesztéshez. Ebből a célból a gázt körülbelül \(15 \: \text{kg cm}^{-2}\) alatt 2-propanonban (aceton, 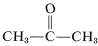 , bp \(56.5^\text{o}\)) oldják és diatoma földdel töltött palackokban tartják.
, bp \(56.5^\text{o}\)) oldják és diatoma földdel töltött palackokban tartják.
Miért olyan sokkal kevésbé stabil az etin, mint az etén vagy az etán? Először is, a \(\ce{C-C}\) kötések nem olyan erősek, mint a \(\ce{C-H}\) kötések. Ezért általában stabilitásnövekedés várható, ha az \(\ce{C-H}\) kötések az \(\ce{C-C}\) kötések rovására jönnek létre; az eténnek és az etánnak több \(\ce{C-H}\) kötése van, mint az etinnek. Másodszor, az etin hat elektront tart a két szénatom között, és ezek az elektronok jelentős kölcsönös interelektronikus taszítást tapasztalnak. Ez magyarázza azt a tényt, hogy az alkin hármas kötésének átlagos \(\ce{C-C}\) kötéserőssége \(200/3 = 67 \: \text{kcal}\), szemben az alkén kettős kötésének \(146/2 = 73 \: \text{kcal}\) és az alkán normál egyszerű kötésének \(83 \: \text{kcal}\) értékével.
- John D. Robert és Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, második kiadás. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Ez a tartalom szerzői jogvédelem alatt áll a következő feltételekkel: “Engedélyt adunk a mű egyéni, oktatási, kutatási és nem kereskedelmi célú sokszorosítására, terjesztésére, bemutatására és előadására bármilyen formátumban.”