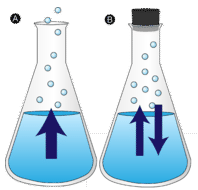
Párolgás
Az érintetlenül hagyott víztócsa végül eltűnik. A folyadékmolekulák a gázfázisba lépve vízgőzzé válnak. A párolgás az a folyamat, amelynek során egy folyadék gázzá alakul. A párolgás egy folyadéknak a folyadék forráshőmérséklete alatti gőzzé alakulása. Ha a vizet ehelyett egy zárt tartályban tartjuk, a vízgőzmolekuláknak nincs esélyük a környezetbe távozni, így a vízszint nem változik. Ahogy néhány vízmolekula gőzzé válik, ugyanennyi vízgőzmolekula visszasűrűsödik a folyékony állapotba. A kondenzáció a gázból folyadékba történő állapotváltozás.
Hogy egy folyadékmolekula gázállapotba léphessen, a molekulának elegendő mozgási energiával kell rendelkeznie ahhoz, hogy legyőzze a folyadékban lévő molekulák közötti vonzóerőket. Emlékezzünk vissza, hogy egy adott folyadékmintában sokféle kinetikus energiájú molekula található. Azok a folyadékmolekulák, amelyek rendelkeznek ezzel a bizonyos küszöb kinetikus energiával, kiszabadulnak a felületről, és gőzzé válnak. Ennek eredményeképpen a megmaradó folyadékmolekuláknak már kisebb a kinetikus energiájuk. A párolgás során a megmaradó folyadék hőmérséklete csökken. Megfigyelted a párolgó hűtés hatásait. Egy forró napon az izzadságodban lévő vízmolekulák elnyelik a testhőt, és elpárolognak a bőröd felületéről. A párolgás következtében a megmaradt izzadság hűvösebb marad, ami viszont több hőt vesz fel a testedből.
Egy adott folyadék gyorsabban párolog, ha felmelegszik. Ennek az az oka, hogy a melegítés hatására a folyadék molekuláinak nagyobb hányada rendelkezik a folyadék felszínéről való kilépéshez szükséges mozgási energiával. Az alábbi ábra a folyadékmolekulák mozgási energiájának eloszlását mutatja két hőmérsékleten. Az elpárolgáshoz szükséges mozgási energiával rendelkező molekulák számát a jobb oldali görbe alatti árnyékolt terület mutatja. A magasabb hőmérsékletű folyadék \(\left( T_2 \right)\) több olyan molekulával rendelkezik, amelyek képesek a gőzfázisba távozni, mint az alacsonyabb hőmérsékletű folyadék \(\left( T_1 \right)\).

A Kína és Nepál határán, a Himalája hegységben található Mount Everest \(\left( 8848 \: \text{m} \right)\) 29 029 láb magasan a Föld legmagasabb pontja. Magassága számos gyakorlati problémát jelent a hegymászók számára. A levegő oxigéntartalma sokkal alacsonyabb, mint a tengerszinten, ezért oxigénpalackot kell magunkkal vinni (bár néhány hegymászó már oxigén nélkül is feljutott a csúcsra). Egy másik probléma az ételek főzéséhez szükséges víz felforralása. Bár a tengerszinten a víz \(100^\text{o} \text{C}\) hőmérsékleten forr, a Mount Everest tetején a forráspont csak körülbelül \(70^\text{o} \text{C}\). Ez a különbség nagyon megnehezíti egy tisztességes csésze tea elkészítését (ami néhány brit hegymászót határozottan frusztrált).