Valós és ideális gázok
Az ideális gáz olyan gáz, amely minden hőmérséklet és nyomás mellett követi a gáztörvényeket. Ehhez a gáznak teljes mértékben be kellene tartania a kinetikus-molekuláris elméletet. A gázrészecskéknek nulla térfogatot kellene elfoglalniuk, és semmiféle vonzóerőt nem kellene kifejteniük egymás felé. Mivel egyik feltétel sem lehet igaz, nem létezik ideális gáz. A valódi gáz olyan gáz, amely nem a kinetikus-molekuláris elmélet feltételezései szerint viselkedik. Szerencsére a laboratóriumban általában előforduló hőmérsékleti és nyomásviszonyok mellett a valódi gázok általában nagyon hasonlóan viselkednek az ideális gázokhoz.
Milyen körülmények között viselkednek tehát a gázok a legkevésbé ideálisan? Amikor egy gázt nagy nyomás alá helyezünk, a molekulái közelebb kerülnek egymáshoz, mivel a részecskék közötti üres tér csökken. Az üres tér csökkenése azt jelenti, hogy kevésbé érvényes az a feltételezés, hogy maguknak a részecskéknek a térfogata elhanyagolható. Ha egy gázt lehűtünk, a részecskék mozgási energiájának csökkenése miatt lelassulnak. Ha a részecskék lassabban mozognak, a közöttük lévő vonzóerők jobban érvényesülnek. Egy másik megközelítés szerint a gáz további hűtése végül folyadékká alakul, a folyadék pedig már biztosan nem ideális gáz (lásd a folyékony nitrogént az alábbi ábrán). Összefoglalva, egy valódi gáz alacsony hőmérsékleten és nagy nyomáson tér el leginkább az ideális gáztól. A gázok magas hőmérsékleten és alacsony nyomáson a legideálisabbak.

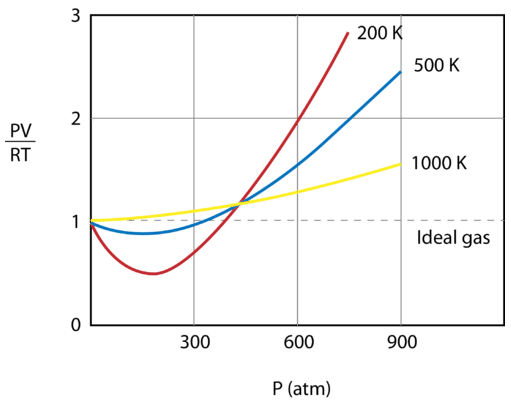
Az alábbi ábra az \(\frac{PV}{RT}\) grafikonját mutatja a nyomás függvényében \(1 \: \text{mol}\) gázra három különböző hőmérsékleten – \(200 \: \text{K}\), \(500 \: \text{K}\) és 1000 \: \text{K}\). Egy ideális gáz esetében az arány értéke minden hőmérsékleten és nyomáson 1 lenne, és a grafikon egyszerűen egy vízszintes vonal lenne. Mint látható, előfordulnak eltérések az ideális gáztól. Ahogy a nyomás emelkedni kezd, a vonzóerők hatására a gáz térfogata a vártnál kisebb lesz, és az \(\frac{PV}{RT}\) értéke 1 alá csökken. A nyomás további növekedése azt eredményezi, hogy a részecskék térfogata jelentőssé válik, és az \(\frac{PV}{RT}\) értéke 1 fölé emelkedik. Vegyük észre, hogy az idealitástól való eltérések nagysága a legnagyobb az \(200 \: \text{K}\) és a legkisebb az \(1000 \: \text{K}\) gáz esetében.
A gáz idealitása a részecskék között fennálló intermolekuláris vonzóerők erősségétől és típusától is függ. Azok a gázok, amelyek vonzóereje gyenge, ideálisabbak, mint az erős vonzóerőkkel rendelkező gázok. Azonos hőmérsékleten és nyomáson a neon ideálisabb, mint a vízgőz, mert a neon atomjait csak gyenge diszperziós erők vonzzák, míg a vízgőz molekuláit viszonylag erősebb hidrogénkötések. A hélium ideálisabb gáz, mint a neon, mert kisebb elektronszáma miatt a hélium diszperziós erői még gyengébbek, mint a neoné.