Kötésszilárdság: Kovalens kötések
A stabil molekulák azért léteznek, mert kovalens kötések tartják össze az atomokat. A kovalens kötés erősségét a kötés felbontásához szükséges energiával mérjük, vagyis a kötött atomok szétválasztásához szükséges energiával. Bármely kötéspár szétválasztása energiát igényel; minél erősebb egy kötés, annál nagyobb energia szükséges a felbontásához. Az egy mólnyi gázmolekulában egy adott kovalens kötés felbontásához szükséges energiát kötési energiának vagy kötésdisszociációs energiának nevezzük. Egy kétatomos molekula kötési energiája, \(D_X-Y}\), az endoterm reakció standard entalpiaváltozásaként definiálható:
\
A tiszta kovalens H-H kötés kötési energiája, \(\Delta_{H-H}\), például 436 kJ a felbontott H-H kötés mólonként:
\
A kötés felbontásához mindig energiát kell hozzáadni a molekulához. Ennek megfelelően egy kötés létrehozása mindig energiát szabadít fel.
A három vagy több atomot tartalmazó molekuláknak két vagy több kötése van. Egy ilyen molekulában az összes kötési energia összege megegyezik a molekula összes kötését felbontó endoterm reakció standard entalpiaváltozásával. Például a CH4-ben lévő négy C-H kötési energia összege, 1660 kJ, megegyezik a reakció standard entalpiaváltozásával:
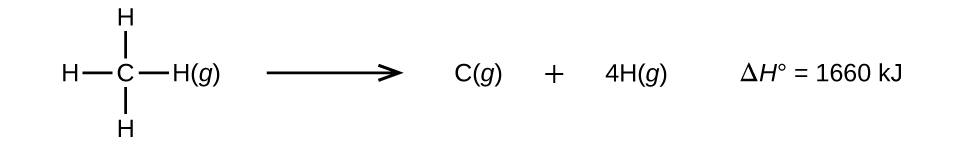
A C-H kötés átlagos energiája, \(D_{C-H}\), 1660/4 = 415 kJ/mol, mivel a reakcióban négy mol C-H kötés szakad meg egy molonként. Bár a négy C-H kötés egyenértékű az eredeti molekulában, nem mindegyiknek ugyanannyi energiára van szüksége a felszakításhoz; miután az első kötés felszakadt (ami 439 kJ/mol-t igényel), a többi kötést könnyebb felszakítani. A 415 kJ/mol érték az átlag, nem a pontos érték, amely bármelyik kötés felszakításához szükséges.
A két atom közötti kötés erőssége a kötésben lévő elektronpárok számának növekedésével nő. Általában a kötés erősségének növekedésével a kötés hossza csökken. Így azt találjuk, hogy a hármas kötések erősebbek és rövidebbek, mint az azonos két atom közötti kettős kötések; hasonlóképpen a kettős kötések erősebbek és rövidebbek, mint az azonos két atom közötti egyszerű kötések. Néhány gyakori kötés átlagos kötési energiája a \(\PageIndex{2}\) táblázatban, a kötéshosszok és kötéserősségek összehasonlítása pedig a \(\PageIndex{2}\) táblázatban található. Amikor egy atom egy csoport különböző atomjaihoz kötődik, a kötés erőssége általában csökken, ahogy haladunk lefelé a csoportban. Például a C-F 439 kJ/mol, a C-Cl 330 kJ/mol és a C-Br 275 kJ/mol.
| Bond | Bond Energy | Bond Energy | Bond | Bond Energy | Bond Energy | Bond Energy | Bond Energy | |
|---|---|---|---|---|---|---|---|---|
| H-H | 436 | C-S | 260 | F-Cl | 255 | |||
| H-C | 415 | C-Cl | 330 | F-Br | 235 | |||
| H-N | 390 | C-Br | 275 | Si-Si | 230 | |||
| H-O | 464 | C-I | 240 | Si-P | 215 | |||
| H-F | 569 | N-N | 160 | Si-S | 225 | |||
| H-Si | 395 | \(\mathrm{N=N}\) | 418 | Si-Cl | 359 | |||
| H-P | 320 | \(\mathrm{N≡N}\) | 946 | Si-Br | 290 | |||
| H-S | 340 | N-O | 200 | Si-I | 215 | |||
| H-Cl | 432 | N-F | 270 | P-P | 215 | |||
| H-Br | 370 | N-P | 210 | P-S | 230 | |||
| H-I | 295 | N-Cl | 200 | P-Cl | 330 | |||
| C-C | 345 | N-Br | 245 | P-Br | 270 | |||
| \(\mathrm{C=C}\) | 611 | O-O | 140 | P-I | 215 | |||
| \(\mathrm{C≡C}\) | 837 | \(\mathrm{O=O}\) | 498 | S-S | 215 | |||
| C-N | 290 | O-F | 160 | S-Cl | 250 | |||
| \(\mathrm{C=N}\) | 615 | O-Si | 370 | S-Br | 215 | |||
| \(\mathrm{C≡N}\) | 891 | O-P | 350 | Cl-Cl | 243 | |||
| C-O | 350 | O-Cl | 205 | Cl-Br | 220 | |||
| \(\mathrm{C=O}\) | 741 | O-I | 200 | Cl-I | 210 | |||
| \(\mathrm{C≡O}\) | 1080 | F-F | 160 | Br-Br | 190 | |||
| C-F | 439 | F-Si | 540 | Br-I | 180 | |||
| C-Si | 360 | F-P | 489 | I-I | 150 | |||
| C-P | 265 | F-S | 285 |
| kötés | kötéshossz (Å) | kötési energia (kJ/mol) |
|---|---|---|
| C-C | 1.54 | 345 |
| \(\mathrm{C=C}\) | 1.34 | 611 |
| \(\mathrm{C≡C}\) | 1.20 | 837 |
| C-N | 1.43 | 290 |
| \(\mathrm{C=N}\) | 1.38 | 615 |
| \(\mathrm{C≡N}\) | 1.16 | 891 |
| C-O | 1.43 | 350 |
| \(\mathrm{C=O}\) | 1.23 | 741 |
| \(\mathrm{C≡O}\) | 1.13 | 1080 |
A kötési energiák segítségével közelítő entalpiaváltozást számíthatunk olyan reakciók esetében, ahol a képződési entalpiák nem állnak rendelkezésre. Az ilyen típusú számításokból azt is megtudhatjuk, hogy egy reakció exoterm vagy endoterm-e.
- Egy exoterm reakció (ΔH negatív, termelt hő) akkor következik be, ha a termékek kötései erősebbek, mint a reaktánsok kötései.
- Egy endoterm reakció (ΔH pozitív, felvett hő) akkor következik be, ha a termékek kötései gyengébbek, mint a reaktánsoké.
A kémiai reakció entalpiaváltozása, ΔH, megközelítőleg egyenlő a reaktánsokban lévő összes kötés felbontásához szükséges energia (energia “be”, pozitív előjel) és a termékekben lévő összes kötés kialakulásakor felszabaduló energia (energia “ki”, negatív előjel) összegével. Ez matematikailag a következőképpen fejezhető ki:
\
Ebben a kifejezésben a \(\Sigma\) szimbólum azt jelenti, hogy “az összeg”, D pedig a kötési energiát jelenti kilojoule/molban, ami mindig pozitív szám. A kötési energiát egy táblázatból kapjuk, és attól függ, hogy az adott kötés egyszerű, kettős vagy hármas kötés. Ezért az entalpiák ilyen módon történő kiszámításakor fontos, hogy minden reaktánsban és termékben figyelembe vegyük a kötést. Mivel a D értékek általában egy kötéstípusra vonatkozó átlagértékek sok különböző molekulában, ez a számítás egy durva becslést ad, nem pedig pontos értéket a reakcióentalpiára.
Nézzük meg a következő reakciót:
vagy
\
Két mol HCl képződéséhez egy mol H-H kötést és egy mol Cl-Cl kötést kell felbontani. E kötések felbontásához szükséges energia a H-H kötés (436 kJ/mol) és a Cl-Cl kötés (243 kJ/mol) kötési energiájának összege. A reakció során két mol H-Cl kötés jön létre (kötési energia = 432 kJ/mol), ami 2 × 432 kJ, azaz 864 kJ felszabadulását jelenti. Mivel a termékek kötései erősebbek, mint a reaktánsoké, a reakció több energiát szabadít fel, mint amennyit fogyaszt:
\-2D_{H-Cl}}\\\
&=\mathrm{-2(432)=-185\:kJ}
\end {align*}\]
Ez a többletenergia hő formájában szabadul fel, tehát a reakció exoterm. A T2. táblázatban a HCl(g) standard moláris képződési entalpiájának \(ΔH^\circ_\ce f\) értéke -92,307 kJ/mol. Ennek kétszerese -184,6 kJ, ami jól egyezik a korábban két mol HCl képződésére kapott válasszal.
Példa \(\PageIndex{1}\): A kötési energiák felhasználása az entalpiaváltozások közelítésére
A metanol, CH3OH, kiváló alternatív üzemanyag lehet. A gőz és a szén magas hőmérsékletű reakciója során a szén-monoxid, CO, és a hidrogén, H2, gázok keveréke keletkezik, amelyből metanol állítható elő. A \(\PageIndex{2}\) táblázatban szereplő kötési energiák felhasználásával számítsuk ki az alábbi reakció közelítő entalpiaváltozását, ΔH-t:
\
Solution
Először fel kell írnunk a reaktánsok és a termékek Lewis szerkezetét:
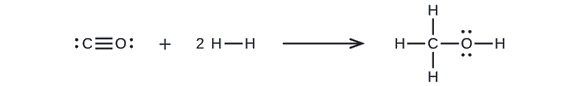
Ebből láthatjuk, hogy a reakció ΔH-ja tartalmazza egy C-O hármas kötés és két H-H egyszeres kötés felbontásához szükséges energiát, valamint a három C-H egyszeres kötés, egy C-O egyszeres kötés és egy O-H egyszeres kötés kialakulásakor keletkező energiát. Ezt a következőképpen fejezhetjük ki (az \ref{EQ3} egyenleten keresztül):
\-}
\end {align*}\]
A \(\PageIndex{2}\) táblázatban szereplő kötési energiaértékeket felhasználva megkapjuk:
&=\ce{-107\:kJ}
\end {align*}\]
Ezt az értéket összehasonlíthatjuk a G függelékben található \(ΔH^\circ_\ce f\) adatok alapján számított értékkel:
&=-\\\
&=\mathrm{-90.5\:kJ}
\end {align*}\]
Megjegyezzük, hogy a két különböző módszerrel számított értékek között meglehetősen jelentős különbség van. Ez azért fordul elő, mert a D értékek különböző kötéserősségek átlaga; ezért gyakran csak durva egyezést adnak más adatokkal.
gyakorlat \(\PageIndex{1}\)
Az etil-alkohol, CH3CH2OH, az egyik első olyan szerves vegyi anyag volt, amelyet az ember szándékosan szintetizált. Számos ipari felhasználási területe van, és ez az alkoholos italokban található alkohol. Cukor erjesztésével nyerhető, vagy etilén hidratálásával szintetizálható a következő reakcióban:

A \(\PageIndex{2}\) táblázatban szereplő kötési energiák felhasználásával számítsa ki a reakció közelítő entalpiaváltozását (ΔH).
Összefoglaló
Videó \(\PageIndex{2}\):
A kovalens kötések akkor jönnek létre, amikor az atomok között elektronok osztoznak, és a két atom magja vonzza őket. A tiszta kovalens kötésekben az elektronok egyenlően oszlanak meg. A poláros kovalens kötésekben az elektronok egyenlőtlenül oszlanak meg, mivel az egyik atom erősebb vonzóerőt gyakorol az elektronokra, mint a másik.
A kovalens kötés erősségét a kötés disszociációs energiájával mérjük, vagyis azzal az energiával, amely az adott kötés felbontásához szükséges egy mól molekulában. A többszörös kötések erősebbek, mint az azonos atomok közötti egyszerű kötések. Egy reakció entalpiája a kötések felbontásához szükséges energiabevitel és az új kötések kialakulásakor felszabaduló energia alapján becsülhető.
Kulcsegyenletek
- Kötési energia egy kétatomos molekula esetében: \(\ce{XY}(g)⟶\ce{X}(g)+\ce{Y}(g)\hspace{20px}\ce{D_{X–Y}}=ΔH°\)
- Enthalpy change: ΔH = ƩBontott kötések – ƩKépződött kötések
Lábjegyzet
- Ez a kérdés a Chemistry Advanced Placement Examination vizsgafeladatból származik, és az Educational Testing Service engedélyével került felhasználásra.
Glosszárium
kötési energia (más néven kötés disszociációs energia) a kovalens kötés felbontásához szükséges energia egy gáznemű anyagban
Megosztók
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) és Richard Langley (Stephen F. F. Austin Állami Egyetem) közreműködő szerzőkkel. Az OpenStax College által készített tankönyvi tartalom a Creative Commons Attribution License 4.0 licenc alatt áll. Letölthető ingyenesen a http://cnx.org/contents/85abf193-2bd…[email protected]).
- Adelaide Clark, Oregon Institute of Technology
- Fuse School, Open Educational Resource ingyenesen, Creative Commons License alatt: Attribution-NonCommercial CC BY-NC (View License Deed: https://creativecommons.org/licenses/by-nc/4.0/)
- Crash Course Chemistry: Crash Course is a Division of Complexly and videos are free to stream for educational purposes.
Feedback
Have feedback to give feedback about this text? Kattintson ide.
Talált egy elírást és extra kreditet szeretne? Kattintson ide.