Kekulé szerkezete a benzolnak
A benzol molekuláris képlete C6H6, de szerkezeti képlete ismeretlen volt.
Ha a benzol egy egyenes láncú telítetlen szénhidrogén lenne, akkor könnyen át kellene esnie addíciós reakcióknak (akárcsak más alkéneknek és alkineknek).
Például a brómnak, Br2-nek, a kettős vagy hármas kötésen keresztül kellene adódnia az alábbiakban látható módon:
| lehetséges egyenes láncú szerkezetű addíciós reakció: | |||
| CH3-C≡C-C≡C-CH3 | + Br2 | → | CH3-CBr=CBr-C≡C-CH3 |
De, amikor 25°C-on és 1 atm-on bromot adunk a benzolhoz (101.3 kPa) nyomáson, úgy tűnik, hogy nem következik be reakció.
A benzol lehetséges szerkezetei, amelyek láncba rendezett kettős és/vagy hármas kötéseket tartalmaznak, a legvalószínűtlenebbnek tűntek, mivel ezeknek addíciós reakcióknak kellene végbemenniük.
Ha FeBr3 jelenlétében brómot adunk a benzolhoz, akkor az olyan szubsztitúciós reakción megy keresztül, amelyben az egyik hidrogénatomot brómatomra cserélve C6H5Br képletű vegyület keletkezik, ahogy az alábbiakban látható:
| ismert szubsztitúciós reakció: | ||||||||
| C6H6 | + Br2 | FeBr3 → |
C6H5Br | + HBr | ||||
Ebben a tekintetben, a benzol sokkal inkább úgy viselkedett, mint egy telített szénhidrogén (csak egyszerű kötések a szénatomok között).
A Kekulé által 1865-ben a benzolra javasolt első szerkezet tehát nem tartalmazott kettős kötéseket, de a 6 szénatomot gyűrűbe rendezte az alábbiakban látható módon:
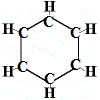
Kekulé felismerte, hogy ez a molekula megszegi a szénre vonatkozó tetravalencia szabályt, azaz minden szénatom 4 helyett csak 3 kötést képez.
Ezért Kekulé 1872-ben egy olyan benzolszerkezetet javasolt, amely három váltakozó egyszerű és kettős kötésből áll, ahogy az alábbiakban látható:

Megjegyzendő, hogy bár a szénatomok nincsenek leírva a szerkezetben, mindig úgy kell érteni, hogy egy kabinatom ott van, ahol a hatszög két vonala összeér, tehát 6 “kötés”, 6 szög, és így 6 szénatom van.
Ebben a szerkezetben minden szénatom egy hidrogénatomhoz, és két másik szénatomhoz kötődik. Az egyik szén-szén kötés egyszerű kötés, a másik szén-szén kötés kettős kötés. Minden szénatom 4 kötést hozott létre.
Míg ez a szerkezet nem magyarázza meg, hogy a benzol miért nem megy keresztül addíciós reakciókon, azt megmagyarázhatja, hogy a benzol miért csak egy szerkezeti izomer képződik, amikor a benzol brómmal reagál szubsztitúciós reakcióban, ahogy az alább látható:
 javasolt benzolszerkezet |
+ Br2 | → |  csak 1 szerkezeti izomer |
. | + HBr |
A benzolra javasolt egyéb gyűrűszerkezetek egynél több szerkezeti izomert jósoltak volna a szubsztitúciós reakció termékére az alábbiak szerint:
| egyéb javasolt gyűrűszerkezeti reakció: | 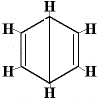 |
Br2 → |
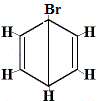 szerkezeti izomer 1 |
+ | 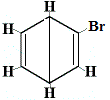 szerkezeti izomer 2 |
Mi történne, ha egy másik hidrogénatomot brómatomra cserélnénk (helyettesítenénk)?
| C6H5Br | + Br2 | FeBr3 → |
C6H4Br2 | + HBr |
Hány szerkezeti izomerje keletkezne a C6H4Br2-nek?
 |
Br2 → FeBr3 |
 szerkezeti izomer 1 |
+ | 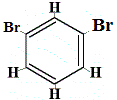 szerkezeti izomer 2 |
+ | . 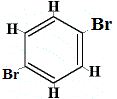 szerkezeti izomer 3 |
+ |  szerkezeti izomer 4 |
Az 1. és 4. szerkezeti izomer azért különbözik, mert az 1. izomerben a két Br atom a C-C kötéssel, míg a 4. izomerben a két Br atom C=C kötéssel kötődik szénatomokhoz.
Amikor azonban a benzolból előállított C6H5Br szubsztitúciós reakcióban brómmal reagál, csak 3 szerkezeti izomer C6H4Br2 keletkezik!
E probléma megoldására Kekulé azt javasolta, hogy a benzolgyűrű gyors egyensúlyban van olyan szerkezetek között, amelyekben a kettős kötések az alábbiakban bemutatott alternatív helyzetekben vannak:
 |
⇋ | 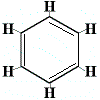 |
Amikor tehát a bróm C6H5Br-rel szubsztitúciós reakcióban C6H4Br2 előállítására reagál, a C6H4Br2 szerkezeti izomerpárjai egyensúlyban vannak egymással.
Ez azt jelenti, hogy a fent bemutatott 1. és 4. szerkezeti izomerek, amelyek csak abban különböznek, hogy a Br atomok egyszerű kötésen vagy kettős kötésen keresztül kapcsolódnak, most gyors egyensúlyban vannak egymással, ahogy az alábbiakban látható:
| Br atomok szomszédos C atomokon, az 1. szerkezeti izomer Br atomjai a C-C-n keresztül a 4. szerkezeti izomer Br atomjai a C=C-n keresztül |
 az 1. szerkezeti izomer |
⇋ |  a 4. szerkezeti izomer |
Kekulé szerint, a C6H4Br2 e két szerkezeti izomere olyan gyors egyensúlyban van, hogy nem lehet őket két külön molekulaként szétválasztani, így úgy tűnik, hogy 4 izomer helyett csak 3 izomer létezik.
Bár a benzolnak ez a gyors egyensúlyú szerkezete, az úgynevezett Kekulé-szerkezet hasznosnak bizonyult, nem magyarázza meg a benzolgyűrű egyedülálló stabilitását (reakcióképtelenségét), nem magyarázza meg, hogy a benzol miért nem megy át könnyen addíciós reakciókon, de addíciós reakciókra késztethető.
Megértette ezt?
Lépjen be az AUS-e-TUTE-ba!
Töltse ki a tesztet most!