Bevezetés
Az immunfluoreszcencia (IF) antitesteket és fluoreszcens detektálást használ a célfehérjék lokalizációjának, relatív expressziójának és aktivációs állapotának tanulmányozására rögzített sejtekben vagy szövetekben. Az IF-t széles körben alkalmazzák a legkülönbözőbb tudományterületeken.
Az IF olyan kérdések megválaszolására használható, mint:
- Mely sejtek vagy szövetek expresszálják a célfehérje(ke)t?
- Hogyan változik a célfehérje expressziója és/vagy aktivációja kísérleti perturbációk hatására?
- Hol lokalizálódik a célfehérje a sejtben/szövetben?
- Milyen térbeli kapcsolat van a különböző célfehérjék között a sejt- vagy szöveti architektúrával összefüggésben?
Az immunfluoreszcencia számos kapcsolódó technikát foglal magában, amelyek az idők során fejlődtek. Mindezek a technikák kihasználják a biológiai célpontok antitestek általi specifikus felismerését és a fluoreszcens riporterek kimutatását a citometriai elemzésben. Fontos, hogy a biológiai minta jól megőrzött legyen, miközben a célantigének hozzáférhetőek az antitestek számára, de a minta, a célpont és az antitest függvényében különböző kihívásokat jelenthet.
Az oldalon olyan forrásokat gyűjtöttünk össze, amelyek segítenek eligazodni a protokollokban, választ adnak a gyakori kérdésekre, és segítenek a sikeres IF-kísérletek megtervezésében.
A megfelelő IF technika és protokoll kiválasztása
Az optimális IF technikát/protokollt befolyásolja a biológiai anyag típusa, a mintafeldolgozási lépések, a célantigén tulajdonságai és az alkalmazott konkrét antitest.
A megfontolások közé tartoznak:
- A bemeneti anyagok lehetnek tenyésztett sejtvonalak, fagyasztott szövetek vagy formalinban rögzített, paraffinba ágyazott (FFPE) szövetek.
- A tenyésztett sejtvonalak és primer sejtek esetében keressen immunfluoreszcencia-immunocitokémiára (IF-IC) validált antitesteket.
- Az “immunhisztokémia/IHC” kifejezést sok laboratóriumban gyűjtőfogalomként használják a paraffinba ágyazott vagy fagyasztott szövetekre, és mind a kromogén, mind a fluoreszcens kimutatásra használható. A cellsignal.com oldalon az alkalmazások megkülönböztetik a fagyasztott (IF-F) és a paraffinba ágyazott szövetkészítményeket.
- FFPE szövetminták esetében az immunhisztokémiára (IHC-P) validált antitestek fluoreszcens detektálással is használhatók erősítés nélkül, ha a célantigén bőséges, vagy multiplex IHC (mIHC) jelerősítéssel.
- Egy antitest a fent felsorolt alkalmazások közül egy vagy több alkalmazáshoz is validálható. A protokollajánlások a validálási folyamat során a tudósok által végzett tesztelés eredményei.
- A termékspecifikus protokollok az egyes termékek weboldalán találhatók. Az IF-hitelesített antitestek esetében válassza az “IF” lehetőséget a termékoldalon az IF-hitelesítési adatok és a protokoll megtekintéséhez. Az egyes antitestekre vonatkozó alapvető információkat (hígítások/munkakoncentráció, validált alkalmazások, fajreaktivitás, gazdafajok) a termék adatlapja tartalmazza.
- A leggyakrabban használt IF protokollok szintén megtalálhatók a protokoll oldalon.
- Nem kell vagy nem szeretne fluoreszcens detektálást használni a szövetmintákhoz? Egy alternatív megközelítés a kromogén detektálás, amellyel az IHC oldal foglalkozik.
Az antitestek kiválasztása az IF-hez: az antitestek validálásának fontossága
A legjobb antitestek erős, specifikus jelet adnak minimális háttérrel. Fontos, hogy olyan antitesteket válasszon, amelyeket validáltak a használni kívánt alkalmazásban. Az antitestek validálása IF-ben magában foglalhatja a pozitív és negatív expressziós kísérleteket (knockout sejtvonalak, genetikai modellek, CRISPR vagy RNAi segítségével), a célfehérje lokalizációjának vagy poszttranszlációs módosításainak kísérleti manipulációját és a protokoll optimalizálását.
Az antitestek teljesítménye alkalmazásonként változik. Egy antitest, amely jól teljesít például egy western blot kísérletben, lehet, hogy nem teljesít IF-ben. Az új antitestek tesztelése során egyesek kisebb mértékű off-target kötődést mutatnak; ezek soha nem ajánlottak IF vagy más, nem-WB alkalmazásokhoz. Továbbá előfordulhat, hogy egy antitest fagyasztott szöveten jól teljesít, de FFPE-szöveten nem, vagy fordítva. Az antitestek érzékenysége és teljesítménye változhat a minta rögzítésének és feldolgozásának módjától, valamint az antitestek munkakörülményeitől függően.
Mihelyt eldöntötte, hogy milyen típusú biológiai mintákat szeretne használni a kísérletében, és hogyan fogja azokat előkészíteni, a legegyszerűbb módja az antitestek böngészésének a cellsignal.com-on, ha először kiválasztja a megfelelő alkalmazást. Ezután megadhatja a keresési kifejezéseket vagy kiválaszthat más attribútumokat (például gazdafaj, kutatási terület stb.), hogy tovább finomítsa a keresést, és kiválaszthasson egy olyan antitestet, amelyet a kívánt alkalmazásban validáltak.
Kontrollkísérletek tervezése az IF-hez
Hogy biztos legyen a kísérleti tervében és eredményeiben, valamint abban, hogy az antitest hűen jelenti a célpontját, a pozitív és negatív kontrollkísérletek informatívak lehetnek. Például:
- A kizárólag másodlagos kontrollok megmondhatják, hogy van-e nem specifikus kötődése a másodlagos antitestnek.
- A primer antitest specifitásának megerősítése Knockout/siRNS kísérletek tervezésével vagy ismert expresszáló és nem expresszáló sejtvonalak összehasonlításával.
- A spektrális unmixing képalkotás beállításához egyetlen célpontra vonatkozó kísérleteket használnak. Az ilyen típusú kísérletek segíthetnek annak meghatározásában, hogy a festődés hiánya a sterikus akadályoztatásnak tudható-e be, amely akkor lép fel, ha 2 antigén egymáshoz közel van.
- Foszfatázzal kezeljük a mintákat annak megerősítésére, hogy a foszforspecifikus antitestek csak a foszforilált célpontot ismerik fel az IF-ben.
- Ha a fixálással vagy permeabilizálással kapcsolatos problémákra gyanakszik, a hibaelhárításban hasznos lehet egy olyan antitesttel történő ellenőrzés, amely korábban már bevált a laboratóriumában.
A Cell Signaling Technology (CST) tudósai rutinszerűen végeznek ilyen típusú ellenőrzéseket a validálási folyamat részeként (lásd a példát). Érdemes lehet hasonló kontrollokat beállítani az Ön kísérleti modellrendszerében, különösen akkor, ha nehezen kapja meg a kívánt eredményeket.
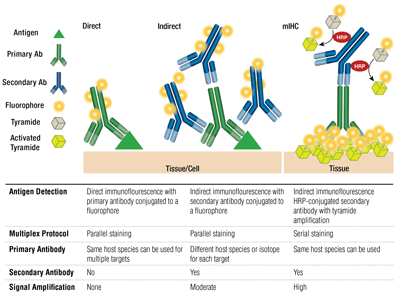
Primer vs. másodlagos antitestek és közvetlen vs. közvetett festés
A primer antitestek a célantigén specifikus felismerését biztosítják. A másodlagos antitestek a primer antitestekhez kötődnek a faj alapján, amelyben felnevelték őket. A nyúlban vagy egérben tenyésztett primer antitestek nyúl-, illetve egérellenes szekunder antitestekkel detektálhatók.
A primer antitest és a (primer gazdafajára specifikus), fluorofórral konjugált szekunder antitest párosítását indirekt festésnek nevezzük. A fluorofórral konjugált primer antitestek másodlagos antitestek nélküli használatát közvetlen festésnek nevezzük. A közvetlen festési módszerek időt takarítanak meg, és lehetővé teszik a multiplexelést ugyanazon gazdafajon termesztett antitestek felhasználásával. A közvetett festés hagyományosan nagyobb érzékenységet biztosít a jelerősítésnek köszönhetően, amely akkor következik be, amikor több másodlagos antitest kötődik egyetlen primer antitesthez.
Ezeknek a technikáknak más változatai is rendelkezésre állnak, például biotinilált primer antitestek használata avidin/streptavidin-konjugált fluorokrómával. A fluorofórral konjugált F(ab’)2 másodlagos antitest fragmentumok (amelyekből hiányzik az Fc domén) segíthetnek a háttér csökkentésében. Az mIHC-ben a tormaperoxidázzal (HRP) konjugált másodlagos antitesteket alkalmaznak a tiramid-fluorofór konjugátumok lerakódásának katalizálására.
Az antitestek fluorofórok kiválasztása
Az antitestek fluorofórok kiválasztása
Hány célpont/antitest multiplexelhető?
A multiplexálás egyszerre több mint 1 célpont kimutatását alkalmazza több antitest segítségével és az egyes célpontok különböző hullámhosszúságának (színének) kimutatásával. Indirekt festés esetén a multiplexálás képessége fluorofór-konjugált, fajspecifikus másodlagos antitestek párosításán alapul minden egyes elsődleges antitesthez. A különböző izotípusú egérantitestek szintén multiplexelhetők izotípus-specifikus másodlagos antitestek használatával, ami akár 5 egérantitest egyidejű kimutatását is lehetővé teszi. A közvetlen festéshez minden egyes primer antitestet különböző fluorofórhoz kell kapcsolni. Ez lehetővé teszi több, ugyanabból a fajból/izotípusból származó antitest kombinálását, valamint az “egér az egéren” festést, mivel az egérellenes szekunderek egérszövethez való nem specifikus kötődése nem jelent gondot.
A multiplex IF-kísérletek tervezésekor figyelembe kell venni a fluoreszcens mikroszkóp spektrális jellemzőit, beleértve a rendelkezésre álló gerjesztő forrásokat és szűrőkészleteket, a spektrális átcsapódás elkerülése érdekében. A modern epifluoreszcens és konfokális fluoreszcens mikroszkópok általában képesek 3 vagy több csatorna megkülönböztetésére.
Az antitestfestés kombinálása festékekkel vagy címkékkel
A fixálás után alkalmazott sejtfestékek vagy fixálható élősejt-jelölők beépíthetők az IF munkafolyamatba. Az organellák jelölését gyakran használják a célpont szubcelluláris lokalizációjának ellenőrzésére. Az expresszált címkéket, például a GFP-t, gyakran használják transzfektált sejtek nyomon követésére vagy mozaikos kísérletekben; ha a GFP fluoreszcencia jele alacsony, anti-GFP antitestet lehet alkalmazni az IF-ben. A festékek vagy fluoreszcens fehérjék használata elfoglalja a fluoreszcens csatornákat, így kevesebb marad az antitestek számára.
A fluorofórok kiválasztása a kísérlethez
Ez a gerjesztő forrás spektrális jellemzőitől és a rendelkezésre álló gerjesztési/emissziós szűréstől függ. A fluorofór gerjesztési és emissziós profilját a kísérlet lefuttatása előtt értékelje, hogy elkerülje a fluoreszcencia átszivárgását. A CST számos fluorofórral konjugált primer és szekunder antitestet kínál, beleértve az Alexa Fluor® termékcsalád festékeit is.
Mintaelőkészítés
Szövet
A szövetmetszeteket optimális vágási hőmérsékletű (OCT) közegben történő gyorsfagyasztással vagy paraffinban történő rögzítéssel és beágyazással lehet elkészíteni. A lefagyasztott mintákat kriosztát segítségével lehet metszeni, és a következő lépés előtti fixálás előtt 10-15 percig hagyni kell levegőn száradni a tárgylemezen. FFPE szövetminták esetében a kitermelési, fixálási és paraffinbeágyazási lépések követelményei az egyes szövettípusoktól függően változhatnak.
Fagyasztott vs. FFPE szövet
A FFPE szövetek általában jobb morfológiát adnak, mint az OCT-be ágyazott fagyasztott szövetek. Ez megkönnyítheti a pozitív sejtek számszerűsítését vagy a festékek közötti határok azonosítását. Az FFPE-szövet emellett nagyon stabil; a beágyazás után a szövetblokkok évekig tárolhatók. Ezt a szövettípust könnyebb a laboratóriumok között szállítani, és ez az előnyben részesített feldolgozási módszer a humán patológiai minták esetében.
Másrészt az FFPE-szövet számos további feldolgozási lépésen megy keresztül, amelyek a fehérjék lebomlása miatt csökkentik az antigén teljes mennyiségét, a maradék antigén kimutatásához maszkmentesítési lépésekre van szükség, és súlyosbítják az aldehidek által kiváltott autofluoreszcenciát. Hacsak nem nagyon bőséges fehérjével dolgozunk, a maradék antigén nehezen mutatható ki indirekt IF-vel, és a megfelelő festék előállításához amplifikációra lehet szükség. Az is lehetséges, hogy az antigén visszanyerése leleplezhet olyan antigéneket, amelyek normális esetben nem mutathatók ki, és egy egyébként a várt festődési mintázatot adó antitest nem specifikus festődést adhat. Ugyanígy lehetséges, hogy olyan célpontokkal dolgozunk, ahol a célpont epitópjának kimutatásához specifikus antigén-visszanyerési módszerre van szükség. Ezért fontos megfontolni, hogy egy antitestet hogyan validálnak, és milyen lépések szükségesek a használatához.
Az OCT-be ágyazott fagyasztott szövetek esetében a feldolgozás csökkentése elsőbbséget élvez a morfológiával szemben. Ez a leggyorsabb módszer az immunfestési eredmények eléréséhez, mivel a tárgylemezek a szövet vágásának pillanatában készen állnak a használatra, és a beágyazás előtt kevesebb feldolgozási lépés szükséges. Kevesebb fehérje lebomlik, és több antigén áll rendelkezésre az antitestek megkötésére, anélkül, hogy további, durva visszanyerési lépésekre lenne szükség. Mivel ez a módszer nem igényel amplifikációt, érzékenyebb a szövet minőségére. A fixálás típusa (alkohol vagy aldehid), időtartama (egyes céltárgyak, például a transzkripciós faktorok rövidebb fixálási időt igényelnek) és a szövetek kora (különösen a metszés után) mind fontosak, és céltárgyanként változnak. Végül, a fagyasztott szövetekkel való munka nagyobb rugalmasságot biztosít a célpontok kiválasztásában, mivel a feldolgozás a metszés után történhet, ami nagyobb testreszabást tesz lehetővé a vizsgálat tervezésében.
Kultúrasejtek
A sejteket a fluoreszcens mikroszkópiával kompatibilis hordozóanyagra kell ültetni. Tipikus hordozók közé tartoznak az üvegfenekű sejttenyésztő edények, az adherens sejttenyésztés támogatására polilicinnel és/vagy extracelluláris mátrix komponensekkel előkészített üveg fedőlemezek (műanyag tenyésztőedényekben tartva), valamint a kereskedelemben kapható, mikroszkópokkal kompatibilis üveglemezekre szerelt multiwell kamrák.
Megjegyzendő, hogy a sejttenyésztési körülmények befolyásolhatják a sejtek egészségét, morfológiáját és a célfehérje expresszióját/lokalizációját, és végső soron az IF adatok minőségét. Győződjön meg arról, hogy a sejtjei egészségesek, azáltal, hogy rendszeresen ellenőrzi a tenyésztőközeg pH-változásait, és mikroszkópon kis nagyítással megvizsgálja a sejtstressz jeleit (például a többmagvú sejteket). Ellenőrizze azt is, hogy a sejtek konfluenciája megfelelő-e a sejttípusnak és a célpontnak.
Minta fixálása
Az ideális fixálószer megőrzi az “életszerű” pillanatfelvételt, miközben az endogén enzimek keresztkötése és gátlása révén gyorsan megállítja az autolízis degradációs folyamatát, és az antigént az antitest általi felismeréshez megjeleníti. Sajnos nincs egyetlen olyan fixálási módszer, amely minden minta és minden antigén esetében ideálisan működik. Még ugyanazon célfehérje különböző antigénjei is eltéréseket mutathatnak az egyes protokollok között. Ezért a legjobb protokoll nemcsak mintatípusonként, hanem epitóponként (és antitestenként) is változhat.
Szövet
Frissen fagyasztott szövetek esetében a lefagyasztott és kriosztátmetszett metszeteket most kell fixálóval kezelni. Alternatív megoldásként a szövetminták tartósítása történhet úgy is, hogy először transzkardiális perfúzióval vagy merítéssel, poszt-fixálással és kriokonzerválási lépésekkel fixáljuk, majd fagyasztással és metszéssel.
Az FFPE szövetek feldolgozásakor a szöveteket formalin (vagy más aldehid alapú fixálószerrel történő merítéses fixálással vagy a fentiek szerinti perfúzióval, majd paraffinbeágyazással és metszéssel tartósítjuk. Az antitesttel való inkubáció előtt a metszeteket deparaffinizálásnak, rehidratálásnak és antigén-visszanyerésnek kell alávetni, hogy az antitestek hozzáférjenek a mintához és meg tudják kötni a célmolekulákat.
Cellák
A sejtek meleg, fehérjeszegény közeggel vagy PBS-szel történő öblítése közvetlenül a fixálás előtt megakadályozhatja az extracelluláris fehérje és a törmelék kicsapódását. A gyors fixálás a médium gyors cseréjével a fixáló oldatra.
Aldehid fixálás vs. alkoholos fixálás
Az aldehid alapú fixálószerek, mint a formaldehid, a formalin (oldott formaldehid és kisebb százalékban metanol keveréke) és a glutaraldehid a leggyakrabban akkor használatosak, amikor a szerkezet megőrzése a legfontosabb. A legtöbb antitest esetében a CST 4%-os (metanolmentes) formaldehiddel történő rögzítést javasol. Az aldehidek reakcióba lépnek a sejtfehérjék primer aminjaival és keresztkötést hoznak létre, és stabilizálják a mintát. Továbbá a sejtek enzimjei, beleértve a foszfatázokat és proteázokat, a keresztkötés hatására inaktiválódnak. Az aldehidek áthatolnak a plazmamembránon és jobban rögzítik az oldható fehérjéket, mint az alkoholok, de néhány célpont elveszítheti antigén jellegét az aldehid keresztkötéssel.
A dehidratáló/denaturáló alkoholos fixálószerek, mint például a metanol, kiszorítják a vizet a sejtek makromolekulái körül, ami azok denaturációját és kicsapódását eredményezi in situ. A célfehérje denaturációja feltárhatja az eltemetett epitópokat, ami egyes antitestek esetében előnyösebbé teszi ezt a megközelítést az aldehid fixálással szemben. A dehidratáló fixálószerek azonban kevésbé alkalmasak az oldható céltárgyak és a módosítási állapot-specifikus antitestek, például a foszfo-antitestek esetében. Ellenőrizze a termék adatlapját az optimális fixálási módszerrel kapcsolatban.
A permeabilizáló szer kiválasztása
Keresztkötő fixálószer használata esetén a plazmamembrán továbbra is érintetlen marad, így az intracelluláris célpontok elérhetetlenek az antitestek számára. Ezért a permeabilizációt a térhálósító fixálás után kell elvégezni, kivéve, ha az antitestek felismerik az extracelluláris epitópokat. Az optimális permeabilizációs módszer az antitesttől függően változik; az ajánlott protokollt mindig ellenőrizze a termék oldalán.
A fixálás utáni Triton® X-100 permeabilizáció alkalmazása gyakori. A Triton és más detergensek, mint például az NP-40, TWEEN®, Saponin, Digitonin és DOTMAC kölcsönhatásba lépnek a sejtmembránokkal, hogy változó méretű “pórusokat” hozzanak létre, és lehetővé tegyék az antitestek hozzáférését.
Alternatívaként a fixálási lépés után alkoholos permabilizálás végezhető etanollal vagy metanollal. Ez a módszer egyesíti a térhálósító fixálószerek gyors rögzítését a fehérjék közbenső denaturációjával és a membrán delipidációjával. Ez javíthatja a jelet bizonyos célpontok esetében, különösen azoknál, amelyek organellákhoz vagy a citoszkeletonhoz kapcsolódnak.
Milyen fixálási/permetizálási feltételeket használjak multiplexáláskor?
Ha olyan antitestekkel multiplexel, amelyek különböző CST protokollokat igényelnek, akkor szükség lehet arra, hogy prioritást adjon annak, hogy melyik antitestet használja az optimális körülmények között. Az mIHC-ben végzett sorrendoptimalizálásra egy példa látható ebben az alkalmazási megjegyzésben (PDF). A különböző protokollokat összehasonlító kisléptékű tesztfuttatás elvégzése informatív lehet a kísérletek méretnövelése előtt.
A blokkoló reagens kiválasztása
A leggyakoribb ajánlás 5% normál kecskeszérum (vagy a másodlagos antitesttel azonos fajból származó szérum) PBS + 0,3% Triton® X-100-ban. Ellenőrizze az adatlapon az ajánlott blokkolószereket.
Ha a mintában Fc-receptorok vannak jelen, az antitest jel a specifikus célpontfelismerés (az antitest antigénkötő helyén/változó régióján keresztül), valamint az Fc-receptorokhoz kötődő antitest nehézlánc nem specifikus abszorpciójának keverékéből származik. Az állati szérumban jelen lévő teljes IgG blokkolja az Fc-receptorokat, hogy megakadályozza az elsődleges és másodlagos antitestek kötődését és csökkentse a háttérzajt. A fluorofór-konjugált F(ab’)2 fragmentumok választása szintén megakadályozza a másodlagos antitest (de nem az elsődleges antitest)
Más antitest-alapú alkalmazásokban, mint például a western blotting, a blokkoló lépések csökkentik a háttérjelet, amelyet az elsődleges és másodlagos antitestek nemspecifikus, alacsonyabb affinitású kötődése okoz a tervezett célponttól eltérő helyekhez. Azt tapasztaltuk azonban, hogy az IF-ben szigorúan tesztelt rekombináns nyúl monoklonális antitestek sok mintán jól teljesítenek blokkolással vagy anélkül. Végső soron az immunfluoreszcenciában validált minőségi antitestek kiválasztása nagyban hozzájárul a háttérzaj elkerüléséhez.
Az antitestkoncentráció és a jel-zaj arány IF-ben
A jel-zaj arány (S/N) összefügg az antitest specifitásával és érzékenységével egy adott alkalmazásban. Az S/N úgy számítható ki, hogy összehasonlítjuk a fluoreszcencia-intenzitások “jelét” az érdeklődésre számot tartó célpontot expresszáló sejtekben és az expresszió nélküli sejtek “háttérzaját”. Ha az antitestet túl alacsony koncentrációban alkalmazzák, a fluoreszcenciajel túl halvány lesz ahhoz, hogy megkülönböztethető legyen a háttérzajtól. Másrészt a túl magas koncentráció hozzájárul a háttérfestéshez, ami csökkenti az S/N értéket. Mindig ellenőrizze a termék adatlapján az ajánlott hígítást, amely az antitest validálása során végzett titrálásokon alapul.
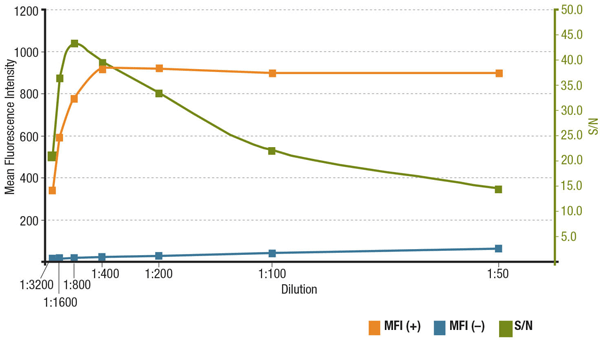
A MUC1 (D9O8K) XP® Rabbit mAb #14161 hígítás S/N analízise. Az átlagos fluoreszcencia-intenzitás mennyiségi meghatározása expresszáló (MFI(+), narancssárga) ZR-75-1 sejtekben és nem expresszáló (MFI(-), kék) HCT 116 sejtekben, és számított S/N (zöld).
A MUC1 (D9O8K) XP® Rabbit mAb #14161 hígítás S/N analízise. Az átlagos fluoreszcencia-intenzitás mennyiségi meghatározása expresszáló (MFI(+), narancssárga) ZR-75-1 sejtekben és nem expresszáló (MFI(-), kék) HCT 116 sejtekben, és számított S/N (zöld).
Az antitest inkubációs ideje
Az éjszakai inkubáció 4°C-on általában erős jelet eredményez. Az inkubációs idő és a hőmérséklet megváltoztatása megváltoztathatja a jelet és az S/N értéket. A különböző antitestek eltérően reagálhatnak a megváltozott inkubációs körülményekre; bővebben lásd ezt a blogbejegyzést.
Konfokális mikroszkóphoz kell hozzáférnem az IF elvégzéséhez?
Az IF bármilyen fluoreszcens mikroszkóppal elvégezhető, amely megfelelő gerjesztő forrással és szűréssel rendelkezik, beleértve az epifluoreszcens, pásztázó és forgó lemezes konfokális mikroszkópokat. Az immunfluoreszcencia általában kompatibilis a speciális fluoreszcencia technikákkal is, beleértve a teljes belső reflexiós fluoreszcenciát (TIRF), a fénylemez mikroszkópiát és néhány szuperrezolúciós technikát.
Kompatibilitás az automatizált nagy áteresztőképességű szűréssel/magas tartalomelemzéssel
Minden IF-IC-re jóváhagyott antitest használható nagy áteresztőképességű szűrésben (HCS) és magas tartalomelemzésben (HCA). Ezek a kísérletek standard IF technikákon alapulnak, automatizálással.
Problémákba ütközik az IF kísérletével? Kattintson ide a hibaelhárítási útmutatóért.
A Cell Signaling Technology, a CST és az XP a Cell Signaling Technology, Inc. védjegyei. Minden más védjegy a megfelelő tulajdonosok tulajdonát képezi.