A kötőhártya interpalpebralis terében gyakran alakulnak ki szabálytalan szöveti elváltozások, amelyek többnyire minimálisan patológiásak vagy egyáltalán nem patológiásak. Ez a hely ki van téve az ultraibolya (UV) sugárzásnak és a légköri irritáló anyagoknak, és hajlamos a kiszáradásra; így az olyan elváltozások, mint a pingueculae és a pterygia gyakran előforduló szemfelszíni szabálytalanságok, és általában minimális figyelmet keltenek a vizsgálat során.
Szövettani daganatos betegséggel azonban alkalmanként találkozhatunk. Az invazív kötőhártya laphámrákot szövettanilag gyakran megelőzi a kötőhártya intraepithelialis neoplazma (CIN), amely a leggyakrabban előforduló kötőhártya-neoplasztikus daganat. Ezek az elváltozások – amelyeket gyakran tévesen tipikusabb szemfelszíni kinövésekként diagnosztizálnak – lassan progrediálnak, lokálisan invazívak és nem rendelkeznek metasztatikus potenciállal. Alkalmanként azonban jelentős helyi szemfelszíni károsodást okozhatnak, és az invazívabb laphámsejtes karcinómává fejlődhetnek. A CIN diagnózisa és kezelése egyaránt kihívást jelenthet. Ez a cikk betekintést nyújt azon OD-k számára, akik esetleg nem találkoznak túl gyakran a CIN-nel, és szeretnének egy klinikai áttekintést.
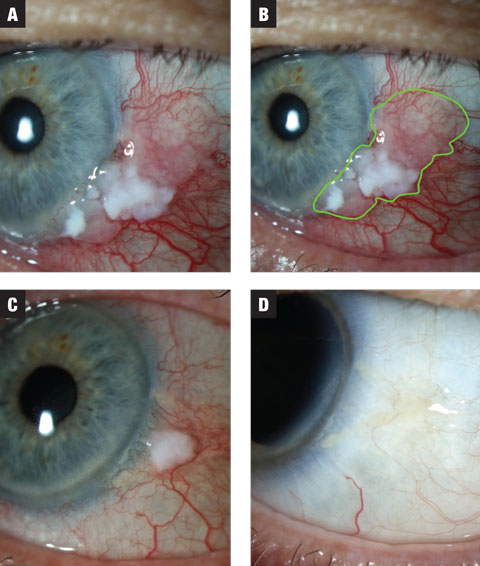
1a. ábra. Az 1. esetben az elváltozás leukoplakiás és zselatinos zónákat is tartalmaz. A kezelést MMC 0,02%-os QID-vel kezdték meg. 1b. ábra. Az elváltozás becsült kiterjedése kiemelve. 1c. ábra. Az első háromhetes kúra után az elváltozás mérete drámai csökkenést mutat. A beteget két hétig tartó kimosási periódusba helyezték, és utasították, hogy számoljon a második MMC-kúrával. 1d. ábra. Az elváltozás a lemosást követően teljesen megszűnt. A nagyításhoz kattintson a képre.
CIN kialakulása
A hámrákos sejtpopuláció, a karcinóma kialakulásához a sejtek viselkedésében bekövetkező változások sorozata szükséges. Az ilyen diszpláziát mutató sejtek rendezetlen növekedést és érést mutatnak, ami az éretlen sejtek túlburjánzását eredményezi, amivel szemben az ilyen vonalú érett sejtek egyidejű relatív csekély száma áll. Bár a diszplázia reverzibilis folyamat, a diszpláziás sejtek további mutáción mehetnek keresztül, ami neoplasztikus transzformációt eredményezhet, amelynek során a sejtek érzéketlenné válnak a növekedésgátlókra és invazívvá válnak.
A neoplasztikus karcinómák lehetnek lokálisan a bazálmembrán által korlátozottak – ez az úgynevezett carcinoma in situ -, vagy lehetnek invazívak, amire jellemző, hogy az elváltozás áttöri a megfelelő bazálmembránt és lokálisan terjed. Ez a stádiumbeosztás azonban nem két különálló entitásra utal; a carcinoma in situ inkább egy előzetes lépést jelent a daganatos megbetegedések ugyanazon kontinuumán. Ha magára hagyják, a carcinoma in situ végül invazívvá válhat.
Míg lehetséges, hogy a laphámkarcinóma kihagyja a CIN lépcsőfokát, ez gyakran a betegség etiológiájának középpontja. A CIN a kötőhártya (és esetleg a szaruhártya) hámsejtjeinek kóros vonala, és vagy egyszerű diszpláziát (a hámszövet részleges vastagsága), vagy carcinoma in situ-t jelent, amikor az elváltozás teljes vastagságú.1-4 A CIN a kötőhártya és a szaruhártya neoplasztikus rendellenességeinek spektrumába tartozik, amelyet együttesen szemfelszíni laphámsejtes neopláziának (OSSN) neveznek. Ha a CIN a bazálmembrán áttörésével invazívvá válik, akkor invazív laphámrákká (SCC) minősítik át.
A CIN, bár nem gyakori, a leggyakrabban előforduló kötőhártya-neoplazma az Egyesült Államokban4. A CIN és az OSSN minden formájának kialakulásának kockázati tényezői az UV-expozíció (különösen az UV-B), a férfi nem, a kőolajtermékeknek való kitettség, az erős dohányfüst, a humán immunhiány vírusa (HIV) és a humán papillomavírus (HPV) 16-os típusa, bár ez utóbbi kockázat továbbra is vitatott.1,3-5 A CIN prognózisa általában jó, kivéve azokat az eseteket, amikor a daganat szokatlanul nagy. Amint az elváltozás áttöri az alaphártyát és invazívvá válik, a prognózis rosszabb, és gyakran agresszív kezelést, például enukleációt vagy extenerációt igényel. Még ezekben az esetekben is alacsony a távoli áttétképződés kockázata.
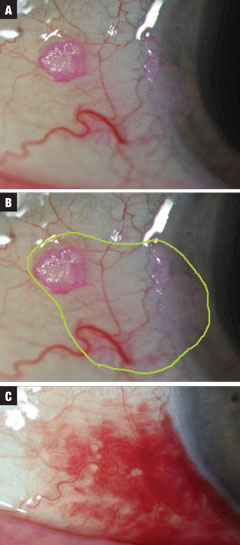
2a-c ábrák (fentről lefelé). A 2. eset egy kis, a vizsgálat során véletlenszerűen felfedezett CIN-gyanús elváltozás volt. A kezelést INF-a2b QID-vel kezdték meg, amíg a 10 ml-es üveg ki nem ürült. A neoplasztikus peremek becsült teljes kiterjedése zölddel van kiemelve. Végül feloldódást tapasztaltak, a valsalvához kapcsolódó (nem gyógyszer okozta) egyidejű SCH-vel. A kezeléshez egy hónapra volt szükség egymillió NE QID, majd 10 napra QID hárommillió NE INF-a2b-vel. Kattintson a képre a nagyításhoz.
Klinikai megjelenés
A CIN klinikai megjelenése egy kóros, enyhén emelkedett, húsos tömeg, amely jellemzően az interpalpebralis limbalis zónában található (az összes elváltozás 95%-a).6 Az e területre való hajlam valószínűleg annak jellemzőinek köszönhető. Az UV-B-expozíció az interpalpebralis zónában a legnagyobb, és a limbus őssejtzónája átmeneti tér a szaruhártya és a kötőhártya hámja között. Ez az átmeneti zóna valószínűleg különleges kockázatot jelent a szövet számára a diszplázia kialakulása szempontjából.
A kötőhártya elváltozás lehet zselatinos, papilláris vagy ritkábban leukoplakiás, ami hyperkeratosis következtében alakul ki. Ezek az elváltozások általában jól körülhatárolhatóak, és valamilyen fokú tápláló érhálózatot mutatnak.3,7,8 Az esetek 95 százalékában a limbus érintett.6 A cornealis manifesztációk hasonló kifehéredést mutatnak, és szürke, fimbriás (azaz ujjszerű) hámnyúlványokat mutathatnak a limbusból. Klasszikusan az elváltozások rózsabengállal pozitív festődést vagy pettyezést mutatnak, ami hasznos lehet a CIN klinikai elkülönítésében más kötőhártya-elváltozásoktól.8,9
A papíron viszonylag feltűnő leletek ellenére a CIN és SCC elváltozásokat nehéz lehet megkülönböztetni a kötőhártya normálisabb növekedésétől, mint például a pingueculae, a pterygia és a naevi. Ez az esetek akár 60%-ában téves diagnózishoz vezethet, még akkor is, ha tapasztalt klinikusok értékelik, ami potenciálisan értékessé teszi a szövettani értékeléssel járó biopsziát.3
Diagnosztikai vizsgálat
A vizsgálat történelmileg a sebészi eltávolításkor végzett kimetszési biopsziát foglalta magában. Az orvosok azonban ma már a kemoterápiát elsődleges kezelési módszerként alkalmazzák, ami korlátozhatja a biopsziához való hozzáférést.
Újabb diagnosztikai eszköz a lenyomatcitológia, amely egy szűrőpapírnak az elváltozásra történő felhelyezésével történik, eltávolítja a felszíni hámot, és lehetővé teszi a minimálisan invazív szövettani vizsgálatokat. Ez nagyjából 80%-os érzékenységű, bár a hamis negatív eredmény továbbra is a gyenge pontja, mivel a gyűjtőpapírt megakaszthatja az elváltozás túlzott keratózisa; az ismételt próbálkozások általában sikeresebbek.8 Egy tanulmány szerint az ultranagy felbontású OCT, bár jelenleg nem áll rendelkezésre, nagyon érzékeny az OSSN és a pterygium megkülönböztetésében az elváltozás hámvastagsága alapján.10
Kezelés
A CIN hagyományos kezelése a kimetszés 1 mm és 5 mm közötti margóval, az elsődleges és recidiváló elváltozások kiterjedésétől és előzményeitől függően. A szaruhártya érintettségét sebészi pengével távolítják el, és krioterápiát alkalmaznak az ágyon és a kötőhártya szélein. A sclerát szabadon hagyjuk. Ez általában sikeres, de a kiújulásokról 10% és 52% között számolnak be, attól függően, hogy a posztoperatív szövettani vizsgálat alapján milyen arányban tisztulnak a műtéti margók.6-11 Az arány 5%-ra csökken, ha tiszta margókat érnek el; sajnos a vizsgálatok azt mutatják, hogy nehéz garantálni a tiszta margókat.8,9,9 Ezek a számok látszólag a lehető legszélesebb margók alkalmazását támogatják; azonban a kiterjedt kötőhártya-kimetszésnek következményei vannak: cicatricialis elváltozások, limbális őssejthiány, szklerális olvadás, a könnyfilm jelentős zavara és a szaruhártya astigmatizmusának szabálytalan változásai.
Topikális lehetőségek
A közelmúltban a helyi kemoterápiás szerek váltak népszerűvé a CIN kezelésében, mivel előnyük, hogy a teljes szemfelszínt kezelik, és körültekintő alkalmazás esetén jól tolerálhatónak tűnnek.
Mitomycin. Az 1950-es években felfedezett mitomicinek a Streptomyces caespitosus fermentációs melléktermékei. A mitomicin-C (MMC), az utolsóként felfedezett ilyen molekula, egy antimetabolit, amelyet a szemészeti ellátáson kívül tumorellenes kemoterápiás szerként használnak.12,13 Az MMC alkiláló szerként működik, amely megakadályozza a DNS osztódását a sejtek mitózisa során, amely változás rendkívül toxikus.1 Már egy ilyen keresztkötés is végzetes lehet egy sejt számára.13 Ezenkívül az MMC reaktív oxigénfajokat generálhat és fokozhatja a tumor nekrózis faktor (TNF) szintézisét.
Bár gyökerei az onkológiában vannak, az MMC használata egyre szélesebb körben elterjedt, különösen a szemészetben, a túlzott posztoperatív hegképződés korlátozására tett kísérletek során. A műtéti betegeket komanőverező optometristák ismerhetik az intraoperatív alkalmazását a hegesedés megelőzésére a glaukómaszűrő eljáráson átesett betegeknél, valamint a PRK-ban történő alkalmazását a szaruhártya homályosodásának megelőzésére. Az 1990-es évek közepén történt első OSSN-hez kapcsolódó alkalmazása óta az MMC hatásosnak bizonyult, 82% és 100% közötti sikerességi arányokkal. Az adagolás jellemzően 0,04%-os koncentrációt adnak QID-ben egyhetes, egyhetes ciklusokban, vagy 0,02%-os koncentrációt folyamatosan adagolnak négyhetes kezelésekben.4 A gyógyszeres toxicitás hosszabb kezelés vagy magasabb koncentráció esetén nagyobb
Mivel az MMC egy különösen erős, potenciálisan veszélyes gyógyszer, mellékhatásai – például a limbális őssejthiány és a szklerális olvadás – súlyosak lehetnek. Az olyan gyakrabban előforduló mellékhatások, mint a szaruhártya- és kötőhártya-epitheliopátia és a kötőhártya-injekció átmeneti jellegűek.4,14 Az MMC alkalmazása esetén gondos nyomon követés és a gyógyszeres kezelés abbahagyása szükséges, ha bármilyen jelentős mellékhatás gyanúja merül fel.
5-Fluorouracil (5-FU). Ez egy másik antimetabolit, amelyet a bőrgyógyászati daganatok kezelésében, valamint a glaukómás sebészek is használnak. Mechanizmusa a timidilát-szintáz enzimbe való beavatkozással gátolja a DNS-szintézist. Az OSSN kezelésében az 5-FU-t általában 1%-os koncentrációban adagolják QID egy hónapig, egy hónapig, a feloldódásig. Az esetek többsége egy vagy két ciklus alatt rendeződik, bár egyes esetekben akár öt ciklus is szükséges. Gyakori a hámtoxicitás, amely eróziót vagy hámosodást eredményez. Egy vizsgálatban a kezelés időtartamát a hámosodás kialakulásáig tartó időtartamban határozták meg, a kezelés elhagyása pedig az újbóli epithelializációig tartott. E fájdalmas szövődmény ellenére az 5-FU mellékhatásai nem tűnnek olyan súlyosnak, mint az MMC-é, és a kiújulási arányokat általában egyenértékűnek jelentik.4,14
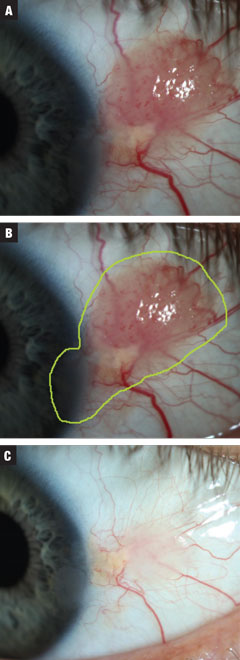
3a. ábra. A 3. eset egy közepes méretű, feltételezett papillomatosus CIN-t érintett. A betegnél INF-a2b hárommillió NE kezelését kezdték el 10 napig. 3b. ábra. Az elváltozás becsült teljes mérete. 3c. ábra. A kezelés után. A növekedés majdnem teljesen megszűnt, a szaruhártya hámja továbbra is szabálytalan. A páciens tanács ellenére a megfigyelés mellett döntött. Kattintson a képre a nagyításhoz.
Interferon alfa 2b (INF-a2b). Az interferonok a citokineknek nevezett, természetben előforduló gyulladásos fehérjék egyik alcsoportja. Aktivált immunsejtek termelik őket, és változó antineoplasztikus, antivirális és antimikrobiális hatással rendelkeznek. Az INF-a2b első bejelentett alkalmazása 1994-ben egy CIN-elváltozás sikeres feloldását eredményezte helyi alkalmazásával.5 Azóta az INF-a2b-t mind helyileg, mind szubkonjunktiválisan, jó hatásfokkal alkalmazzák az OSSN kezelésében.
A perilesionalis adagolás a legnagyobb hatékonyságú, öt hét alatt 87% és 100% közötti feloldódással (hetente akár háromszor adott injekciókkal).4,14,15 Több injekció szükséges az ilyen szintű hatékonyság eléréséhez, ami a betegek akár 100%-ánál szisztémás myalgiát és lázat eredményez.5,14 A lokális adagolás nagyjából megegyezik az MMC hatékonyságával.14,15 Egy millió nemzetközi egység (IU) milliméterenkénti koncentrációban adják és QID adagolják egy hónapig a klinikai feloldódás után. Ha a rendeződés nem következik be, a koncentráció akár hárommillió NE-re is növelhető, szintén QID-ben. Általában, a kezelési koncentrációtól függetlenül, a gyógyszertárakban a készítményt egyetlen, egymillió NE-t tartalmazó készítményből készítik el az üveget. Ez az egymillió NE készítmény tovább koncentrálható a vivőanyag mennyiségének csökkentésével a palackban. A helyi INF-a2b mellékhatásai enyhék, gyakran számolnak be hiperémia és follikuláris kötőhártya-gyulladásról; ritkábban keratitisről.4
Helyi kontra műtét
Noha a biopszia és a sebészi kimetszés volt a múltban a választott kezelés, a helyi kemoterápiás szerek, amelyeknek elméleti előnyei vannak a műtéttel szemben, némi elfogadottságot nyertek a frontvonalbeli terápiában. A műtéttel nem lehet garantálni a tiszta margókat – ami a legjobb prognózishoz szükséges. Minél nagyobb mennyiségű szövetet távolítanak el a tiszta margók biztosítása érdekében, annál nagyobb a szemfelszín hosszú távú károsodásának lehetősége. A lokális szerek a teljes szemfelszínt kezelik, kiküszöbölve a peremek azonosításának szükségességét, és lehetővé téve a mikroszkópos elemzéssel nem egyértelműen azonosítható daganatos sejtpopulációk hatékony kezelését – ez az előny vezethet a lokális szerek és a sebészi kimetszés párosításához, mint a nagy kiterjedésű elváltozások teljes kezelési protokolljához. A helyi kezelés hátránya természetesen az, hogy mivel a teljes szemfelszínt érintik a gyógyszerek – technikailag túlkezelésről van szó -, komplikációk léphetnek fel, és különösen az MMC esetében ezek a komplikációk, bár ritkák, súlyosak lehetnek.
A hatékonyságot tekintve az OSSN kezelésére szolgáló valamennyi helyi kemoterápiás szer meglehetősen jól teljesít. Az INF-a2b a sebészi reszekcióval összehasonlító hatékonysági vizsgálatokon esett át, és kimutatták, hogy hasonló arányban szünteti meg az elváltozást, és a kiújulási arányok valóban alacsonyabbak lehetnek az INF-a2b esetében a reszekcióhoz képest4. A követéses vizsgálatok arról számolnak be, hogy alkalmazása egyszerű vagy kis kiterjedésű elváltozások esetén megfelelőbb, míg előrehaladottabb elváltozások esetén a műtét előnyösebb, bár a helyi terápia előnyösebb lehet a kiújuló elváltozások esetén.4,15
Az MMC általában a legrövidebb kezelési idővel rendelkezik, de a legmérgezőbb és a legnagyobb szövődményveszélyt hordozza. Az 5-FU mellékhatásprofilja és kezelési időtartama közepes; ez a legkevésbé költséges is a csoportból. Az INF-a2b jobb tolerálhatósággal rendelkezik, de gyakran hosszabb kezeléssel és nagyobb költségekkel jár.4,13-16
A költség minden bizonnyal szempont lehet, amikor a helyi kemoterápiás szerek alkalmazásáról döntünk. A biztosítótársaságok néha megtagadják ezeknek a gyógyszereknek a fedezését, kísérleti jellegűnek jelentve alkalmazásukat. Rövid kezelések esetén és csak a teljes egészségügyi kiadásokat összehasonlítva a helyi kemoterápiás szerek olcsóbbak, mint a műtét; azonban több kezelés után meghaladhatják a műtét költségeit.
Ezt a lehetséges akadályozó tényezőt félretéve, figyelembe véve a hatékonyságot, a műtét elkerülésének lehetőségét és az általános tolerálhatóságot, a helyi kemoterápiás szerek ellenőrzött módon alkalmazva jó lehetőségnek tűnnek a kötőhártya intraepiteliális neoplazmás elváltozásainak kezelésére.
Dr. Bronner a Washingtoni Kennewickben található Pacific Cataract and Laser Institute optometrista munkatársa.
1. Kiire CA, Dhillon B. A kötőhártya intraepiteliális neoplázia etiológiája és társulásai. Br J Ophthalmol. 2006:90(1);109-13.
2. Birkholz ES et al. Treatment of ocular surface squamous cell intraepithelial neoplasia with and without mitomycin C. Cornea (Szaruhártya). 2011;30:37-41.
3. Lee GA, Hirst LW. Szemfelszíni laphámsejtes neoplázia. Szemészeti áttekintés. 1995; 39:429-50.
4. Nelson KD, McSoley JJ. A kötőhártya intraepithelialis neoplázia klinikai leletei és kezelése. Optometria. 2011; 82:15-21.
5. Nanji AA, Sayyad FE, Karp CL. A szemfelszíni laphámsejtes neoplázia helyi kemoterápiája. Current Opinion in Ophthalmology. 2013; 24:336-42.
6. Warner M, Jakobiec F. Squamous Neoplasms of the Conjunctiva. In: Krachmer JH, Mannis MJ, Holland EJ eds. Cornea. 2nd ed. St Louis: Mosby; 2004:557-70.
7. Rapuono CJ, Luchs JI, Kim T. Conjunctival and External Disease. Elülső szegmentum: a rekvizitumok. Ed. Krachmer JH. Mosby. 2000;33-6.
8. Huerva V és Ascaso FJ. Kötőhártya intraepithelialis neoplasia – Klinikai megjelenés, diagnózis és kezelési lehetőségek. Srivstava S (szerk.) ISBN: 978-953-3053-307-987-5, InTech.
9. Nelson KD, McSoley JJ. A kötőhártya intraepithelialis neoplázia klinikai leletei és kezelése. Optometria. 2011;82:15-21.
10. Kieval JZ1, Karp CL, Abou Shousha M, et al. Ultranagy felbontású optikai koherencia tomográfia a szemfelszíni laphámneoplázia és a pterigia differenciálására. Invest Ophthalmol and Vis Sci. 2011; 52:1741.
11. Peksayar G, Soyturk MK, Demiryont M: A krioterápia hosszú távú eredményei a kötőhártya rosszindulatú epitheldaganatain. Amer J of Ophthalmol. 1989;107: 337.
12. Santhiago MR, Netto MV, Wilson SE. Mitomicin C: Biológiai hatások és alkalmazás a refraktív sebészetben. Cornea. 2012; 31:311-21.
13. Tomaz M. Mitomicin C: kicsi, gyors és halálos (de nagyon szelektív). Chem and Biol. 1995; 2:575-9.
14. Majmudar PA, Epstein RJ. Antimetabolitok a szemfelszíni daganatokban. Curr Opin in Ophthalmol. 1998; 9:35-9.
15. Besley J, Pappalardo J, Lee GA. A szemfelszíni laphámsejtes neoplázia kiújulásának kockázati tényezői helyi mitomicin C és interferon alfa 2b kezelés után. Amer J of Ophthalmol 2014; 157:287-93.
16. Boehm M és Huang AJW. A recidiváló szaruhártya- és kötőhártya intraepithelialis neoplázia kezelése topikális interferon alfa-2b-vel. Ophthalmol. 2004; 111:1755-61.