Introduction
A Bacillus és Clostridium nemzetségbe tartozó gramm-pozitív baktériumok differenciálódhatnak endospórát (spórát) képezve, amely egy anyagcsere-nyugalmi sejt, amely olyan körülmények hatására keletkezik, amelyek nem teszik lehetővé a sejtnövekedést (McKenney és mtsai., 2012). A környezetbe kerülve a spóra rendkívül hosszú ideig túlél nyugalmi állapotban, és ellenáll a stresszhatások széles skálájának, például a magas hőmérsékletnek, a kiszáradásnak, a tápanyaghiánynak és a mérgező vegyi anyagok jelenlétének (McKenney és mtsai., 2012). A nyugalmi állapotban lévő spóra azonban képes folyamatosan figyelni a környezetet, és a víz és a tápanyagok jelenlétére csírázással és egy vegetatív sejt keletkezésével reagál, amely képes növekedni és sporulálni (McKenney et al., 2012). A nem fiziológiás körülményekkel szembeni ellenálló képesség részben a spóra felületi struktúráinak köszönhető. A Bacillus subtilisben, a spóraképzők modellrendszerében a spórafelszín többrétegű burokba és a spóraköpenyt körülvevő, nemrég felfedezett kéregrétegbe szerveződik (McKenney és mtsai., 2012). A B. subtilis spórák negatív töltésűek (Huang et al., 2010; Pesce et al., 2014), és relatív hidrofóbitással rendelkeznek, ami részben egyes spórafelszíni fehérjék glikozilációjának köszönhető (Cangiano et al., 2014; Rusciano et al., 2014). Számos Bacillus és Clostridium fajban, köztük a B. cereus, B. anthracis, B. megaterium és C. difficile esetében a legkülső spóraszerkezet az exosporium, egy morfológiailag elkülönülő, fehérjékből és glikoproteinekből álló réteg, amely körülveszi a köpenyt (Díaz-González et al., 2015; Manetsberger et al, 2015b; Stewart, 2015).
A baktériumspórát heterológ fehérjék megjelenítésére szolgáló platformként javasolták, amelynek lehetséges alkalmazásai a nyálkahártya-vakcinák kifejlesztésétől kezdve az újrafelhasználható biokatalizátorokig, diagnosztikai eszközökig és bioremediációs eszközökig terjednek (Knecht et al., 2011; Isticato és Ricca, 2014; Ricca et al., 2014). A spóra figyelemre méltó és jól dokumentált rezisztenciája (McKenney és mtsai., 2012), számos spóraképző faj genetikai manipulációra való alkalmassága (Harwood és Cutting, 1990) és számos faj biztonságossága (Cutting, 2011; Baccigalupi és mtsai., 2015) támogatja a spóra megjelenítő és hordozó rendszerként való felhasználását. Két stratégiát dolgoztak ki heterológ fehérjék spórafelszínen történő megjelenítésére. A rekombináns stratégiát, amely egy kiválasztott spórafelszíni fehérjét kódoló DNS és a megjelenítendő fehérjét kódoló DNS közötti génfúzió létrehozásán alapul, az évek során számos heterológ fehérje megjelenítésére használták (Isticato és Ricca, 2014). A tisztított spórák és a tisztított fehérjék közötti spontán adszorpción alapuló, nem rekombináns megközelítést szintén alkalmazták különböző enzimek és antigének megjelenítésére (Ricca és mtsai., 2014). A spóraadszorpciót szabályozó molekuláris részletek még nem teljesen tisztázottak. Az ismert, hogy az adszorpció hatékonyabb, ha a kötőpuffer pH-ja savas (pH 4) (Huang et al., 2010; Sirec et al., 2012), és hogy a kölcsönhatásban valószínűleg elektrosztatikus és hidrofób kölcsönhatások kombinációja játszik szerepet (Huang et al., 2010; Sirec et al., 2012). Az is ismert, hogy az erősen megváltozott spórafelülettel rendelkező mutáns spórák hatékonyabban lépnek kölcsönhatásba modellfehérjékkel, mint az izogén vad típusú spórák (Sirec et al., 2012; Donadio et al., 2016).
Itt egy fluoreszcens fehérjét, a korall Discosoma sp. vörös fluoreszcens fehérjének (mRFP) monomer formáját (Campbell et al., 2002) használtuk annak felmérésére, hogy a B. megaterium spórái képesek-e kölcsönhatásba lépni és adszorbeálni egy heterológ modellfehérjét. A B. megaterium számos morfológiailag különböző törzset foglal magában, amelyek osztoznak mind a sejtek (hossza akár 4 μm és átmérője 1,5 μm), mind a spórák (hossza akár 3 μm és átmérője 1 μm) szokatlanul nagy méreteiben (Di Luccia et al., 2016). A B. megaterium egyes törzseinek spóráit exospórium veszi körül, és mivel eddig csak az exospóriummal nem rendelkező fajok spóráit tekintették adszorpciós platformnak, nem állnak rendelkezésre adatok az exospóriumnak a heterológ fehérjékkel való kölcsönhatásra gyakorolt hatásáról.
A QM B1551 törzs a B. megaterium legjobban jellemzett törzse. Ez a törzs genomjának mintegy 11%-át hét őshonos plazmidon hordozza (Rosso és Vary, 2005; Vary et al., 2007; Eppinger et al., 2011), amelyek közül kettő – a pBM500 és a pBM600 – olyan géneket hordoz, amelyek elengedhetetlenek e törzs jellegzetes “dió alakú” exospóriumának kialakulásához (Manetsberger et al., 2015a). A QM B1551 exosporium fehérjeösszetétele egyelőre kevéssé jellemezhető, genomikai elemzésekkel csak néhány olyan gént azonosítottak, amelyek más fajok spóráiban felismert exosporiumfehérjék ortológjait kódolják. Ezek közé tartoznak a BclA nap fehérjéket kódoló gének, amelyek a B. megaterium QM B1551 spórákban lokalizált napot alkotnak, valamint a B. cereus család spóráiban az exospórium bazális rétegét alkotó BxpB fehérje ortológja. Úgy tűnik, hogy ez utóbbi más szerepet tölt be a B. megaterium QM B1551 spórákban, mivel egy nullmutáns törzs megtartotta a látszólag normális exospóriumot (Manetsberger et al., 2015a).
Ebben a tanulmányban olyan adatokat mutatunk be, amelyek bizonyítják, hogy a B. megaterium QM B1551 spórái hatékonyan képesek mRFP-t adszorbeálni, és bizonyítékot szolgáltatunk arra, hogy a fehérjemolekulák képesek átjutni az exosporium által képviselt permeabilitási gáton, hogy a köpenyek közötti térben lokalizálódjanak.
Anyagok és módszerek
Baktériumtörzsek, spórák és RFP-termelés
A vizsgálatban alkalmazott B. megaterium törzsek a QM B1551 és annak plazmid nélküli származéka, a PV361 (Rosso és Vary, 2005). Az ebben a vizsgálatban használt B. subtilis törzs a PY79 volt (Youngman és mtsai., 1984). Valamennyi Bacillus törzs sporulációját a kimerítési módszerrel indukáltuk (Cutting és Vander Horn, 1990). A Difco sporulációs (DS) táptalajon 37°C-on, erőteljes rázással végzett 30 órás növekedés után a spórákat összegyűjtöttük és megtisztítottuk a Nicholson és Setlow (1990) által leírtak szerint, a maradék sporangiumsejtek líziséhez 4°C-on H2O-ban történő éjszakai inkubálással. A kapott tisztított spórák számát közvetlen számlálással mértük Bürker-kamra segítségével optikai mikroszkóp alatt (Olympus BH-2 40× objektívvel).
Az mRFP termeléséhez az Escherichia coli RH161 törzs (Donadio et al, 2016), amelyek az rfp kódoló régió 5′ végének in-frame fúzióját hat hisztidin kodonnal hordozó pRSET-A expressziós vektort hordoztak egy T7 promóter transzkripciós kontrollja alatt, 100 ml autoindukciós tápfolyadékban 18 órán keresztül 37°C-on növesztettük a heterológ fehérje expressziójához (Isticato et al., 2010). A His6-címkézett RFP fehérjét natív körülmények között tisztítottuk a gyártó által ajánlott His-Trap oszlop segítségével (GE Healthcare Life Science). A tisztított fehérjét PD10 oszlop (GE Healthcare Life Science) segítségével sótalanítottuk a magas NaCl- és imidazol-koncentráció eltávolítása érdekében.
Adszorpciós reakció
Eltérő rendelkezés hiányában 5 μg tisztított rekombináns mRFP-t adtunk spóraszuszpenzióhoz (5 × 108) 50 mM nátrium-citrát pH 4,0-ban 25°C-on, 200 μl végtérfogatban. Az 1 órás inkubáció után a kötési elegyet centrifugáltuk (10 perc 13 000 g-n), hogy a pelletben lévő mRFP-hez kötött spórákat a felülúszóban lévő szabad mRFP-től frakcionáljuk.
Western és Dot-Blot analízis
Az adszorpciós reakciókból származó spóraspelleteket 40 μl spóraköpeny extrakciós pufferben (Nicholson és Setlow, 1990; Giglio et al., 1990) reszuszpendáltuk, 2011), 68°C-on inkubáltuk 1 órán át a spóraköpeny fehérjéinek szolubilizálása érdekében, majd 12%-os SDS-PAGE gélre töltöttük. A fehérjéket ezután elektrotranszferáltuk nitrocellulóz szűrőkre (Amersham Pharmacia Biotech), majd Western blot analízisre használtuk a korábban leírtak szerint (Isticato et al., 2008) monoklonális mRFP-t felismerő anti-His antitest (Sigma) használatával. Az mRFP mennyiségének mennyiségi meghatározását a tisztított mRFP és a kötésvizsgálati felülúszó sorozatos hígításainak összehasonlításával végzett dot blot-kísérletekkel kaptuk. A szűrőket ezután ECL-prime módszerrel (Amersham Pharmacia Biotech) vizualizáltuk, majd denzitometriai elemzésnek vetettük alá a Quantity One 1-D Analysis Software (Bio-Rad) segítségével. A dot blot és a relatív denzitometriai elemzést háromszor végeztük el az eredmények szignifikanciájának ellenőrzésére.
Fluoreszcencia és immunfluoreszcencia mikroszkópia
A felszívódás utáni spórákat 50 μl 1x PBS pH 4,0-ban reszuszpendáltuk, majd a szuszpenzióból 5 μl-t mikroszkópos tárgylemezre helyeztünk és fedőlappal fedtük le, amelyet előzőleg 30 s-ra poli-L-lizinnel (Sigma) kezeltünk. Az immunfluoreszcenciát az Isticato és munkatársai (2013) által leírtak szerint végeztük, a következő módosításokkal: A QM B1551 és PV361 B. megaterium törzsek 2,0 × 106 RFP-adszorbeált spóráját 1% szarvasmarha szérumalbuminnal (BSA) – 1x PBS pH 4,0 30 percig előkezeltük, mielőtt 2 órás inkubációt végeztünk 4°C-on az anti-polihisztidin antitestekkel (egér; Sigma), amelyeket 1:20 arányban hígítottunk 1x PBS pH 4,0-1% BSA-ban. A technika specificitásának ellenőrzésére a nem adszorbeált spórákat közvetlenül anti-His antitestekkel kezeltük. Három mosás után a mintákat 64-szeresére hígított, fluoreszcein-izotiocianáttal, FITC-vel (Santa Cruz Biotechnology, Inc.) konjugált egér ellenes másodlagos antitesttel inkubáltuk, és négyszer mostuk 1x PBS pH 4,0-val. A mosott mintákat 20 μl 1x PBS pH 4,0-ban reszuszpendáltuk, és 10 μl-t elemeztünk. Minden mintát 100× UPlan F1 olajobjektívvel felszerelt Olympus BX51 fluoreszcens mikroszkóppal figyeltünk meg; U-MNG vagy U-MWIBBP kocka szűrőket használtunk az mRFP vörös fluoreszcencia emissziójának, illetve a FITC-konjugált antitestek zöld emissziójának kimutatására. Az expozíciós idők 200 és 3000 ms között voltak. A képeket egy Olympus DP70 digitális fényképezőgéppel készítettük, és az Image Analysis Software (Olympus) segítségével dolgoztuk fel a fényerő, a kontraszt és a színegyensúly kisebb módosítására (McCloy et al., 2014). Az ImageJ (v1.48, NIH) programmal minden törzs esetében 80 spóra körvonalát rajzoltuk meg, és minden spóra esetében rögzítettük a minimális, maximális és átlagos fluoreszcenciaértékeket pixelenként. A fluoreszcencia-intenzitás értékeit később box-plotként ábrázoltuk 5-95%-os konfidenciaintervallummal (McCloy et al., 2014).
Statisztikai elemzés
A dot blot és a fluoreszcencia-mikroszkópos elemzés eredményei három független kísérlet átlagai. A statisztikai szignifikanciát Student t-próbával határoztuk meg, a szignifikancia szintet P < 0,05-nél állapítottuk meg.
Eredmények
mRFP of Discosoma sp. is Adsorbed by B. megaterium spórák
Hogy ellenőrizzük, hogy a B. megaterium QM B1551 spórái képesek-e adszorbeálni az mRFP-t, 5 μg tisztított fehérjét (Anyagok és módszerek) inkubáltunk 5,0 × 108 tisztított spórával. Az adszorpciós reakciót 50 mM nátrium-citrátban, pH 4,0 mellett végeztük, a korábban leírtak szerint (Sirec és mtsai., 2012). A reakciót követően a spórákat 1x PBS pH 4,0-val alaposan mostuk, a spórák felszíni fehérjéit az Anyagok és módszerek című fejezetben leírtak szerint extraháltuk, és western blottal elemeztük anti-polihisztidin-peroxidáz antitesttel (Sigma), amely felismeri az mRFP hisztidin-jelölt N-terminusát. Amint az 1A. ábrán látható, az mRFP-t kivonták a spórákból, ami azt jelzi, hogy a reakció során felszívódott, majd az extrakciós kezelés hatására felszabadult. Az adszorpció hatékonyságának értékeléséhez elemeztük a meg nem kötött mRFP mennyiségét, azaz az adszorpció utáni spórákat centrifugálással gyűjtöttük, a felülúszót sorozatosan hígítottuk és dot blottinggal elemeztük (1B ábra). A dot blot denzitometriai elemzése (1. kiegészítő táblázat) azt mutatta, hogy amikor 5 μg mRFP-t használtunk az adszorpciós reakcióban, kevesebb mint 1% maradt kötődés nélkül, ami azt jelzi, hogy a heterológ fehérje körülbelül 99%-a adszorbeálódott a B. megaterium spórákhoz.

1. ÁBRÁZAT. Bacillus megaterium QM B1551 spórák mRFP-t adszorbeálnak. 5 × 108 spórát inkubáltunk 5 μg tisztított mRFP-vel, majd a mintákat centrifugálásnak vetettük alá. (A) A spórák felszíni fehérjéit a pelletfrakcióból SDS-DTT kezeléssel extraháltuk, SDS-PAGE-on frakcionáltuk és Western blot segítségével elemeztük. Markerként tisztított mRFP-t (20 μg) használtunk. (B) A felülúszót, amely a nem kötött mRFP-t tartalmazta, sorozatosan hígítottuk és dot blottal (QM B1551) elemeztük. A tisztított mRFP (mRFP) sorozatos hígításait használtuk standardként. (C) Az mRFP-vel adszorbeált spórákat kétszer mostuk (W1 és W2) PBS pufferrel pH 3,0 vagy pH 7,0, illetve 1M NaCl, 0,1% Triton X-100 oldattal. A tisztított mRFP és a nem kötött mRFP (UN-mRFP) sorozatos hígításait használtuk standardként. Az immunreakciókat minden panelben torma-peroxidázzal konjugált, mRFP-t felismerő anti-His antitesttel végeztük.
Az elemzéshez, hogy az adszorbeált mRFP molekulák szorosan kötődtek-e a spóra felületéhez, az adszorpciós reakció utáni spórákat kétszer mostuk PBS pufferrel pH 3,0 vagy pH 7,0, illetve 1M NaCl, 0,1% Triton X-100 oldattal a korábban leírtak szerint (Donadio et al., 2016). Amint az 1C. ábrán látható, és a dot blot denzitometriai elemzése is alátámasztja (2. kiegészítő táblázat), a 3,0 pH-n végzett mosások nem okozták az adszorbeált mRFP felszabadulását, míg a 7,0 pH-n vagy 1M NaCl, 0,1% Triton X-100 oldattal végzett mosások az mRFP molekulák minimális, kevesebb mint 1%-os felszabadulását okozták. Ezért az 1. ábrán bemutatott eredmények arra utalnak, hogy az mRFP hatékonyan adszorbeálódott és szorosan kötődött a B. megaterium spórákhoz. Annak felmérésére, hogy a spórák által adszorbeált mRFP molekulák megtartották-e fluoreszcencia tulajdonságaikat, fluoreszcencia mikroszkópos elemzést végeztünk. Amint az a 2. ábrán látható, az adszorpciós reakció utáni spórákhoz erős fluoreszcenciajel társult, amely a spóra teljes felszíne körül látható volt.
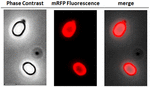
2. ÁBRA. B. megaterium QM B1551-mRFP QM B1551-mRFP spórák fluoreszcens mikroszkópos elemzése. Az mRFP-vel (5 μg) inkubált, majd mosott QM B1551 spórákat fluoreszcens mikroszkópiával elemeztük. Ugyanazt a mikroszkópiás mezőt fáziskontraszt- és fluoreszcens mikroszkópiával is megfigyeltük. Méretsáv 1 μm. Az egyesített panelt közöljük. Az expozíciós idő 200 ms volt.
Az exospóriumnak alapvető szerepe van az mRFP-adszorpcióban
A B. megaterium QM B1551 törzse hét őshonos plazmidot tartalmaz (Rosso és Vary, 2005; Eppinger és mtsai., 2011), és a plazmidok által kódolt gének elengedhetetlenek az exospórium kialakulásához (Manetsberger és mtsai., 2015a). A PV361 egy QM B1551-gyel gyógyított törzs, amelyből hiányzik mind a hét plazmid, és ennek következtében teljesen hiányzik az exospórium (Manetsberger és mtsai., 2015a). A PV361 törzs spóráit használtuk fel az exospórium mRFP-adszorpcióban betöltött szerepének elemzésére. Ezzel párhuzamosan spórákat használtunk a B. subtilis PY79, amelyekről egy korábbi tanulmányban kimutatták, hogy adszorbeálják az mRFP-t (Donadio et al., 2016). A B. subtilis PY79 és a B. megaterium QM B1551 és PV361 törzsek spóráinak adszorpciós hatékonyságának összehasonlításához 5 μg tisztított mRFP-t adszorbeáltunk mindhárom törzs 5,0 × 108 spórájával. Az adszorpciós reakciók után a spórákat centrifugálással gyűjtöttük össze, a fehérjéket SDS-DTT kezeléssel extraháltuk és mRFP-t felismerő anti-His antitesttel Western blottinggal elemeztük. Amint a 3A. ábrán látható, az mRFP láthatóan nagyobb mennyiségben extrahálódott a QM B1551 spóráiból, mint a másik két törzs spóráiból. E nyilvánvaló különbségek számszerűsítésére az adszorpciós reakciókból származó, nem kötött mRFP-t sorozatosan hígítottuk, és dot blottinggal elemeztük (3B. ábra). A 3B. ábra dot blotjának denzitometriai elemzése (3. kiegészítő táblázat) azt mutatta, hogy a PY79 és PV361 spórák az összes mRFP körülbelül 90%-át adszorbeálták, míg a QM B1551 spórák szinte az összes (több mint 99%) tisztított mRFP-t adszorbeálták.
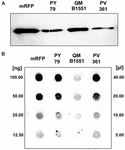
3. ábra. Monomer vörös fluoreszcens fehérje adszorpciója B. megaterium QM B1551 és PV361 és B. subtilis PY79 spóráin. Az egyes törzsek 5 × 108 spóráját 5 μg tisztított mRFP-vel inkubáltuk, majd a mintákat centrifugálásnak vetettük alá. A pelletfrakciókban lévő spórákat felszíni fehérjék kivonására használtuk, amelyeket ezt követően Western blot segítségével elemeztünk (A), míg a felülúszókat sorozatosan hígítottuk és dot blot segítségével elemeztük (B). A tisztított mRFP sorozatos hígításait használtuk standardként. Az immunreakciókat mindkét panelen torma-peroxidázzal konjugált anti-His antitesttel végeztük.
A három törzs spóráinak adszorpciós hatékonyságát fluoreszcens mikroszkópiával is elemeztük (4A. ábra és S1. kiegészítő ábra). A mikroszkópos képeket az ImageJ szoftverrel (v1.48, NIH) elemeztük a kvantitatív fluoreszcencia-képelemzés elvégzéséhez, és a spórák fluoreszcenciáját az Anyagok és módszerek című fejezetben leírtak szerint számoltuk ki. Az egyes törzsek 80 spórájának elemzése során a pixelenkénti átlagos fluoreszcenciaérték 52,43 (± 5,94), 20,81 (± 2,71) és 32,33 (± 2.97; önkényes egységek) a QM B1551, a PV361 és a PY79 esetében (4B. ábra), ami további bizonyítékot szolgáltat arra, hogy a QM B1551 spórái több mRFP-t adszorbeáltak, mint a másik két törzs spórái.
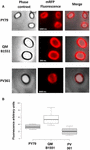
4. ÁBRÁNY. Az mRFP adszorpciójának hatékonysága a B. megaterium QM B1551 és PV361 és a B. subtilis PY79 spóráin. (A) Fluoreszcencia-mikroszkópos felvételek a PY79, QM B1551 és PV361 spórákról mRFP-adszorpciót és mosást követően. Az expozíciós idők jelezve vannak. Fáziskontraszt és vörös fluoreszcencia átfedés látható (egyesített panel). Méretsávok 1 μm. (B) Az egyes törzsek nyolcvan különböző spórájának fluoreszcencia-intenzitását ábrázoló dobozdiagramok. Az egyes dobozok határai az első és a harmadik kvartilt (25 és 75%), a dobozokon kívüli értékek pedig a maximális és a minimális értékeket jelölik. A dobozokat elválasztó vonal az egyes törzsek mediánértékét jelzi. A P-érték kisebb, mint 0,0001.
A 3. és 4. ábra eredményei alapján arra következtetünk, hogy a QM B1551-ben jelen lévő, a PV361-ből hiányzó exosporiumnak releváns szerepe van az mRFP adszorpciójában.
A 4. ábra eredményei továbbá azt mutatták, hogy a B. subtilis PY79 spórák hatékonyabbak az mRFP adszorpciójában, mint a B. megaterium PV361 spórák, míg a 3B ábrán közölt dot blotting hasonló adszorpciós hatékonyságot jelzett a két törzs esetében. Úgy véljük, hogy ez az eltérés a fluoreszcencia erős csökkenésének köszönhető, amikor az mRFP a PV361 spórákhoz kötődik, de a PY79 vagy a QM B1551 spórákhoz nem (lásd alább).
A QM B1551 spórákhoz való mRFP-adszorpció kvantitatív értékelése
A dot blot kísérletek (3B ábra) azt mutatták, hogy amikor 5 μg tisztított mRFP-t használtunk a QM B1551 törzs 5,0 × 108 spórájával végzett adszorpciós reakciókban, szinte az összes heterológ fehérje a spórához kötődött. Annak érdekében, hogy meghatározzuk a QM B1551 spórákhoz adszorbeálható mRFP maximális mennyiségét, megismételtük a reakciókat a tisztított mRFP növekvő koncentrációjával, azaz 5,0 × 108 QM B1551 spórát 5, 10, 20, 40, 80 és 160 μg tisztított mRFP-vel reagáltattunk. A reakciók után a spórákat centrifugálással gyűjtöttük össze, és a nem kötött mRFP-t tartalmazó felülúszókat sorozatosan hígítottuk, majd dot blottinggal elemeztük (5A. ábra). Az 5B. ábra a dot blot denzitometriai elemzésének eredményeit mutatja (??), amely azt jelzi, hogy amikor 5-80 μg mRFP-t 5 × 108 spórával reagáltattunk, a spórákhoz kötött fehérje aránya több mint 90% volt. A kötött mRFP mennyiségének csökkenését figyeltük meg, amikor 160 μg tisztított fehérjét használtunk a reakcióban. Azonban még akkor is, amikor 160 μg tisztított mRFP-t használtak, a fehérje több mint 60%-a felszívódott, ami azt jelzi, hogy 5,0 × 108 QM B1551 spóra körülbelül 100 μg mRFP-t képes adszorbeálni.
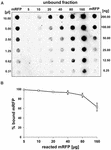
5. ÁBRA. Az mRFP adszorpciójának mennyiségi értékelése a B. megaterium QM B1551 spórákhoz. 5 × 108 spórát inkubáltunk 5, 10, 20, 40, 80 és 160 μg tisztított mRFP-vel. A reakcióelegyeket ezt követően centrifugálásnak vetettük alá, a felülúszókat sorozatosan hígítottuk és dot blot segítségével elemeztük (A). A tisztított mRFP sorozatos hígításait használtuk standardként. Az immunreakciókat mindkét panelen torma-peroxidázzal konjugált anti-His antitesttel végeztük. (B) A spórákhoz adszorbeálódott mRFP százalékos aránya meghatározott mennyiségű endogén mRFP-vel történő reakció után. A hibasávok három kísérlet átlagának standard hibáját mutatják, a P-érték soha nem haladta meg a 0,0025-öt.
az mRFP a B. megaterium QM B1551 spórákban a rétegek közötti térben lokalizálódik
Az immunfluoreszcens mikroszkópiás megközelítést alkalmaztuk annak értékelésére, hogy az adszorbeált mRFP molekulák a B. megaterium QM B1551 spórák felszínén vannak-e exponálva. A különböző mennyiségű mRFP-vel adszorbeált QM B1551 spórákat a rekombináns mRFP-t felismerő monoklonális anti-His antitesttel, majd fluoreszcens anti-egér másodlagos antitesttel (Santa Cruz Biotechnology, Inc.) reagáltattuk és fluoreszcens mikroszkóp alatt megfigyeltük (6. ábra). A kísérletben használt legkisebb mRFP-mennyiséggel (2 μg) az mRFP fluoreszcenciajel (piros) a spóra egészén megfigyelhető volt, míg az immunfluoreszcenciajel (zöld) gyenge volt és főként a spóra pólusainál koncentrálódott, ami arra utal, hogy csak ezeken a pontokon volt az mRFP a spóra felszínén. A reakcióban használt mRFP mennyiségének növelésével a zöld foltok száma nőtt (5 és 10 μg), és a reakcióban használt legnagyobb mRFP-mennyiséggel (20 μg) szinte teljes zöld gyűrű volt megfigyelhető a spórák körül. A 6. ábrán bemutatott eredmények alapján feltételeztük, hogy az mRFP molekulák beszivárognak az exosporiumba, és a külső köpeny és az exosporium közötti köpenytérben lokalizálódnak, azaz kis mennyiségű mRFP használata esetén szinte minden fehérjemolekula az exosporium belsejében van, és csak néhány helyen áll az antitest rendelkezésére. Az adszorpciós reakciókban az mRFP mennyiségének növelése azt eredményezi, hogy a burkolat közötti tér “feltöltődik”, míg végül több mRFP-molekula áll az antitest rendelkezésére a spóra felszínén. Ez a hipotézis azt feltételezi, hogy ha az exosporium hiányzik, akkor az összes mRFP-nek elérhetőnek kell lennie az antitest számára. Ennek tesztelésére immunfluoreszcens mikroszkópiával összehasonlítottuk a QM B1551 (exosporiummal rendelkező) és a PV361 (exosporium nélküli) azonos mennyiségű mRFP-vel (5 μg) inkubált spóráit. Amikor az exospórium jelen volt (QM B1551), az mRFP csak részben volt elérhető az antitest számára, és zöld foltok voltak megfigyelhetők (7. ábra és S2. kiegészítő ábra). Amikor az exospórium nem volt jelen (PV361), az adszorbeált mRFP a spóra egészén elérhető volt az antitest számára, és egy teljes zöld gyűrű alakult ki, ami alátámasztja azt a hipotézist, hogy az mRFP a QM B1551 spórákban az exospóriumon belül van.
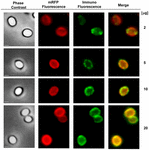
6. ÁBRA 6. Immunfluoreszcencia analízis az mRFP-adszorbeált B. megaterium QM B1551 spórákról. 5 × 108 QM B1551 spóra aliquotját inkubáltuk változó koncentrációjú mRFP-vel, majd ezt követően fáziskontraszt, fluoreszcencia és immunfluoreszcencia mikroszkópiával elemeztük az Anyagok és módszerek című fejezetben leírtak szerint. Az egyes reakciókhoz tartozó azonos mikroszkópiás mezőt az egyesítési panellel együtt közöljük. Az expozíciós idő minden kép esetében 200 ms volt. Méretsáv, 1 μm.
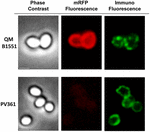
7. ÁBRA. A B. megaterium QM B1551 és PV361 spórákhoz adszorbeált mRFP immunfluoreszcenciája. 5 × 108 QM B1551 és PV361 spórát inkubáltunk 5 μg mRFP-vel, majd immunfluoreszcens mikroszkópiával elemeztük az Anyagok és módszerek fejezetben leírtak szerint. Minden egyes mezőnél fáziskontraszt és immunfluoreszcens mikroszkópia látható. Az expozíciós idő minden kép esetében 200 ms volt. Méretsáv, 1 μm.
Míg a 7. ábra kísérleteiben használt QM B1551 spórák a 2. ábrához hasonlóan teljes vörös fluoreszcens gyűrűt mutattak, addig a PV361 spórák nagyon gyenge vörös fluoreszcens jelet mutattak. A PV361 spóráknál vörös jelet csak hosszú expozíciós idővel lehetett megfigyelni a fluoreszcens mikroszkópban (4. ábra). Mivel az mRFP jelen van a PV361 spórák körül (3. és 7. ábra), arra következtetünk, hogy az mRFP fluoreszcenciája gyengül, amikor a fehérje a PV361 spórákhoz adszorbeálódik. További kísérletekre lesz szükség ennek a kérdésnek a teljes körű tisztázásához.
Diszkusszió
A jelentés főbb megállapításai, hogy a B. megaterium spórái rendkívül hatékonyan adszorbeálják a heterológ mRFP modellfehérjét, hogy az exospóriumnak fontos szerepe van ebben a folyamatban, és hogy az mRFP molekulák beszivárognak az exospóriumon keresztül, a külső köpeny és az exospórium között lokalizálódva. Ezek az eredmények kibővítik a B. subtilis spóráin végzett korábbi munkákat, és azt mutatják, hogy más fajok spórái is felhasználhatók heterológ fehérjék adszorpciós módszerrel történő szállítására. A B. megaterium spóráknál megfigyelt magas adszorpciós hatékonyság részben annak köszönhető, hogy a spórák mérete a B. subtiliséhoz képest nagy. A B. megaterium spóra felülete ugyanis mintegy 2,5-szer nagyobb, mint a B. subtilis spóráé, felülete 5,33 μm2 (h: 1,60 ± 0,16 w: 0,84 ± 0,07) vs. 1,98 μm2 (h: 1,07 ± 0,09 w: 0,48 ± 0,03). A nagy méretek lehetővé teszik akár 100 μg mRFP adszorpcióját, amikor 160 μg fehérje reagál a spórákkal.
A megfigyelés, hogy az mRFP átjut az exosporiumon, arra utal, hogy az mRFP, egy 27 kDa fehérje számára permeábilis. Az exosporium permeabilitása nem teljesen meglepő, mivel a környezetben jelen lévő csíraképző anyagoknak át kell jutniuk a spóra külső rétegein, hogy elérjék receptoraikat, bár a csíraképző anyagok jellemzően kis molekulák, molekulatömegük jellemzően <200 Da. Emellett az mRFP adatok nagyjából összhangban vannak a jelölt dextrannal és rokon molekulákkal végzett korábbi vizsgálatok eredményeivel (Koshikawa és mtsai., 1984; Nishihara és mtsai., 1989). Ezekben a vizsgálatokban a B. megaterium QM B1551 exosporiumról azt feltételezték, hogy a 100 KDa-nál nagyobb molekulatömegű molekulák számára permeabilitási gátat képez, miközben befolyásolja a valahol 2 és 40 kDa közötti tömegű molekulák átjutását (Koshikawa et al., 1984; Nishihara et al., 1989).
A jövőbeli munka érdekes kihívása lesz annak a mechanizmusnak vagy beszivárgási útvonalnak a megállapítása, amelyet az mRFP, és ebből következően más érdekes heterológ fehérjék is bejutnak a bevonatok közötti térbe. A metszett B. megaterium QM B1551 spórák transzmissziós elektronmikroszkópos vizsgálata azt mutatja, hogy az exosporium két azonos “héjból” áll (Manetsberger et al., 2015a), és elképzelhető, hogy az egyes struktúrák közötti határfelület (amelyet a korai cikkekben “apikális nyílásokként” írtak le) lehetővé teszi a viszonylag nagy molekulák bejutását. Az mRFP-fluoreszcencia PV361 spórák adszorpciójakor bekövetkező látszólagos elvesztésének alapjának felderítése, valamint az, hogy az mRFP-molekulák képesek-e beszivárogni a külső köpenyrétegekbe, ahogyan azt a B. subtilis spórák esetében megfigyelték (Donadio et al., 2016), szintén érdekes lesz.
A jelenlegi vizsgálatban azt feltételezzük, hogy az mRFP-molekulák előnyösen áthaladnak az exosporiumon, és a külső köpeny és az exosporium közötti köpenytérben halmozódnak fel. Ebben a modellben az mRFP-molekulák csak akkor adszorbeálódnak és jelennek meg a spóra felszínén, ha az adszorpciós helyek (vagy térfogati kapacitás?) a köpenyközi térben kellően elfoglaltak. Ez azt jelenti, hogy a felületi megjelenítés adszorpciós megközelítése alkalmazható a B. megaterium QM B1551 spórákkal, bár a rendszer függ az adszorpciós reakciókban használt spóra-fehérje aránytól. Mivel a B. megaterium különböző törzseit már régóta használják iparilag enzimek, például amilázok és dehidrogenázok, vitaminok és antimikrobiális molekulák előállítására (Vary et al., 2007), adataink arra utalnak, hogy a B. megaterium spóra új biotechnológiai alkalmazást jelenthet heterológ fehérjék megkötésére és szállítására szolgáló hordozóként.
A szerzők hozzájárulása
ML és GD – végezték a kísérletek nagy részét; RA és AS – hozzájárultak a munka adatainak értelmezéséhez; GiC, LB és GrC – hozzájárultak a munka megfogalmazásához és kritikai átdolgozásához; ER – hozzájárult a munka során folytatott vitákhoz és javaslatokhoz, valamint a kézirat megírásához; RI – vezette a munkát és hozzájárult a kézirat megírásához. Minden szerző elolvasta és jóváhagyta a végleges kéziratot.
Finanszírozás
Ezt a munkát a nápolyi Federico II Egyetem és a Compagnia di San Paolo (Olaszország) ösztöndíja (STAR Linea1- 2014) támogatta RI számára.
Kérdések összeférhetetlenségi nyilatkozata
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
Kiegészítő anyagok
A cikkhez tartozó kiegészítő anyagok online elérhetők a következő címen: https://www.frontiersin.org/article/10.3389/fmicb.2016.01752/full#supplementary-material
S1. ábra | A 4. ábrán ismertetett fluoreszcencia-mikroszkópos elemzés egészmezős képei. Ugyanazt a mikroszkópiás mezőt fáziskontraszt- és fluoreszcencia-mikroszkópiával is megfigyelték. Méretsáv 5 μm. Az egyesített panelt közöljük. Az expozíciós idő feltüntetve.
S2. ábra | A 7. ábrán bemutatott immunfluoreszcens elemzés egész mezőben készült képei. Ugyanazt a mikroszkópiás mezőt fáziskontraszt- és fluoreszcens mikroszkópiával is megfigyeltük. Méretsáv 5 μm. Az expozíciós idő minden kép esetében 200 ms volt.
S1. TÁBLA | A QM B1551 spórákkal végzett adszorpciós reakció felülúszójával végzett dot blot-kísérletek denzitometriai elemzése (1B. ábra).
S2. TÁBLA | Az adszorpciós reakciót követő különböző mosások felülúszóival végzett dot blot kísérletek denzitometriai elemzése (1C. ábra).
S3. TÁBLA | A PY79, QM B1551 és PV361 törzsek spóráival végzett adszorpciós reakció felülúszóival végzett dot blot kísérletek denzitometriai elemzése (3B. ábra).
TABLE S4 | A különböző mennyiségű mRFP-vel végzett adszorpciós reakció felülúszójával végzett dot blot kísérletek denzitometriai elemzése.
Baccigalupi, L., Ricca, E., and Ghelardi, E. (2015). “Non-LAB probiotics: spore Formers”, in Probiotics and Prebiotics: Current Research and Future Trends, eds K. Venema and A. P. do Carmo (Norfolk, VA: Caister Academic Press), 93-103. doi: 10.21775/9781910190098.06
CrossRef Full Text | Google Scholar
Campbell, R. E., Tour, O., Palmer, A. E., Steinbach, P. A., Baird, G. S., Zacharias, D. A., et al. (2002). Egy monomer vörös fluoreszcens fehérje. Proc. Natl. Acad. Sci. U.S.A. 99, 7877-7882. doi: 10.1073/pnas.082243699
PubMed Abstract | CrossRef Full Text | Google Scholar
Cangiano, G., Sirec, T., Panarella, C., Isticato, R., Baccigalupi, L., De Felice, M., et al. (2014). Az sps géntermékek befolyásolják a Bacillus subtilis spórák csírázását, hidrofobicitását és fehérjeadszorpcióját. Appl. Environ. Microbiol. 80, 7293-7302. doi: 10.1128/AEM.02893-14
PubMed Abstract | CrossRef Full Text | Google Scholar
Cutting, S. M. (2011). Bacillus probiotikumok. Food Microbiol. 28, 214-220. doi: 10.1016/j.fm.2010.03.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Cutting, S., and Vander Horn, P. B. (1990). “Genetic analysis,” in Molecular Biological Methods for Bacillus, eds C. Harwood and S. Cutting (Chichester: John Wiley and Sons), 27-74.
Google Scholar
Díaz-González, F., Milano, M., Olguin-Araneda, V., Pizarro-Cerda, J., Castro-Córdova, P., Tzeng, S. C., et al. (2015). A Clostridium difficile 630 spórák legkülső exosporiumszerű rétegének fehérjeösszetétele. J. Proteom. 123, 1-13. doi: 10.1016/j.jprot.2015.03.03.035
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Luccia, B., D’Apuzzo, E., Varriale, F., Baccigalupi, L., Ricca, E., and Pollice, A. (2016). A Bacillus megaterium SF185 stressz útvonalakat indukál és befolyásolja a humán bélhámsejtek sejtciklus-eloszlását. Benef. Microb. 7, 609-620. doi: 10.3920/BM2016.0020
PubMed Abstract | CrossRef Full Text | Google Scholar
Donadio, G., Lanzilli, M., Sirec, T., Ricca, E., and Isticato, R. (2016) Protein adsorption and localization on wild type and mutant spores of Bacillus subtilis. Microb. Cell Fact. 15:153. doi: 10.1186/s12934-016-0551-2
PubMed Abstract | CrossRef Full Text
Eppinger, M., Bunk, B., Johns, M. A., Edirisinghe, J. N., Kutumbaka, K. K., Koenig, S. S., et al. (2011). A biotechnológiailag fontos Bacillus megaterium törzsek QM B1551 és DSM319 genomszekvenciái. J. Bacteriol. 193, 4199-4213. doi: 10.1128/JB.00449-11
PubMed Abstract | CrossRef Full Text | Google Scholar
Giglio, R., Fani, R., Isticato, R., De Felice, M., Ricca, E., and Baccigalupi, L. (2011). A Bacillus subtilis cotG és cotH génjeinek szerveződése és evolúciója. J. Bacteriol. 193, 6664-6673. doi: 10.1128/jb.06121-11
PubMed Abstract | CrossRef Full Text | Google Scholar
Harwood, C. R., and Cutting, S. M. (1990). Bacillus molekuláris biológiai módszerek. Chichester: John Wiley and Sons.
Google Scholar
Huang, J. M., Hong, H. A., Van Tong, H., Hoang, T. H., Brisson, A., and Cutting, S. M. (2010). Antigének nyálkahártyára juttatása bakteriális spórák adszorpciójával. Vaccine 28, 1021-1030. doi: 10.1016/j.vaccine.2009.10.127
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Pelosi, A., De Felice, M., and Ricca, E. (2010). A CotE kötődik a CotC-hez és a CotU-hoz és közvetíti kölcsönhatásukat a Bacillus subtilis spóraképződés során. J. Bacteriol. 192, 949-954. doi: 10.1128/JB.01408-09
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Pelosi, A., Zilhão, R., Baccigalupi, L., Henriques, A. O., De Felice, M., et al. (2008). CotC-CotU heterodimerizáció a Bacillus subtilis spórahéj összeállítása során. J. Bacteriol. 190, 1267-1275. doi: 10.1128/JB.01425-07
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., and Ricca, E. (2014). Spórák felszíni megjelenítése. Microbiol. Spectr. 2, 351-366. doi: 10.1128/microbiolspec.TBS-0011-2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Sirec, T., Treppiccione, L., Maurano, F., De Felice, M., Rossi, M., et al. (2013). Az Escherichia coli hőlabilis toxin B alegységének nem rekombináns megjelenése a Bacillus subtilis vad típusú és mutáns spóráin. Microb. Cell Fact. 12:98. doi: 10.1186/1475-2859-12-98
PubMed Abstract | CrossRef Full Text | Google Scholar
Knecht, L. D., Pasini, P., and Daunert, S. (2011). Bakteriális spórák mint bioanalitikai és orvosbiológiai alkalmazások platformjai. Anal. Bioanal. Chem. 400, 977-989. doi: 10.1007/s00216-011-4835-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Koshikawa, T., Beaman, T. C., Pankratz, H. S., Nakashio, S., Corner, T. R., and Gerhardt, P. (1984). A Bacillus megaterium spórák ellenállóképessége, csírázása és permeabilitási korrelátumai az integumentális rétegektől szukcesszíven megfosztott Bacillus megaterium spórák esetében. J. Bacteriol. 159, 624-632.
PubMed Abstract | Google Scholar
Manetsberger, J., Hall, E. A. H., and Christie, G. (2015a). Plazmid-kódolt gének befolyásolják az exosporium összeszerelését és morfológiáját Bacillus megaterium QM B1551 spórákban. FEMS Microbiol. Lett. 362:fnv147. doi: 10.1093/femsle/fnv147
PubMed Abstract | CrossRef Full Text | Google Scholar
Manetsberger, J., Manton, J. D., Erdelyi, M. J., Lin, H., Rees, D., Christie, G., et al. (2015b). Az ellipszoid lokalizációs mikroszkópia következtet a Bacillus spórahéjak fehérjerétegeinek méretére és rendjére. Biophys. J. 109, 2058-2066. doi: 10.1016/j.bpj.2015.09.023
PubMed Abstract | CrossRef Full Text | Google Scholar
McCloy, R., Rogers, S., Caldon, E., Lorca, T., Castro, A., and Burgess, A. (2014). A Cdk1 részleges gátlása a G2 fázisban felülírja a SAC-ot és szétkapcsolja a mitotikus eseményeket. Cell Cycle 13, 1400-1412. doi: 10.4161/cc.28401
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenney, P. T., Driks, A., and Eichemberger, P. (2012). A Bacillus subtilis endospóra: a többrétegű burok felépítése és funkciói. Nat. Rev. Microbiol. 11, 33-44. doi: 10.1038/nrmicro2921
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicholson, W. L., and Setlow, P. (1990). “Sporulation, germination and out-growth,” in Molecular biological methods for Bacillus, eds C. Harwood and S. Cutting (Chichester: John Wiley and Sons), 391-450.
Google Scholar
Nishihara, T.: Molecular biological methods for Bacillus, szerk, Takubo, Y., Kawamata, E., Koshikawa, T., Ogaki, J., and Kondo, M. (1989). A külső burok szerepe a Bacillus megaterium spórák ellenálló képességében. J. Biochem. 106, 270-273.
PubMed Abstract | Google Scholar
Pesce, G., Rusciano, G., Sirec, T., Isticato, R., Sasso, A., and Ricca, E. (2014). Bacillus subtilis spórák felületi töltésének és hidrodinamikai együtthatójának mérése optikai csipesszel. Colloids Surf. B Biointerfaces 116C, 568-575. doi: 10.1016/j.colsurfb.2014.01.039
PubMed Abstract | CrossRef Full Text | Google Scholar
Ricca, E., Baccigalupi, L., Cangiano, G., De Felice, M., and Isticato, R. (2014). Bacillus subtilis nem rekombináns spórákkal történő nyálkahártya-vakcina beadás. Microb. Cell Fact. 13, 115. doi: 10.1186/s12934-014-0115-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Rosso, M. L., and Vary, P. S. (2005). A Bacillus megaterium QM B1551 plazmidok eloszlása más B. megaterium törzsek és Bacillus fajok között. Plasmid 53, 205-217. doi: 10.1016/j.plasmid.2004.10.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Rusciano, G. Zito, G., Isticato, R., Sirec, T., Ricca, E., Bailo, E., and Sasso, A. (2014). Bacillus subtilis spórák nanoméretű kémiai képalkotása a csúcs-megerősített Raman-szórás és fejlett statisztikai eszközök kombinálásával. ACS Nano 8, 12300-12309. doi: 10.1021/nn504595k
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirec, T., Strazzulli, A., Isticato, R., De Felice, M., Moracci, M., and Ricca, E. (2012). Az Alicyclobacillus acidocaldarius béta-galaktozidázának adszorpciója a Bacillus subtilis vad típusú és mutáns spóráin. Microb. Cell Fact. 11:100. doi: 10.1186/1475-2859-11-100
PubMed Abstract | CrossRef Full Text | Google Scholar
Stewart, G. C. (2015). A bakteriális spórák exosporium rétege: kapcsolat a környezettel és a fertőzött gazdaszervezettel. Microbiol. Mol. Biol. Rev. 79, 437-457. doi: 10.1128/MMBR.00050-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Vary, P. S., Biedendieck, R., Fuerch, T., Meinhardt, F., Rohde, M., Deckwer, W. -D., et al. (2007). Bacillus megaterium – az egyszerű talajbaktériumtól az ipari fehérjetermelő gazdatestig. Appl. Microbiol. Biotechnol. 76, 957-967 doi: 10.1007/s00253-007-1089-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Youngman, P., Perkins, J. B., and Losick, R. (1984). Új módszer a Bacillus subtilis kromoszómális DNS-ének gyors klónozására Escherichia coli-ban a Tn917 inszerció szomszédságában. Mol. Gen. Genet. 195, 424-433. doi: 10.1007/BF00341443
CrossRef Full Text | Google Scholar
.