Introduction
A meningeomák a leggyakoribb primer központi idegrendszeri (CNS) daganatok, és az összes primer agydaganat több mint 37%-át teszik ki (1). A meningeomák kezelési lehetőségei közé tartozik a megfigyelés, a műtét és a sugárterápia (2, 3). Míg a meningeomák kisebb része agresszív, beleértve a WHO II. és III. fokozatát, több mint 80%-a WHO I. fokozatú, és gyakran “jóindulatúnak” nevezik (4). Azonban még a WHO I. fokozatú meningeómák is kiújulhatnak, korábbi tanulmányok szerint a kiújulási arány akár 47% is lehet a hosszú távú követés során (4, 5). A meningeóma kiújulása gyakran további műtéti vagy mentő sugárterápiás kezelést tesz szükségessé, ami potenciális morbiditáshoz vezet (6, 7). Ennek eredményeképpen a kiújulás előrejelzésének képessége a WHO I. fokozatú meningeóma kezelésének döntő fontosságú eleme, hogy ajánlásokat lehessen tenni a megfigyelő képalkotás gyakoriságára vagy az adjuváns sugárterápia alkalmazására vonatkozóan.
A rezekció során elért Simpson-osztály mellett számos tumorjellemzőt értékeltek a kiújulás lehetséges előrejelzőjeként, a szövettani leletekre összpontosítva (8). Ezek közé tartozik a MIB-1 index (a sejtproliferáció markere), az agyi invázió és az atipikus szövettani jellemzők jelenléte, beleértve a fokozott sejtszintűséget, a lemezesedést, a spontán nekrózis fókuszait és a nukleáris atípiát (9-13). A 2016-os WHO-osztályozás kizárólag a patológiai leleteket használja a tumor fokozatának meghatározásához, a II. fokozatot az agyi invázió és a 4/10 nagy teljesítményű mező (HPF) feletti megnövekedett mitózis határozza meg (4). Ezenkívül három atipikus jellemző együttesen a tumor fokozott fokozatát eredményezi (4). A jövőre nézve a meningeóma molekuláris jellemzőit a közelmúltban összefüggésbe hozták a kiújulás kockázatával, és a jövőben valószínűleg ezeket fogják használni a meningeóma osztályozásában (14-16).
Míg a WHO osztályozások szintetizálják a rendelkezésre álló irodalmat, hogy egyértelmű elhatárolást hozzanak létre a tumor fokozatok között, a WHO I. fokozatú meningeóma kiújulásával kapcsolatos irodalom továbbra is vegyes. Például, míg az agyi invázió önmagában a WHO I-II. fokozatról a tumor fokozatának emelkedését eredményezheti, számos későbbi tanulmány nem talált kapcsolatot az agyi invázió és a kiújulás között, ami rávilágít a kiújulás előrejelzőinek további kutatására (10, 17, 18). A MIB-1 index hasznossága a meningeóma kiújulásának előrejelzésében szintén ellentmondásos; egy WHO I. fokozatú meningeómákon végzett vizsgálat csak >3%-os MIB-1 index esetén jelezte a kiújulás magasabb kockázatát, de más, az összes WHO fokozatot magában foglaló irodalomban >5% vagy >10%-os értéknél kimutatták a kiújulás magasabb előfordulását (9-11). Korábbi tanulmányok szintén >3%-os MIB-1 határértéket javasoltak csak a Simpson II vagy III reszekcióval rendelkező betegek esetében, ami tovább mutatja a MIB-1 határértékek és használatuk változatosságát (13). Ehhez képest korlátozott számú tanulmány vizsgálta az atipikus jellemzők hatását a WHO I. fokozatú meningeóma kiújulására; bár a patológiai elemzés során atipikus jellemzőket mutató WHO I. fokozatú tumorok esetében magasabb kiújulási kockázatot sugalltak (9).
Ezért a tanulmány célja az volt, hogy megvizsgálja a WHO I. fokozatú meningeómák kiújulásának klinikai, radiológiai és patológiai prediktorait. Tekintettel arra, hogy nincs konszenzus a MIB-1 használatáról a WHO I. fokozatú meningeomákban, a MIB-1 index klinikailag releváns határértékének meghatározásához rekurzív partícionáló analízist is alkalmaztunk. Ezután azonosítjuk a WHO I. fokozatú daganatok korai és posztmediális kiújulásának prediktorait.
Módszerek
Betegpopuláció
A 2007 és 2017 között WHO I. fokozatú meningeóma miatt kezelésen átesett betegeket retrospektív módon azonosítottuk egy intézményi adatbázis segítségével. A vizsgálatot a San Franciscó-i Kaliforniai Egyetem Intézeti Felülvizsgálati Bizottsága (IRB#13-12587) hivatalosan jóváhagyta. Az elektronikus orvosi nyilvántartásban rendelkezésre álló MIB-1 indexértékkel nem rendelkező betegeket kizárták. A vizsgálati időszak elején a MIB-1-et a kezelő neuropatológus belátása szerint szerezték be, de az idő előrehaladtával a MIB-1-et minden WHO I. fokozatú meningeomás betegről beszerezték.
Klinikai adatok
A betegek demográfiai, klinikai és kezelési jellemzőit, szövettani adatait és klinikai kimenetelét visszamenőlegesen áttekintették és összegyűjtötték. Az összegyűjtött klinikai adatok között szerepelt a betegek életkora, neme, Karnofsky Performance Status (KPS) a kezeléskor, a klinikai megjelenés és a meningeóma kezelésének korábbi története. A szövettani adatok közé tartozott a MIB-1 index, a lemezesedés/architektúra elvesztése, a fokozott sejtesség, a nekrózis, a nukleáris atípia és a csontinvázió jelenléte. Progeszteronreceptor (PR), epithelialis membrán antigén (EMA), CD34, S100, gliafibrilláris és savas fehérje (GFAP) festési eredményeket gyűjtöttünk, ha rendelkezésre álltak. A patológiai adatokat a műtéti beavatkozáskor készített patológiai jelentésből vettük ki. A tumor elhelyezkedését, méretét és a műtét előtti peritumorális ödéma jelenlétét a műtét előtti MRI-képalkotás segítségével határozták meg. Összegyűjtötték az elülső-hátsó (AP), a felső-alsó (SI) és a keresztirányú (TV) átmérőket. A preoperatív tumortérfogatot a nem gömb alakú tumortérfogatra vonatkozó egyenlet segítségével számították ki. A kezelés típusát hasonlóképpen gyűjtötték. A Simpson-fokozatot a műtéti jelentés alapján határoztuk meg. A bruttó teljes (GTR) és szubtotális reszekciót (STR) a műtét utáni mágneses rezonancia képalkotó (MRI) felvételek segítségével határozták meg.
A primer kimenetelek a tumor kiújulása és a kiújulásig eltelt idő voltak. A kiújulást a műtét utáni röntgenfelvételen határozták meg, mint helyi kiújulást vagy a reziduális tumor progresszióját. A kiújulásig eltelt időt a beteg kezelési időpontjától számítva határozták meg. A követés időtartamát a kezelés időpontjától az idegsebészeti klinikán tett utolsó látogatásig számítottuk. A másodlagos kimenetelek közé tartozott a korai és az utólagos kiújulás. A korai kiújulást a kezdeti kezeléstől számított 2 éven belüli kiújulásként definiáltuk (19). A posztmedián kiújulást úgy definiáltuk, hogy az >2 évvel a kezdeti kezelést követően következett be.
Statisztikai elemzés
A kategorikus és a folytonos változók összehasonlítására a Chi-négyzet és a Student-féle t-próbát használtuk. A kiújulás többváltozós visszafelé valószínűsített Cox-regressziós modelljét olyan változók felhasználásával állították fel, amelyek p < 0,200 volt az egyváltozós elemzés során. Hasonlóképpen, többváltozós visszafelé valószínűségi bináris logisztikus modelleket építettünk a korai és poszt-medián kiújulás előrejelzésére olyan változók felhasználásával, amelyek p < 0,200 az egyváltozós elemzés során. Rekurzív partícionáló analízist (RPA) alkalmaztak az általános, korai és posztmedián meningeóma kiújulás kulcsfontosságú kockázati tényezőinek további azonosítására. A statisztikai szignifikancia küszöbértékeként a p < 0,050 értéket használták. Minden statisztikai elemzést az SPSS 26 programmal végeztünk.
Eredmények
A betegek összes demográfiai adatai és klinikai kimenetele
A betegek összes demográfiai adatai, szövettani jellemzői és klinikai kimenetele az 1. táblázatban látható. A vizsgálatba összesen 239 WHO I. fokozatú meningeómás beteget vontak be. Az átlagéletkor 60,0 év volt, és a betegek 69,5%-a nő volt. A leggyakoribb megjelenő tünet a fejfájás volt (30,5%), amelyet a fokális neurológiai deficit követett (27,6%). A betegek többsége kizárólag műtéten esett át (98,3%), 2 beteg egyenként kapott adjuváns sugárterápiát (0,8%) vagy gamma-késes kezelést (0,8%). A betegek 38,1%-ánál a műtét előtti MRI-felvételeken peritumorális ödéma volt jelen. Az átlagos számított tumortérfogat 30,6 cm3 volt (tartomány = 0,23-215,73 cm3), a daganat átlagos legnagyobb mérete pedig 3,8 cm (tartomány = 0,6-11,3 cm). Összességében 91 (38,1%) tumor a koponyaalapon, 57 (23,8%) konvex tumor, 43 (18,0%) falx/paraszagittális elhelyezkedésű, 55 (23,0%) pedig egyéb elhelyezkedésű volt. A legtöbb betegnél bruttó teljes reszekciót végeztek (63,6%). A Simpson I, II, III és IV reszekció előfordulása 31,4, 29,7, 2,5 és 35,6% volt. Számos betegnél előfordultak atipikus jellemzők; a leggyakoribb atipikus jellemzők a csontinvázió (18,0%) és a lemezesedés/architektúra elvesztése (8,4%) voltak. Az átlagos követési idő 41,1 hónap volt (tartomány: 0-147 hónap).
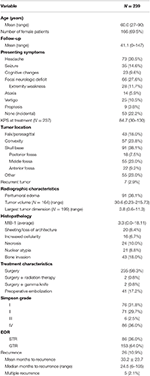
Táblázat. A betegek jellemzői, szövettani jellemzők, röntgenfelvételek és kimenetel.
A WHO I. fokozatú meningeóma kiújulásának előrejelzői
A kiújulás összesen 26 betegnél fordult elő, a kiújulásig eltelt idő mediánja 24,5 hónap volt (1. táblázat). A kiújulással és a kiújulás nélküli betegek összehasonlítása a 2. táblázatban található. Nem volt különbség az életkor (60,2 vs. 58,8, p = 0,582) és a női nem (61,5 vs. 70,4%, p = 0,353) tekintetében a kiújult tumorral rendelkező és a ki nem újult betegek között. A kezelési jellemzők hasonlóak voltak a csoportok között, mindkét csoportban a legtöbb beteg kizárólag műtétet kapott (100,0 vs. 98,1%, p = 1,000). A kiújuló tumorral rendelkező betegeknél azonban magasabb volt az STR előfordulása (61,5 vs. 32,7%, p = 0,004) és alacsonyabb a Simpson-féle I. fokozatú reszekció előfordulása (11,5 vs. 34,1%, p = 0,019). A peritumorális ödéma, a tumor mérete és a tumor térfogata hasonló volt a csoportok között. A szövettani elemzés során a kiújuló betegeknél tendenciaszerűen nagyobb volt a nukleáris atípia (19,2 vs. 7,5%, p = 0,061). A kiújulásos betegeknél az átlagos követési idő is magasabb volt (68,9 vs. 37,7 hónap, p = 0,001).
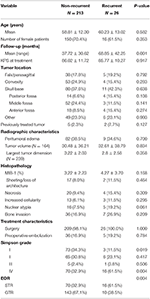
Táblázat. A kiújuló meningeómás betegek és a nem kiújuló meningeómás betegek összehasonlítása.
Az ezt követő backward likelihood cox-regressziós elemzés kiemelte a kiújulás és a hátsó fossa tumor elhelyezkedése közötti független kapcsolatot (HR = 5.25, CI 1,71-16,17, p = 0,004), a MIB-1 index (HR = 1,18, CI 1,05-1,34, p = 0,008), a nukleáris atípia (HR = 5,24, CI 1,73-15,92, p = 0,003) és az STR (HR = 5,66, CI 1,30-13,92, p < 0,001; 3. táblázat) között. A Kaplan-Meier-görbék, amelyek kiemelik a kiújulásmentes túlélést a hátsó fossa lokalizáció (p = 0,007), a nukleáris atípia (p = 0,137), a reszekció kiterjedése (p = 0,001) és a MIB-1 >4,5% (p = 0,001) tekintetében, az 1A-D ábrákon láthatók.
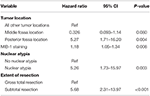
3. TÁBLA. Cox-regressziós elemzés a kiújulásra vonatkozóan.

1. ábra. A WHO I. fokozatú meningeóma kiújulásának kockázati tényezőinek Kaplan Meier-görbéi. (A) Nukleáris atípia (kék vonal) vs. nukleáris atípia hiánya (piros vonal) (X2 = 2,21, p = 0,137). (B) Posterior-fossa tumor lokalizációja (kék vonal) vs. egyéb lokalizáció (piros vonal) (X2 = 10,36, p = 0,001). (C) MIB-1 index >4,5% (kék vonal) vs. ≤4,5% (piros vonal) (X2 = 6,17, p = 0,013). (D) STR (kék vonal) vs. GTR (piros vonal) (X2 = 10,46, p = 0,001).
Predictors of Early vs. Post-median WHO Grade I Meningioma Recurrence
A nem recidiváló betegek és a korai vagy post-median recidiváló daganattal rendelkező betegek összehasonlítása a 4. táblázatban látható. A korai kiújulással rendelkező betegeknél nagyobb volt a szubtotális reszekció előfordulása (76,9 vs. 32,7%, p = 0,001). Náluk tendenciaszerűen nagyobb volt a nukleáris atípia előfordulása is (23,1 vs. 7,5%, p = 0,084) a szövettani vizsgálat során (4. táblázat). A medián utáni kiújulásban szenvedő betegeknél tendenciaszerűen nagyobb volt a hátsó fossa tumor lokalizációjának előfordulása (23,1 vs. 6,6%, p = 0,063) és a csontinvázió nagyobb előfordulása (38,5 vs. 16,9%, p = 0,064), valamint magasabb volt a MIB-1 index (5,55 vs. 3,22%, p = 0,098). Nem volt szignifikáns különbség a Simpson-osztályozás vagy a GTR-arányok között a poszt-medián recidívás betegeknél vs. a nem recidívás betegeknél (4. táblázat).
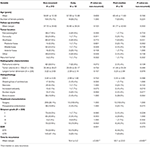
4. táblázat. Korai vs. medián utáni kiújulás.
Két többváltozós visszafelé valószínűségi bináris logisztikus modellel azonosították a korai vs. medián utáni kiújulás prediktorait (5. táblázat). A korai tumorrecidíva független előrejelzői közé tartozott a nukleáris atípia a szövettani vizsgálaton (OR = 6,45, CI 1,34-31,07, p = 0,020) és az STR (OR = 8,92, CI 2,18-36,46, p = 0,002). A posztmediális kiújulás egyetlen független prediktora a MIB-1 index volt (OR = 1,24, CI 1,05-1,45, p = 0,010), bár a hátsó fossa elhelyezkedése megközelítette a szignifikanciát (OR = 4,42, CI 0,954-20,49, p = 0,058; 5. táblázat).

5. táblázat. A posztmediális és korai tumorrecidíva bináris logisztikus modellje.
Recursive Partitioning Analysis of Recurrence
RPA-t végeztünk a meningeóma kiújulásának legfontosabb kockázati tényezőinek azonosítására (2. ábra). A cox-regressziós elemzéssel összhangban az STR volt az első partíció az általános kiújulás előrejelzésekor: Az STR-rezekciót végző betegek 18,6%-a kiújult, szemben a GTR-t végző 6,5%-kal. A következő döntési csomópont csak a GTR-betegeken belül a 4,5%-os MIB-1 cutoffot érintette, mivel a MIB-1 >4,5%-os értékkel rendelkező betegek 18,8%-a kiújult, szemben a MIB-1 ≤4,5%-os értékkel rendelkező betegek 3,3%-ával (2A ábra). Kifejezetten a medián utáni kiújulás tekintetében az RPA az első döntési csomópontot 5,83%-os MIB-1 cutoff értékkel azonosította: A MIB-1 >5,83%-os MIB-1 értékkel rendelkező betegek 22,2%-a kiújult, szemben a ≤5,83%-os MIB-1 értékkel rendelkező betegek 3,3%-ával. A későbbi döntési csomópont a hátsó fossa tumor lokalizációját használta: A hátsó fossa tumorral rendelkező betegek 13,3%-a kiújult, szemben az egyéb tumorhelyszínek 2,5%-ával (2B ábra). A korai kiújulásra vonatkozó RPA a reszekció kiterjedését jelölte meg elsődleges döntési csomópontként: Az STR betegek 11,6%-a kiújult, szemben a GTR betegek 2,0%-ával. A következő döntési csomópont a falx vagy a parasagittalis lokalizációt használta: A falx vagy parasagittalis tumorok 36,4%-a kiújult, szemben a többi tumorhelyszín 8,1%-ával (2C. ábra).
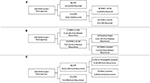
2. ábra. Rekurzív partícionáló elemzés, amely kiemeli a (A) teljes kiújulás, (B) a posztmediális kiújulás és (C) a korai kiújulás legfontosabb kockázati tényezőit.
Diszkusszió
Főbb eredmények
AHO I. fokozatú meningeóma kiújulása függetlenül összefügg a MIB-1 indexszel, a hátsó fossa tumor elhelyezkedésével, a nukleáris atípia jelenlétével és az STR-rel. Konkrétabban, a 4,5%-os MIB-1 indexet klinikailag releváns határértékként azonosították a WHO I. fokozatú meningeiómás betegek kockázat-stratifikációjában a GTR-t követően. Azoknak a betegeknek, akiknél a MIB-1 index >4,5% és a WHO I. fokozatú meningeóma GTR-je hasonló kiújulási kockázattal rendelkeztek, mint azok a betegek, akiknél STR volt. A további elemzés kiemelte a MIB-1-et, mint a posztmediális kiújulással összefüggő kritikus tényezőt, míg a reszekció kiterjedése volt a korai kiújulás fő tényezője.
A WHO I. fokozatú meningeóma kiújulásának előrejelzői
A korábbi tanulmányok hasonlóan értékelték a szövettani jellemzők, a klinikai jellemzők és a kiújulás közötti kapcsolatot valamennyi WHO-osztályú meningeóma esetében. Egy 901 beteget (716 WHO I. fokozatú, 174 II. fokozatú és 11 III. fokozatú) vizsgáló tanulmányban Gousias et al. nagyobb kiújulási kockázatot mutatnak ki a >10%-os MIB-1 indexű, magasabb WHO fokozatú, >6 cm-es daganatméretű, petroclivalis vagy cavernosus sinusban elhelyezkedő és multiplicitású meningeomák esetében (11). Gousias és munkatársai azonban nem értékelték a szövettani atípusos jellemzők jelenléte és a tumor kiújulása közötti kapcsolatot. Kifejezetten a WHO I. fokozatú meningeómák esetében Marciscano és munkatársai 148 WHO I. fokozatú meningeómás beteg teljes patológiai elemzéssel rendelkező kohorszát használták fel a kiújulással összefüggő változók azonosítására, különös tekintettel az atipikus patológiai jellemzők kiújulási kockázatra gyakorolt hatására (9). Érdekes módon a MIB-1 index >3% és a Simpson-rezekció mellett független kockázati tényezőként azonosították az atipikus jellegzetességek jelenlétét. A mi vizsgálatunk hasonlóan kiemeli a sebészi GTR-t és a nukleáris atípiát, mint atipikus jellemzőt, mint a kiújulás független prediktorait (3. táblázat), bár az egyes atipikus jellemzőket egymástól függetlenül értékeltük. A tumor elhelyezkedését is figyelembe vesszük a cox-regressziós modellünkben, tovább azonosítva a tumor hátsó fossa fossa-i elhelyezkedését, mint a kiújulás független kockázati tényezőjét. Míg Marciscano és munkatársai nem vonták be a tumor elhelyezkedését a progressziót előrejelző tényezők elemzésébe, Gousias és munkatársai hasonlóan a kiújulás kockázati tényezőjeként mutatják ki a petroclivalis tumor elhelyezkedését, bár az összes WHO meningeóma fokozatot figyelembe véve (9, 11). A hátsó fossa lokalizációhoz társuló magasabb kiújulási kockázat a hátsó fossa területén előforduló NF2-mutációk nagyobb gyakoriságának tudható be (14, 15, 20), bár ezt nem tudjuk teljes mértékben feltárni, mivel intézményünkben nem végzünk rutinszerűen genetikai vizsgálatot a meningeómák esetében. Ettől függetlenül további, nagyobb WHO I. fokozatú meningeomás betegcsoportokkal végzett vizsgálatokra van szükség ennek az összefüggésnek a vizsgálatához.
MIB-1 index és WHO I. fokozatú meningeóma kiújulása
A korábbi tanulmányokhoz hasonlóan (9, 11, 13, 21) ezután a daganat MIB-1 indexe és a kiújulás kockázata közötti összefüggést is értékeltük. Először a MIB-1 indexet értékeltük egy cox-regressziós modellben a teljes kiújulásra vonatkozóan, ahogyan azt korábban tárgyaltuk. A korábbi tanulmányokkal összhangban azt találtuk, hogy a magasabb MIB-1 index független kapcsolatban állt az általános megnövekedett kiújulási kockázattal. Tekintettel az irodalomban a MIB-1 határértékei közötti eltérésekre és a laboratóriumok közötti eltérésekre, a MIB-1-et kezdetben folytonos változóként értékeltük. Ezután a MIB-1 index határértékének meghatározására törekedtünk a betegpopulációnkban azáltal, hogy RPA-t használtunk az általános kiújulás modellezésére, amely 4,5%-os MIB-1 határértéket azonosított a GTR-ben szenvedő betegeknél (2A ábra). Érdekes módon ezeknél a betegeknél hasonló volt a kiújulás kockázata, mint az STR-rel rendelkező betegeknél, ami bizonyítja a MIB-1 hasznosságát a GTR-t követő betegeknél. Perry és munkatársai hasonlóan 4,2%-os MIB-1 indexet azonosítottak a GTR-t követő kiújulással kapcsolatban az egyváltozós elemzés alapján, bár az összes meningeóma fokozatot figyelembe véve (22).
A GTR-rel és MIB-1 >4,5%-kal rendelkező betegek 18,8%-os kiújulási aránya kiemeli az ilyen betegek szoros felügyeletének szükségességét, vagy akár az adjuváns sugárkezelés megfontolását, a beteg preferenciájától függően. A WHO I. fokozatú meningeóma reszekcióját követő adjuváns sugárterápia bizonyítottan csökkenti a kiújulást, különösen az STR-t követően (23-25), bár az STR-t követő megfigyelés továbbra is bevett gyakorlat (8). Soyuer és munkatársai 92 WHO I. fokozatú meningeomát vizsgáló tanulmányukban 91%-os progressziómentes túlélést (PFS) mutattak ki azoknál a betegeknél, akik az STR-t követően adjuváns sugárterápiában részesültek, ami jelentősen magasabb volt, mint az adjuváns sugárterápiában nem részesült betegek 38%-os PFS-e (24). Mivel vizsgálatunkban az STR-rel rendelkező betegeknél hasonló volt a kiújulás kockázata, mint a GTR-rel és MIB-1 >4,5%-kal rendelkező betegeknél, mindkét csoport esetében indokolt lehet az adjuváns sugárterápia. Nagyobb vizsgálatokra van azonban szükség a MIB-1 határértékünk és a kapcsolódó klinikai következmények további validálásához. Prospektív tanulmányokra is szükség van, amelyek az adjuváns sugárterápia alkalmazását vizsgálják WHO I. fokozatú meningeomákban.
Predictors of Early and Post-median WHO Grade I Meningioma Recurrence
Given the trend toward a later recurrence in patients with a elevated MIB >4.5% (1C. ábra), ezután arra törekedtünk, hogy megvizsgáljuk a prediktorok közötti különbségeket a korai (a kezelést követő 2 éven belül meghatározott) vagy posztmedián (a kezelést követő >2 éven belül kiújult) betegek között. Az irodalomban kevés tanulmány vizsgálta a korai kiújulás prediktorait meningeómák esetében. Budohoski és munkatársai tanulmánya a 220 atípusos meningeomából álló kohorszban a korai kiújulás prediktoraiként azonosította a parafalcinális elhelyezkedést, az STR-t és a peritumorális ödémát a radiológiai képalkotáson (26). Maillo és munkatársai hasonló tanulmánya a WHO I. fokozatú meningeomákban az interfázisú fluoreszcencia in situ hibridizáció (FISH) és a patológiai jellemzők felhasználásával azonosította a korai kiújulás (a kezelést követő 2,5 évben meghatározott) kockázati tényezőit, és megállapította, hogy a nagyobb tumorméret, a kariotípus-rendellenességek, a beteg életkora és a 10. kromoszóma rendellenességei a kiújulás fokozott kockázatával járnak együtt (19). A szerzők azonban nem vették figyelembe az atípia jelenlétét a patológián vagy a MIB-1 indexet. A WHO I. fokozatú meningiomás betegek granulárisabb patológiai és klinikai adatokkal rendelkező kohorszát felhasználva a bináris logisztikus regressziós modellezés során a korai kiújulás független prediktoraiként azonosítottuk a reszekció mértékét és a patológiás nukleáris atípiát (5. táblázat). Az RPA hasonlóképpen kimutatta a reszekció kiterjedésének fontosságát a betegek korai kiújulásra való kockázat-stratifikálásában (2C. ábra). Érdekes módon kiemelte a falx/parasagittális tumorlokalizációhoz kapcsolódó megnövekedett kockázatot is, ami megfelel a Budohoski és munkatársai (26) eredményeinek. A bináris logisztikus regressziós modellezés során a posztmedián tumor kiújulásának egyetlen szignifikáns előrejelzője a MIB-1 index volt, bár a tumor hátsó fossa fossa utáni elhelyezkedése megközelítette a szignifikanciát. Ez az RPA-n tovább igazolódott (2B. ábra). Meglepő módon a reszekció kiterjedése nem volt független előrejelzője a medián utáni kiújulásnak, mivel a medián utáni kiújulások többségénél GTR-t végeztek. A medián utáni kiújulások a WHO I. fokozatú meningeomának egy olyan kategóriáját emelhetik ki, amely molekulárisan agresszívebb és a GTR ellenére kiújul, tekintettel az emelkedett MIB-1 indexre és a hátsó fossa posterior elhelyezkedésére . A korai kiújulásokat jelentősen jobban befolyásolja a reszekció mértéke, és ennek következtében valószínűleg a reziduális tumor további növekedését jelentik, szemben a korábbi, teljesen reszekált tumor kiújulásával, ahogyan az a középmetszet utáni kiújulásoknál megfigyelhető. Így eredményeink potenciálisan két különböző molekuláris WHO I. fokozatú meningeóma altípust képviselnek. Azonban nagyobb betegcsoportokkal és molekuláris tumoradatokkal végzett jövőbeli vizsgálatokra van szükség a korai és a medián utáni kiújulások közötti molekuláris változások mögöttes különbségeinek további vizsgálatához.
Korlátozások
A vizsgálatunk korlátai közé tartozik a retrospektív jelleg és a kiújulás alacsony előfordulása. Tanulmányunkban a 2007-től kezdődő betegek is szerepelnek, és ennek következtében átfogja mind a 2007-es, mind a 2016-os WHO CNS osztályozási sémát. Az egyetlen jelentős változás a két osztályozás között azonban az agyi invázió mint a WHO II. fokozatú státusz egyedüli kritériumának hozzáadása volt. A kohorszunkban szereplő betegek közül csak kettőnél észleltek agyi inváziót a patológiai elemzés során, és egyik betegnél sem fordult elő recidíva. Ennek eredményeképpen nem hisszük, hogy a 2007-es osztályozási séma alapján osztályozott betegek bevonása jelentős hatással lett volna az eredményeinkre. Ezenkívül tanulmányunk a kezdeti reszekciót követő patológiai jelentésekre támaszkodik, a patológiai preparátumok központi felülvizsgálata nélkül. Ez a patológiai változók, például a nukleáris atípia és más hasonló patológiai leletek, amelyek megfigyelők közötti változékonyságot mutathatnak, nagyobb variabilitást eredményezhetnek (27, 28). A MIB-1 azonban viszonylag objektív mérőszám, amelynél kisebb a megfigyelők közötti variabilitás a patológiai laboratóriumon belül ugyanazt a módszert alkalmazó patológusok között (29). A MIB-1 vizsgálatával kapcsolatos gyakorlati szokások is változtak a vizsgálati időszak alatt az egyéni patológus preferenciáktól – amelyek a patológustól függően változtak – az összes betegnél végzett vizsgálatig. A patológusok által a MIB-1 vizsgálatról való döntés során figyelembe vett tényezők között szerepeltek a vizsgálatunkban szereplő atipikus jellemzők, így minimálisra csökkentve azok lehetséges hatását az eredményeinkre. Ezenkívül a vizsgálatunkba bevont összes meningeóma WHO I. fokozatú. Ennek eredményeképpen úgy véljük, hogy a vizsgálatba bevezetett bármilyen torzítás, amely a gyakorlási minták e változásain alapul, minimális. Végül, bár részletes klinikai és patológiai jellemzőket tartalmazunk, betegcsoportunkból hiányoznak a tumor genetikai és molekuláris változásaira vonatkozó információk, amelyekről kimutatták, hogy jelentős hatással vannak a tumor kimenetelére (15, 30-32). Így a WHO I. fokozatú meningeomák általános kiújulásának előrejelzésekor a hagyományos patológiai és klinikai változók mellett további nagy, több intézményt érintő vizsgálatokra van szükség, amelyek molekuláris/genetikai adatokat tartalmaznak. Ez magában foglalja a molekuláris/genetikai prognosztikai tényezők, például az egész genomra kiterjedő metilációs mintázatok (33, 34), a TERT promóter mutációk (35) és további tumormolekuláris adatok figyelembevételét is, tekintettel eredményeinkre, a korai és későbbi kiújulások egyedi genetikai/molekuláris, klinikai és patológiai előrejelzőinek jövőbeli vizsgálatai is indokoltak, tekintettel az orvosok terápiás döntéshozatalára gyakorolt lehetséges hatásukra.
Vizsgálatunk mindazonáltal részletes betekintést nyújt a kiújulás klinikai és szövettani prediktorairól, különösen a WHO I. fokozatú meningeomákban. Ezenkívül azonosítjuk azokat a betegeket, akiknél a MIB-1 >4,5%, mint akiknél a GTR-t követő kiújulás kockázata magas. Adatainkat arra is felhasználjuk, hogy betekintést nyújtsunk a korai és a WHO I. fokozatú meningeóma utáni kiújulások közötti különbségekbe, potenciálisan különböző WHO I. fokozatú meningeóma molekuláris alcsoportokat azonosítva. Eredményeink arra utalnak, hogy azoknál a betegeknél, akiknél a patológiai elemzés során emelkedett a MIB-1 index és a nukleáris atípia, a tumoruk hátsó fossa utáni elhelyezkedése és az STR magasabb a kiújulás kockázata, és szorosabb nyomon követést vagy akár adjuváns sugárterápiát kell fontolóra venni. Ezenkívül a 4,5% feletti MIB-1 indexű betegeknél hasonló a kiújulás kockázata, mint azoknál, akiknél a daganat STR-t végeztek, és potenciálisan szintén megfontolandó az adjuváns sugárterápia.
Következtetés
A WHO I. fokozatú meningeomák kiújulásának specifikus előrejelzőiről továbbra is kevés az irodalom. E tanulmány eredményei kiemelik a hátsó fossa tumor elhelyezkedését, a MIB-1 indexet, a nukleáris atípiát és a reszekció kiterjedését, mint az I. fokozatú meningeomák kiújulásával függetlenül összefüggő jelenségeket. Azt is kimutattuk, hogy a MIB-1 >4,5% és GTR-rel rendelkező betegeknél hasonló a kiújulás kockázata, mint az STR-rel rendelkező betegeknél. Végül a korai és posztmedián kiújulások differenciált elemzése kimutatta a MIB-1 index és a hátsó fossa elhelyezkedésének összefüggését a posztmedián kiújulásokban, míg a korai kiújulásokat szignifikánsabban befolyásolta a reszekció kiterjedése. További, az eredményeinket validáló és molekuláris/genetikai adatokat is tartalmazó vizsgálatokra van szükség a WHO I. fokozatú meningeomák kiújulásának további előrejelző tényezőinek azonosításához. Az ilyen vizsgálatok pontosabb keretet biztosíthatnának a betegek kockázati besorolásához és segíthetnék a terápiás döntéshozatalt, beleértve az adjuváns sugárterápia lehetőségét is.
Adatok hozzáférhetőségi nyilatkozata
A cikk következtetéseit alátámasztó nyers adatokat a szerzők indokolatlan fenntartás nélkül rendelkezésre bocsátják.
Etikai nyilatkozat
A humán résztvevőkkel végzett vizsgálatokat az UCSF intézményi felülvizsgálati bizottsága felülvizsgálta és jóváhagyta. A nemzeti jogszabályoknak és az intézményi követelményeknek megfelelően a vizsgálatban való részvételhez nem volt szükség írásbeli beleegyezésre.
Author Contributions
AH: koncepcióalkotás, módszertan, formai elemzés, vizsgálat, írás-eredeti tervezet, írás-ellenőrzés és szerkesztés, valamint vizualizáció. JY: koncepcióalkotás, módszertan, írás-ellenőrzés és szerkesztés. IK és SS: vizsgálat. J-SC: vizualizáció és formai elemzés. DR és MM: írás-ellenőrzés és szerkesztés. SM: írás-ellenőrzés és szerkesztés, koncepcióalkotás és módszertan. MA: írás-ellenőrzés és szerkesztés, valamint felügyelet. Minden szerző hozzájárult a cikkhez, és jóváhagyta a benyújtott változatot.
Érdekütközés
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
A recenzens BB a DR, MM és SM szerzőkkel való korábbi társszerzőségét jelentette be a kezelőszerkesztőnek.
1. A szerzők a szerzőkkel közösen írták a cikket. Ostrom QT, Cioffi G, Gittleman H, Patil N, Waite K, Kruchko C, et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2012-2016. Neuro Oncol. (2019) 21:v1-100. doi: 10.1093/neuonc/noz150
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Keresés English (2019) 21:v1-100. o. Karsy M, Guan J, Cohen A, Colman H, Jensen RL. A meningeomák orvosi kezelése. Jelenlegi helyzet, sikertelen kezelések és ígéretes távlatok. Neurosurg Clin N Am. (2016) 27:249-60. doi: 10.1016/j.nec.2015.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Brastianos PK, Galanis E, Butowski N, Chan JW, Dunn IF, Goldbrunner R, et al. Advances in multidisciplinary therapy for meningiomas. Neuro Oncol. (2019) 21:I18-31. doi: 10.1093/neuonc/noy136
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Google Scholar
. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Keresés English (2016) 131:803-20. Pettersson-Segerlind J, Orrego A, Lönn S, Mathiesen T. Sebészileg kezelt parasagittalis meningeomák hosszú távú, 25 éves követése. World Neurosurg. (2011) 76:564-71. doi: 10.1016/j.wneu.2011.05.015
PubMed Abstract | CrossRef Full Text | Google Scholar
6. 6. Vizsgálatok a neurológiai betegségekkel kapcsolatban. Van Alkemade H, De Leau M, Dieleman EMT, Kardaun JWPF, Van Os R, Vandertop WP, et al. Impaired survival and long-term neurological problems in benign meningioma. Neuro Oncol. (2012) 14:658-66. doi: 10.1093/neuonc/nos013
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Buerki RA, Horbinski CM, Kruser T, Horowitz PM, James CD, Lukas RV. A meningeomák áttekintése. Futur Oncol. (2018) 14:2161-77. doi: 10.2217/fon-2018-0006
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Rogers L, Barani I, Chamberlain M, Kaley TJ, McDermott M, Raizer J, et al. Meningeomák: tudásbázis, kezelési eredmények és bizonytalanságok. Egy RANO áttekintés. J Neurosurg. (2015) 122:4-23. doi: 10.3171/2014.7.JNS131644
PubMed Abstract | CrossRef Full Text | Google Scholar
9. JNS131644
PubMed Abstract | CrossRef Full Text | Google Scholar
. Marciscano AE, Stemmer-Rachamimov AO, Niemierko A, Larvie M, Curry WT, Barker FG, et al. Benignus meningeomák (WHO Grade I) atipikus szövettani jellemzőkkel: a szövettani jellemzők korrelációja a klinikai kimenetellel. J Neurosurg. (2016) 124:106-14. doi: 10.3171/2015.1.JNS142228
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Baumgarten P, Gessler F, Schittenhelm J, Skardelly M, Tews DS, Senft C, et al. Brain invasion in otherwise benign meningiomas does not predict tumor recurrence. Acta Neuropathol. (2016) 132:479-81. doi: 10.1007/s00401-016-1598-1
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Keresztmetszet teljes szöveg | Google Scholar
11. Gousias K, Schramm J, Simon M. The simpson grading revisited: agresszív műtét és annak helye a modern meningioma kezelésben. J Neurosurg. (2016) 125:551-60. doi: 10.3171/2015.9.JNS15754
PubMed Abstract | CrossRef Full Text | Google Scholar
12. JNS15754
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Matsuno A, Fujimaki T, Sasaki T, Nagashima T, Ide T, Asai A, et al. A recidiváló és nem recidiváló meningeomák proliferatív potenciáljának klinikai és szövettani elemzése. Acta Neuropathol. (1996) 91:504-10. doi: 10.1007/s004010050458
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Oya S, Kawai K, Nakatomi H, Saito N. A Simpson osztályozási rendszer jelentősége a modern meningeóma sebészetben: a fokozat integrálása a MIB-1 jelölési indexszel, mint a WHO I. fokozatú meningeómák kiújulásának előrejelzésének kulcsa – klinikai cikk. J Neurosurg. (2012) 117:121-8. doi: 10.3171/2012.3.JNS111945
PubMed Abstract | CrossRef Full Text | Google Scholar
14. JNS111945
PubMed Abstract | CrossRef Full Text | Google Scholar
14. JNS111945. Yuzawa S, Nishihara H, Tanaka S. A meningeóma genetikai tájképe. Brain Tumor Pathol. (2016) 33:237-47. doi: 10.1007/s100714-016-0271-7
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karsy M, Azab MA, Abou-Al-Shaar H, Guan J, Eli I, Jensen RL, et al. Clinical potential of meningioma genomic insights: a practical review for neurosurgeons. Neurosurg Focus. (2018) 44:E10. doi: 10.3171/2018.2.FOCUS1849
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Patel AJ, Wan YW, Al-Ouran R, Revelli JP, Cardenas MF, Oneissi M, et al. Molecular profiling predicts meningioma recurrence and reveals loss of DREAM complex repression in aggressive tumors. Proc Natl Acad Sci USA. (2019) 116:21715-26. doi: 10.1073/pnas.1912858116
PubMed Abstract | CrossRef Full Text | Google Scholar
17. PhD. Spille DC, Heß K, Sauerland C, Sanai N, Stummer W, Paulus W, et al. Brain invasion in meningiomas: incidencia és összefüggések a klinikai változókkal és a prognózissal. World Neurosurg. (2016) 93:346-54. doi: 10.1016/j.wneu.2016.06.055
PubMed Abstract | CrossRef Full Text | Google Scholar
18. PiŽem J, Velnar T, Prestor B, Mlakar J, Popović M. Brain invasion assessability in meningiomas is related to meningioma size and grade, and can be improved by extensive sampling of the surgicalically removed meningioma specimen. Clin Neuropathol. (2014) 33:354-63. doi: 10.5414/NP300750
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Hírlevelek a következő cikkekből:
. Maillo A, Orfao A, Espinosa AB, Sayagués JM, Merino M, Sousa P, et al. Early recurrences in histologically benign/grade I meningiomas are associated with large tumors and coexistence of monosomy 14 and del(1p36) in the ancestral tumor cell clone. Neuro Oncol. (2007) 9:438-46. doi: 10.1215/15228517-2007-026
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Youngblood MW, Duran D, Montejo JD, Li C, Omay SB, Özduman K, Sheth AH, et al. Correlations between genomic subgroup and clinical features in a cohort of more than 3000 meningiomas. J Neurosurg. (2019). doi: 10.3171/2019.8.jns191266. .
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Chen WC, Magill ST, Wu A, Vasudevan HN, Morin O, Aghi MK, et al. Histopathological features predictive of local control of atypical meningioma after surgery and adjuvant radiotherapy. J Neurosurg. (2019) 130:443-50. doi: 10.3171/2017.9.JNS171609
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Perry A, Stafford SL, Scheithauer BW, Suman VJ, Lohse CM. A MIB-1, a p53 és a DNS áramlási citometria prognosztikai jelentősége teljesen reszekált primer meningeomákban. Cancer. (1998) 82:2262-9. doi: 10.1002/(SICI)1097-0142(19980601)82:11<2262::AID-CNCR23>3.0.CO;2-R
PubMed Abstract | CrossRef Full Text | Google Scholar
23. AID-CNCR23>3.0.CO;2-R
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Ohba S, Kobayashi M, Horiguchi T, Onozuka S, Yoshida K, Ohira T, et al. Long-term surgical outcome and biological prognostic factors in patients with skull base meningiomas: clinical article. J Neurosurg. (2011) 114:1278-87. doi: 10.3171/2010.11.JNS10701
PubMed Abstract | CrossRef Full Text | Google Scholar
24. JNS10701
PubMed Abstract | CrossRef Full Text | Google Scholar
. Soyuer S, Chang EL, Selek U, Shi W, Maor MH, DeMonte F. Sugárterápia a jóindulatú agyi meningeóma műtétje után. Radiother Oncol. (2004) 71:85-90. doi: 10.1016/j.radonc.2004.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Hosszú időn át tartó vizsgálat, amely során az orvosok és az orvostudományi szakemberek is részt vettek a vizsgálatban. Park S, Cha YJ, Suh SH, Lee IJ, Lee KS, Hong CK, et al. Kockázati csoporthoz igazított adjuváns sugárterápia WHO I. és II. fokozatú koponyaalapi meningeóma esetén. J Cancer Res Clin Oncol. (2019) 145:1351-60. doi: 10.1007/s00432-019-02891-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. PhD. Budohoski KP, Clerkin J, Millward CP, O’Halloran PJ, Waqar M, Looby S, et al. Predictors of early progression of surgical treated atypical meningiomas. Acta Neurochir. (2018) 160:1813-22. doi: 10.1007/s00701-018-3593-x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. 27. De La Monte SM, Flickinger J, Linggood RM. A meningeomák szubtotális reszekciót követő kiújulását előrejelző szövettani jellemzők. Am J Surg Pathol. (1986) 10:836-43. doi: 10.1097/00000478-198612000-00002
PubMed Abstract | CrossRef Full Text | Google Scholar
28.
28. Backer-Grøndahl T, Moen BH, Torp SH. Az emberi meningeomák szövettani spektruma. Int J Clin Exp Pathol. (2012) 5:231-42.
PubMed Abstract | Google Scholar
29. Rezanko T, Akkalp AK, Tunakan M, Sari AA. MIB-1 számlálási módszerek meningeomákban és a patológusok közötti egyetértés. Anal Quant Cytol Histol Histol. (2008) 30:47-52.
PubMed Abstract | Google Scholar
30. Pérez-Magán E, Campos-Martín Y, Mur P, Fiaño C, Ribalta T, García JF, et al. Genetic alterations associated with progression and recurrence in meningiomas. J Neuropathol Exp Neurol. (2012) 71:882-93. doi: 10.1097/NEN.0b013e31826bf704
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Vö. Linsler S, Kraemer D, Driess C, Oertel J, Kammers K, Rahnenführer J, et al. A meningeóma progressziójának és kiújulásának molekuláris biológiai meghatározásai. PLoS ONE. (2014) 9:e94987. doi: 10.1371/journal.pone.0094987
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Barbera S, Miguel TS, Gil-Benso R, Muñoz-Hidalgo L, Roldan P, Gonzalez-Darder J, et al. Genetic changes with prognostic value in histologically benign meningiomas. Clin Neuropathol. (2013) 32:311-7. doi: 10.5414/NP300580
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Google Scholar
33. PubMed Abstract | CrossRef Full Text | Google Scholar
. Gao F, Shi L, Russin J, Zeng L, Chang X, He S, et al. DNS-metiláció a meningeomák rosszindulatú átalakulásában. PLoS ONE. (2013) 8:e54114. doi: 10.1371/journal.pone.0054114
PubMed Abstract | CrossRef Full Text | Google Scholar
34. MTA doktori iskola. Vengoechea J, Sloan AE, Chen Y, Guan X, Ostrom QT, Kerstetter A, et al. Methylation markers of malignant potential in meningiomas. J Neurosurg. (2013) 119:899-906. doi: 10.3171/2013.7.JNS13311
PubMed Abstract | CrossRef Full Text | Google Scholar
35. JNS13311
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Lu VM, Goyal A, Lee A, Jentoft M, Quinones-Hinojosa A, Chaichana KL. A TERT promóter mutációk prognosztikai jelentősége meningeomában: szisztematikus áttekintés és metaanalízis. J Neurooncol. (2019) 142:1-10. doi: 10.1007/s11060-018-03067-x
PubMed Abstract | CrossRef Full Text | Google Scholar