Introduction
A rizs összetett gyökérarchitektúrával rendelkezik, melyben embrionális és posztembrionális gyökerek keverednek. A csírázás során először a gyökérsarjak jelennek meg, amelyeket nem sokkal később az embrionális koronagyökerek követnek (Rebouillat és mtsai., 2009; Coudert és mtsai., 2010). A hajtás apikális merisztéma aktivitásából származó első posztembrionális gyökerek néhány nappal a csírázás után jelennek meg. Az adventív gyökereket koronagyökereknek vagy koronagyökereknek is nevezik, és a növény egész életében keletkeznek.
A rizs belső gyökér anatómiája jól le van írva, különösen a csíranövény-stádiumokban (Rebouillat et al., 2009). Az epidermisz és az érzőszövetek között több koncentrikus szövet található (a perifériától a sztéléig) (1. ábra). Ezeket a szöveteket, amelyeket együttesen “alapszövetnek” neveznek, néha “kéregnek” is nevezik (Lux et al., 2004). Itt megtartjuk az általános kifejezést, azaz az alapszövetet az exodermális, szklerenchimális, kérgi és endodermális szövetek leírására. A “kéreg” alatt az endodermisz és a szklerenchima között elhelyezkedő szövetet értjük.
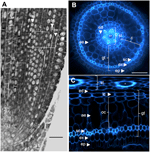
1. ábra. Egy 6 napos Nipponbare radicula anatómiája. (A) Egy rögzített és paraplastba ágyazott radicula hosszmetszete. Sáv = 100 μm. (B) Egy friss radicula keresztmetszete UV-fényben megfigyelve. Sáv = 50 μm. (C) A B poláris transzformált nézete. A szövetek rétegei a következőképpen vannak jelölve: sztélé (st), alapszövet (gt), amely több sejtrétegből áll: egy réteg endodermisz (ed), több réteg kéreg (c), egy réteg szklerenchima (sc) és egy réteg exodermisz (ex). Az endodermális (ed) és exodermális (ex) rétegek könnyen azonosíthatók a fluoreszcencia hiánya/csökkenése alapján e sejtek sejtfalközpontjaiban. A radiculát egy epidermiszréteg (ep) védi. Kétféle kéregréteg azonosítható: a belső kéreg (ic), amely az endodermisz (ed) mellett helyezkedik el, és a külső kéreg (oc), amely végül az aerenchimát (ae) fogja alkotni. A sztélében figyeljük meg a nagy központi metaxiléma (cx) jelenlétét, amelyet 6 metaxiléma (x) ér vesz körül.
A talajszövet több, azonos parenchimatikus eredetű, de különböző specifikus tulajdonságokkal rendelkező szövetrétegből áll, amelyek különböző és fontos szerkezeti és funkcionális szerepet játszanak a gyökerekben. Az exodermisz és az endodermisz például apoplasztikus gátak, amelyek szabályozzák a víz és a tápanyagok sugárirányú szállítását a talajból a fotoszintetizáló szervekbe, ezt a funkciót leginkább a szuberin lamellák lerakódása és a másodlagos sejtfal differenciálódása biztosítja (Gregory, 2006). A szklerenchimák lignifikált sejtek, amelyek kritikus gátat jelentenek egyes fémekkel szemben, és valószínűleg mechanikai támogató szerepet játszanak (Huang et al., 2012). E három egyrétegű szövettel ellentétben a rizskocsányban a kérgi szövet négy vagy öt rétegből áll. Ezt a középső kéregnek vagy mezodermisznek is nevezett szövetet a rizsben az aerenchimák kialakulásához vezető skizogén térszerkezet jellemzi (Justin és Armstrong, 1991; Kawai és mtsai., 1998). Az aerenchima fontos szerepet játszik az árvízi körülményekkel szembeni toleranciában, és biztosítja a folyamatos oxigénáramlást a hajtásból a gyökérbe, lehetővé téve a gyökér növekedését anoxikus körülmények között. A kéregnek számos faj gyökérfiziológiájában fontos, de változó funkciója van, és részt vesz a tárolásban, az árvíztűrésben vagy a szimbiotikus kölcsönhatásokban (Lux et al., 2004).
A gyökérgyökér és a koronagyökér háromféle oldalgyökeret termel: kis oldalgyökereket (SLR) és kétféle nagy oldalgyökeret (Kawata és Shibayama, 1965; Kono et al., 1972; Rebouillat et al., 2009). Ez a felosztás a (i) gyökérátmérőn alapul: Az SLR-ek a legkisebbek (50-60 μm) és az L-LLR-ek a legnagyobbak (120-150 μm), (ii) az elágazások, amelyek csak az LLR-eken figyelhetők meg, (iii) a központi metaxilemaedény jelenléte csak az LLR-eken, és (iv) a szklerenchima réteg jelenléte csak az L-LLR-eken (Kono et al., 1972; Kawata et al., 1977; Rebouillat et al., 2009). Ezen osztályozás ellenére az oldalgyökerek, különösen az SLR-ek belső gyökérszöveteinek azonossága továbbra is bizonytalan. Valóban, Rebouillat et al. (2009) és Kawata et al. (1977) egyaránt azt állította, hogy az SLR talajszövetét az endodermisz, a szklerenchima és az exodermisz alkotja (belülről kifelé haladva), míg Kono et al. (1972) a belső kérgi szklerenchymás sejtréteg hiányát írta le az SLR-ekben és a T-LLR-ekben.
A dilemma megoldásához, valamint általában az egyes szövetek fejlődésének és működésének tanulmányozásához identitásmarkerek használatára van szükség. Az eddig használt szöveti markerek többsége morfológiai marker vagy hisztokémiai festék, amelyek hasznos módot biztosítottak a sejtidentitás jellemzésére. A berberin kimutatja a szuberin jelenlétét a sejtfalakban, amely szinte kizárólag az egyes endodermasejteket körülvevő Casparian-csíkokban található, és így az endodermális identitás jó közvetett markere (Brundett és mtsai., 1988). Az A. thaliana-ban szövetspecifikus markereket is kifejlesztettek szövetspecifikus promóterek segítségével, amelyeket riportergénekkel (GUS és/vagy GFP) fuzionáltak genetikailag módosított növényekben. A SCARECROW promótert például endodermális identitás markerként használják (Sugimoto et al., 2010). A QC25 és QC46 enhancer trap GUS vonalakat (Sabatini et al., 2003) és a QHB rizsben (Kamiya et al., 2003) szintén nyugalmi központ (QC) markerként azonosították QC-specifikus expressziójuk alapján. Az e markerek iránti érdeklődés ellenére csak néhány áll rendelkezésre, és szinte kizárólag A. thaliana-ban. Hátrányaik is vannak. Például a SCARECROW (SCR) promóter “endodermisz” markerként való használatának alkalmassága vitatható, amikor az SCR és SHORT ROOT (SHR) földszöveti differenciálódásban betöltött szerepének konkrét kérdéseivel foglalkozunk. Az SCR és SHR gének ugyanis önmagukban részt vesznek az endodermisz/kéreg kialakulásában (Wu és Gallagher, 2014). A. thaliana-ban az egyetlen elérhető gyökérkéreg marker a Co2 és Co3 promóterek (Heidstra et al., 2004; Ten Hove et al., 2010). Rizsben ezeket a kéregmarkereket még nem használják, mivel a Co2 és Co3 géneknek nincsenek egyértelmű ortológjai. Rizsben eddig csak közvetett morfológiai markereket használtak, például az aerenchimaképződést a kérgi identitáshoz (Rebouillat et al., 2009).
A markerek másik osztálya a növényi sejtfalak ellen irányuló, kereskedelmi forgalomban kapható antitestek (http://www.plantprobes.net/index.php). Ezeket a markereket a múltban alig használták, de hatékonyságuk bizonyított. A CCRC-M2 és JIM13 sejtfal antitesteket például A. thaliana-ban használták annak kimutatására, hogy a shr mutánsban jelenlévő egyetlen belső szöveti réteg kérgi identitású, míg az scr mutánsban az alapszöveti réteg többféle identitást mutat (Di Laurenzio et al., 1996; Helariutta et al., 2000). Ezeknek a markereknek számos előnye van: egyszerűségük és a különböző fluorokrómokhoz kapcsolt másodlagos antitestek kombinálásának lehetősége az autofluoreszcenciával való átfedés korlátozása érdekében, nem igényelnek genetikai transzformációt, és más markerosztályok kiegészítésére is használhatók.
Ebben a cikkben először egy egyszerű, közepes áteresztőképességű protokollt írunk le friss vibrátomos szövetmetszetek immunjelölésére. Ennek a protokollnak a segítségével rizsgyökerek radiális metszeteit egy 174 sejtfal-antitestet tartalmazó nagy könyvtárral vizsgáltuk. Ezek közül nyolc kéregspecifikus markert azonosítottunk, és kimutattuk, hogy a rizs kétféle, eltérő identitású kéregszövettel rendelkezik. Ezeket a rétegeket belső és külső kéregnek neveztük el a gyökérszelvényekben elfoglalt anatómiai helyzetük alapján. E kéregspecifikus markerek hasznosságának bizonyítására három ilyen antitest segítségével tisztáztuk az oldalgyökerek talajszöveti azonosságát. Különösen az SLR-ekben mutattuk ki, hogy a belső szöveti réteg külső kérgi identitással rendelkezik. Protokollunk elég általános ahhoz, hogy bármely fajban felhasználható legyen szöveti markerek kifejlesztésére anélkül, hogy transzgénikus növényeket kellene létrehozni. Ez a protokoll könnyen adaptálható friss hajtással, levéllel, gyökérrel vagy más növények bármely szövetével, és egyszerű és könnyű módját jelenti a szövetspecifikus markerek azonosításának. Ráadásul ezek a markerek más molekuláris markerekkel együtt is használhatók.
Eredmények
Rizs gyökér radiális metszeteiben lévő sejtfal-antitestek immunoprofilozása a kéregrétegekre specifikus antitesteket mutat ki
A kéregsejtekre vonatkozó antitest-alapú markerek azonosításának céljával először is létrehoztunk egy protokollt a friss rizsgyökerek radiális metszeteinek közepes áteresztőképességű immunjelölésére (lásd az Anyagok és módszerek és a Kiegészítő 1. ábra részleteit). Ezután a sejtfal komponensek ellen termelt monoklonális antitestekkel (a Complex Carbohydrate Research Center (CarboSource Services, Athens Georgia, USA) és Paul Knox Cell Wall lab (University of Leeds, UK), lásd részletesen Anyagok és módszerek)) végeztünk szűrést a kéregmarkerek azonosítására. A 174 vizsgált antitestből csak 12 maradt meg, mint feltételezhetően kéregspecifikus. Megismételhetőségüket két további kísérlet elvégzésével teszteltük, és arra a következtetésre jutottunk, hogy nyolc antitest hasonló és robusztus profilt mutatott a három ismétlés között (2. ábra). Öt antitest (JIM7, M14, M38, M130 és M131) ugyanazt az immunjelölési mintázatot mutatta a kéregben. Csak a nem szomszédos sejtfalakat jelölték, ami az összes kéregsejt egyedi “gyémánt alakú” jelölését eredményezte. A három másik antitest (LM5, M133 és M107) esetében a jelölés a kéregben és néha a szklerenchimasejtekben volt kimutatható, különösen az LM5 és M107 antitestek esetében. A jel homogén volt a kéreg sejtfalán, de sokkal gyengébb volt a belső kéregrétegekben (az endodermális réteggel szomszédos kéregréteg), mint a külső kéregrétegekben. Így ezek az antitestek mindegyike, amelyek profilja komplementer a kérgi szövetekhez, olyan specifikus markerek, amelyek felhasználhatók a kérgi sejtek identitásának elemzésére. Ráadásul a két különböző, két szubkortikális területet meghatározó kérgi jelölés arra utal, hogy a külső és a belső rétegek különálló molekuláris identitással rendelkeznek, amit ezek az antitestek feltártak.
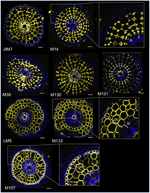
2. ábra. Nyolc specifikus kéreg antitest (JIM7, M14, M38, M130, M131, LM5, M133 és M107) azonosítása a monoklonális sejtfal-antitest könyvtárból kiszűrt 174 közül. Minden egyes antitest esetében az immunhisztológiai jelölés után konfokális mikroszkóp alatt készültek a keresztmetszetek összevont képei: sárga színben az antitest mintázata 561 nm-en, kékben pedig a sejtfal autofluoreszcenciája UV-fényben. Öt antitest (JIM7, M14, M38, M130 és M131) hasonló profilt mutat minden megfestett kérgi sejtrétegen belül (rombusz alakzatok). Három antitest (LM5, M133 és M107) homogén módon jelölte a kérgi sejtfalakat. Megjegyzendő, hogy ezeknél az antitesteknél a belső kérgi (ic) rétegek nem festődnek a külső kérgi (oc) rétegekhez képest. A betétek a megfelelő képek közelképeit mutatják. Sávok = 20 μm.
Az ImageJ szoftver “polar transformer” bővítményét (http://imagej.nih.gov/ij/) használva a gyökérmetszetek képeit (1B,C ábra; Schneider et al., 2012; Lartaud et al., 2014), e két szubkortikális réteg néhány sajátosságát emeltük ki. A belső sejteket vastag sejtfal jellemezte a külső sejtekhez képest, amelyek különböző, a sejtfal összeolvadásából származó, levegőt tartalmazó üregeket mutattak. A belső kéregsejtek lapos, endodermális sejtekre emlékeztető alakot is mutattak, ellentétben a külső sejtekkel, amelyek kerekebbek voltak. Ezen az átalakított képen a sejt belső oldalától a külső oldal felé futó sugárirányú sejtfal, az endodermális és exodermális sejtek autofluoreszcenciája nem látható, feltehetően a Caspar-csíkok jelenléte miatt. Hasonlóképpen, de kisebb mértékben, az autofluoreszcenciától mentes kis lyukak voltak láthatók a belső kérgi sejtek radiális sejtfalán is.
Minden oldalgyökértípus csak külső kéregszövettel rendelkezik
A kéregmarkerek hasznosságának bizonyítására és a sejtidentitás jellemzésére a három rizs oldalgyökértípust (L-LLR, T-LLR és SLR) három ilyen antitesttel (M107, M133 és M14) jelöltük. Ehhez a kísérlethez, mivel az L-LLR-ek nem gyakran fejlődnek Petri-csészén, az oldalgyökereket 2 hétig hidroponikus körülmények között nevelt rizs palántákból gyűjtöttük. Először az egyes oldalgyökértípusok alapszöveti szerveződését elemeztük a sejtfalak autofluoreszcenciájának megfigyelésével a gyökérmetszetek keresztirányú és poláris nézeteiben (3. ábra). Ez az első elemzés kissé eltérő belső radiális anatómiát mutatott ki a három oldalgyökértípus esetében. Az UV-fényben megtekintett gyökérszelvényekhez hasonlóan az endodermális, illetve exodermális szövetek a radiális sejtfalak közepén a fluoreszcencia elhalványulása alapján azonosíthatók. Ez a két szövet minden oldalgyökérben jelen volt. Az endodermisz és az exodermisz között az L-LLR-ekben és a T-LLR-ekben több szöveti réteg volt jelen, míg az SLR-ekben csak egyetlen (azonosítatlan) sejtréteg volt. Az L-LLR-ek anatómiája a szemináriumgyökerekhez hasonlított, és az endodermiszen kívül, az aerenchimaszövet kialakulásakor könnyen azonosítható volt a kérgi szövet több rétege. Ezenkívül megfigyelhető volt egy sűrűn tömörített, széles sejtfalakkal rendelkező sejtekből álló szklerenchimaréteg is. A kísérlettől függően ez a sejtréteg nem mindig volt teljesen kifejlődve. A T-LLR metszeteken a külső réteg a kérgi szövetre, a belső réteg pedig az egyetlen (nem azonosított) SLR rétegre hasonlított.
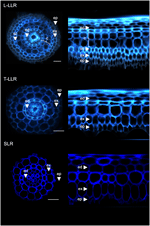
3. Ábra. A nagy oldalgyökér típusok (Large-LLR és Thin-LLR) és a kis oldalgyökér (SLR) szöveti összetétele. A palántákat 2 héten keresztül hidroponikus körülmények között neveltük. A sejtfal autofluoreszcenciája a keresztmetszeteken és a poláris transzformált nézetben UV-fényben. A szövetek jelölése a következő: epidermisz (ep), exodermisz (ex), cortex (c), endodermisz (ed). Megjegyzendő, hogy az epidermisz (ep) a kísérlet során gyakran töredezett volt. Sávok = 20 μm.
Az SLR és a T-LLR alapszöveteiben jelenlévő sejtrétegek azonosításához és az L-LLR-ekben a kéreg azonosságának megerősítéséhez három kéreg-specifikus antitesttel (M107, M133 és M14; 4. ábra) immunjeleztünk oldalgyökérmetszeteket. Az M107 és M133 antitestek az endodermisz és exodermisz között elhelyezkedő összes sejtréteget megjelölték minden oldalgyökérben. Az ezen antitestek radikális festődése alapján ez a megfigyelés azt jelezte, hogy ezek a sejtrétegek szklerenchimával vagy kérgi identitással rendelkezhetnek. Az a tény azonban, hogy az M14 ezeket a rétegeket is immunjelölte, különösen az SLR metszetekben, egyértelműen bizonyítja, hogy ezek a rétegek külső kérgi identitással rendelkeznek.

4. ábra. A nagy oldalsó gyökértípusok (Large-LLR és Thin-LLR) és a kis oldalsó gyökér (SLR) M107, M133 és M14 immunjelölésű metszeteinek összevont képei. A palántákat 2 héten keresztül hidroponikus körülmények között neveltük. Sárgával az ellenanyagjelölés 561 nm-en, kékkel az autofluoreszcencia UV-fényben. A szövetek jelölése a következő: epidermisz (ep), exodermisz (ex), cortex (c), endodermisz (ed). Megjegyzendő, hogy az epidermisz (ep) a kísérlet során gyakran töredezett volt. Sávok = 20 μm.
A külső kérgi sejtrétegek számának változása (egy az SLR-ben, kettő a T-LLR-ben, három az L-LLR-ben és négy-öt a radiculában) jelentős szerepet játszik a rizs gyökérátmérőjében (5. ábra).
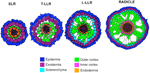
5. ábra. Az oldalgyökér és a radicula szöveteinek sematikus ábrázolása.
Következtetések
A növényekben a szubkortikális területek minősítésére már különböző kifejezéseket használtak. Például az itt vizsgálthoz hasonló “belső” lignifikált kéregréteg jelenlétét már leírták vadrizsben (Yang et al., 2014). Kukoricában a két kérgi területet másképp határozzák meg (Baluška et al., 1993). A “belső” domén aerenchimát képez, ami itt a külső kéregnek felel meg, a “középső-külső” kéreg pedig egy lignifikált támasztószövet, ami szklerenchima lehet. Arabidopsisban szintén leírtak egy “középső kéreg” sejtréteget, amely a kérgi monoréteg és az endodermisz között helyezkedik el (Baum és mtsai., 2002; Paquette és Benfey, 2005). A legújabb eredmények arra utalnak, hogy ez a kéregréteg, amelynek kialakulását többek között a GA, az oxidatív stressz, valamint az SHR és SCR szabályozza, szerepet játszik az abiotikus toleranciában (Paquette és Benfey, 2005; Cui és Benfey, 2009; Pauluzzi és mtsai., 2012; Wu és Gallagher, 2014). Érdekes, hogy ezt a réteget jellegzetes alakú, spirálszerű rétegként is leírják (Baum és mtsai., 2002). Lehet, hogy ez az Arabidopsis “középső kéregrétege” funkcionálisan és szerkezetileg hasonló a rizs radicula belső kéregrétegéhez? A rizs hosszanti és keresztirányú metszeteiben a belső kéregréteg általában szintén hélixet alkot, ami arra utal, hogy ez a két szöveti réteg hasonló lehet. Arabidopsisban a “középső kéregréteg” az endodermisz periklinális osztódásából származik, amely a csírázás után 7-14 nappal jelenik meg a QC-től távolabb (Paquette és Benfey, 2005). Új eszközökre lesz szükség e fontos paraméterek rizsben történő ellenőrzéséhez. Eddig például nem írtak le olyan mutánst, amely befolyásolná e réteg kialakulásának időzítését. Ezenkívül a rizs QC képalkotásának technikai fejlődésére is szükség van. Mindazonáltal a kéregspecifikus markereink új eszközt kínálnak a belső kéreg (rizs) vs. “középső kéreg” (Arabidopsis) kialakulásában részt vevő funkció és molekuláris hálózat összehasonlításához. Laboratóriumunkban folyamatban van a belső és külső kéreg kialakulásának molekuláris meghatározóinak azonosítása, az SCR és SHR rizs-ortológok a rizs gyökerekben történő kéregképződés szabályozásának első jelöltjei (Pauluzzi et al.,
Anyagok és módszerek
Növényi anyag
hatnapos magoncok
Az Oryza sativa L. ssp. japonica Nipponbare fajta palántáit steril Petri-csészékben (Corning, 431301; 20 × 20 cm) termesztettük függőlegesen, ellenőrzött körülmények között (nappali/éjszakai ritmus: 12/12 óra, 28/25 °C, fényintenzitás: 500 μE m-2 s-1). Először a magokat felületi sterilizálással, 70%-os etanolban történő ~1 perces öblítéssel sterilizáltuk. Ezután az etanolt 40%-os fehérítőszerből álló, három csepp tween 80-at (Sigma-Aldrich P4780-500 ml) tartalmazó oldattal helyettesítettük desztillált vízben. A magokat 30 percig áztattuk ebben az oldatban enyhe keverés mellett, majd legalább négyszer öblítettük le steril desztillált vízzel. Forró (~50°C) autoklávban sterilizált, fele erősségű Murashige és Skoog (MS/2) táptalajt (250 mL) öntöttünk Petri-csészékbe, és ~45 percig hagytuk megszilárdulni. Az MS/2 szilárd táptalaj 2,15 g.L-1 MS táptalaj alapsókeverékből (Duchefa Biochemie, M0221), 75 mg.L-1 MS vitaminkeverékből (Duchefa Biochemie, M0409) és 8 g.L-1 II. típusú agarózból (Sigma-Aldrich, A6877) áll. A steril magvakat ezután a megszilárdult MS/2 táptalajba nyomjuk úgy, hogy a gyökérzet lefelé irányuljon. A gyökereket 6 napos növekedés után szedtük le.
Négyhetes növények
A vízben történő csíráztatás 3 napja után a palántákat ellenőrzött körülmények között (nappali/éjszakai ritmus: 12/12 óra, 28/25°C, fényintenzitás: 500 μE m-2 s-1, relatív páratartalom: 55%) hidroponikus rendszerbe helyeztük át. A hidrokultúrás rendszer egy 50 literes műanyag dobozból áll, amely 30 liter hidrokultúrás oldatot tartalmaz, és amelyre 1 cm vastag habmatracot helyeztek. A habmatracot résekkel áttörték, hogy a csemeték száralapjai megmaradjanak. A hidroponikus közeg (NH4)2SO4 (0,5 mM), MgSO4.7H2O (1,6 mM), Ca(NO3)2.4H2O (1,2 mM), KNO3 (0,7 mM), FeSO4 (0,1 mM), Na2EDTA (0,1 mM), MnSO4. H2O (1,7 μM), (NH4)6Mo7O24.4H2O (0,2 μM), ZnSO4.7H2O (0,2 μM), CuSO4.5H2O (0,2 μM), H3BO3 (1,4 μM) és KH2PO4 (0,6 mM). Az oldatot a műanyag doboz alján elhelyezett szivattyúval levegőztetjük, és 10 naponta cseréljük. A pH-t 5,4 ± 0,2 értéken állítottuk be és tartottuk.
Friss gyökérmetszés
A növekvő gyökércsúcsok vagy oldalgyökerek (2 cm) csúcsait éles pengével vágtuk le és egymással párhuzamosan helyeztük el, hogy a gyökércsúcsokat egymáshoz igazítsuk (1A,B kiegészítő ábra). Ezeket egy csepp 3%-os olvasztott agarózba ágyaztuk be (50°C; 1C. kiegészítő ábra). A gyökércsúcsokat tartalmazó foltokat 3%-os olvasztott agarózzal töltött 3 × 1 × 1 cm-es mélyedésbe helyeztük (1D. kiegészítő ábra). Megszilárdulás után a blokkokat átméreteztük, és egy vibratom lemezre ragasztottuk a szeleteléshez. A vibratom (Hm650v (Thermo Scientific Microm)) paraméterei a következők voltak: 30-as sebesség, 70-es frekvencia, 0,8-as amplitúdó és 60 μm vastagság (1E. kiegészítő ábra). A metszeteket vagy kamrás tárgylemezekre (Lab-teak 177402) helyeztük át az immunfestéshez (1F. kiegészítő ábra), vagy 1X alkalikus foszfát pufferrel (PBS, Sigma-Aldrich P3813) nedvesített tárgylemezekre a megfigyeléshez.
Immunolokalizáció
A kamrás tárgylemezekre helyezett metszeteket (kamránként hármat) először 0,1 M glicinnel és 1X PBS-szel kiegészítve, majd kétszer 1X PBS-ben öblítettük, egyenként 10 percig. Ezután a szöveteket 5% szarvasmarha magzati szérumot tartalmazó PBS-oldatba (blokkoló oldat, Thermo Fisher 37520) mártottuk 4°C-on egy éjszakán át kevergetés mellett. Az ebben a blokkoló oldatban 1/10 arányban hígított primer antitesteket egy éjszakán át 4°C-on, kevergetés mellett alkalmaztuk. Ezután a metszeteket háromszor öblítettük 1X PBS-ben 10 percig. A gyökérmetszeteket 2 órán át inkubáltuk a blokkoló oldatban 500-szorosan hígított másodlagos ellenanyaggal, kevergetés mellett. Ezeket az antitesteket fluorofórral, Alexa 546 anti-patkány antitesttel (Invitrogen A11081) vagy Alexa 546 anti-egér antitesttel (Invitrogen A11060) kapcsoltuk. Ezután a metszeteket ismét háromszor öblítettük 1X PBS-ben, kevergetés mellett, egyenként 10 percig. A kamrákat eltávolítottuk, és néhány csepp mowiol montírozó médiumot (Sigma-Aldrich 81381) adtunk hozzá. Fedőlapot helyeztünk a gyökérmetszetekre, amelyeket 36 órán át hagytunk száradni 4°C-on, sötétben.
Paraplast fixálás
A Petri-csészéken 6 napig nevelt gyökereket 4%-os paraformaldehidben (PBS 1X-ben) fixáltuk egy éjszakán át 4°C-on, majd kétszer öblítettük le PBS 1X-ben (Jackson, 1991). A rögzített szöveteket etanolban dehidratáltuk, Histochoice Clearing Agentben (HistoClear, Sigma Aldrich) tisztítottuk, és Paraplastba (Fisher) ágyaztuk be. A szöveteket Leica RM2255 mikrotómmal metszettük (6 μm vastagságban) és SuperfrostPlus tárgylemezekre (Fisher) rögzítettük.
Mikroszkópia
A fénymező és autofluoreszcencia megfigyeléseket Leica DM4500 mikroszkóppal végeztük. Az autofluoreszcencia esetében a képeket az “A” szűrőkockával készítettük (gerjesztési tartomány: UV; gerjesztő szűrő: BP 340-380; szuppressziós szűrő: LP 425). Az immunfestett metszeteket konfokális mikroszkópokkal figyeltük meg: Zeiss LSM 510 vagy Leica SP8. A sejtfalakat először autofluoreszcenciával tettük láthatóvá. A másodlagos antitestet 543, illetve 561 nm-es hélium/neon lézerrel vizualizáltuk. A képeket színes Retiga 2000R kamerával (QIMAGING, Kanada) készítettük, amelyen a Volocity képgyűjtő szoftver (Improvision, Egyesült Királyság) futott.
Author Contributions
SH, FD, MB, CB: adatgyűjtés; SH, CP, AD adatelemzés; SH, EG, CP, AD: a kézirat szerkesztése.
Interdekütközésre vonatkozó nyilatkozat
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
Köszönet
Köszönjük az MRI (Montpellier RIO Imaging plateform), PHIV és La Gaillarde Plateforms technikai támogatását az immunolokalizációs és/vagy konfokális és multifoton képalkotáshoz. SH-t a CIRAD PhD-ösztöndíjjal támogatja.
Kiegészítő anyag
A cikkhez tartozó kiegészítő anyag online elérhető a következő címen: https://www.frontiersin.org/article/10.3389/fpls.2015.01139
Abbreviations
ae, aerenchyma; c, cortex; ed, endodermis; ep, epidermis; ex, exodermis; gt, ground tissue; ic, inner cortex; L-LLR, nagy típusú nagy oldalgyökér; oc, külső kéreg; sc, szklerenchima; SLR, kis oldalgyökér; st, sztélé; T-LLR, vékony típusú nagy oldalgyökér; x, xiléma.
Baluška, F, Brailsford, R. W., Hauskrecht, M., Jackson, M. B. és Barlow, P. W. (1993). Sejtdimorfizmus a kukorica gyökérkéregben: a mikrotubulusok, az etilén és a gibberellin részvétele a sejtek viselkedésének differenciálódásában a posztmitotikus növekedési zónákban. Bot. Acta 106, 394-403. doi: 10.1111/j.1438-8677.1993.tb00766.x
CrossRef Full Text | Google Scholar
Baum, S. F., Dubrovsky, J. G., and Rost, T. L. (2002). A kéreg és az érőhenger apikális szerveződése és érése az Arabidopsis thaliana (Brassicaceae) gyökereiben. Am. J. Bot. 89, 908-920. doi: 10.3732/ajb.89.6.908
PubMed Abstract | CrossRef Full Text | Google Scholar
Brundett, M. C., Enstone, D. E., and Peterson, C. A. (1988). Berberin-anilin kék fluoreszcens festési eljárás szuberin, lignin és kallóz kimutatására növényi szövetekben. Protoplasma 146, 133-142. doi: 10.1007/BF01405922
CrossRef Full Text | Google Scholar
Coudert, Y., Périn, C., Courtois, B., Khong, N. G., and Gantet, P. (2010). A gyökérfejlődés genetikai szabályozása a rizsben, a modellgabonában. Trends Plant Sci. 15, 219-226. doi: 10.1016/j.tplants.2010.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., and Benfey, P. N. (2009). A SCARECROW, a GA és a LIKE HETEROCHROMATIN PROTEIN 1 közötti kölcsönhatás az Arabidopsis gyökér talajszöveti mintázódásában. Plant J. 58, 1016-1027. doi: 10.1111/j.1365-313X.2009.03839.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Laurenzio, L., Wysocka-Diller, J., Malamy, J. E., Pysh, L., Helariutta, Y., Freshour, G., et al. (1996). A SCARECROW gén szabályozza az Arabidopsis gyökér radiális szerveződésének kialakulásához nélkülözhetetlen aszimmetrikus sejtosztódást. Cell 86, 423-433. doi: 10.1016/S0092-8674(00)80115-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Gregory, P. J. (2006). Növényi gyökerek: Growth, Activity, and Interaction with Soils. Oxford; Ames, IA: Blackwell Pub.
Google Scholar
Heidstra, R., Welch, D., and Scheres, B. (2004). Mozaikos elemzések markáns aktivációs és deléciós klónok segítségével boncolgatják az Arabidopsis SCARECROW hatását az aszimmetrikus sejtosztódásban. Genes Dev. 18, 1964-1969. doi: 10.1101/gad.305504
PubMed Abstract | CrossRef Full Text | Google Scholar
Helariutta, Y., Fukaki, H., Wysocka-Diller, J., Nakajima, K., Jung, J., Sena, G., et al. (2000). A SHORT-ROOT gén az Arabidopsis gyökér radiális mintázódását szabályozza radiális jelátvitelen keresztül. Cell 101, 555-567. doi: 10.1016/S0092-8674(00)80865-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, C. F., Yamaji, N., Ono, K., and Ma, J. F. (2012). Egy leucinban gazdag ismétlődő receptorszerű kináz gén részt vesz a rizs gyökereinek külső sejtrétegeinek specifikációjában. Plant J. 69, 565-576. doi: 10.1111/j.1365-313X.2011.04824.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, D. (1991). “In-situ hibridizáció növényekben” in Molecular Plant Pathology: A Practical Approach, eds D. J. Bowles, M. McPherson, and S. J. Gurr (Totowa, NJ: Humana Press), 163-174.
Google Scholar
Justin, S. H. F. W., and Armstrong, W. (1991). Bizonyíték az etilén részvételére a rizs (Oryza sativa L.) adventív gyökereinek aerenchimaképződésében. New Phytol. 118, 49-62. doi: 10.1111/j.1469-8137.1991.tb00564.x
CrossRef Full Text | Google Scholar
Kamiya, N., Nagasaki, H., Morikami, A., Sato, Y., and Matsuoka, M. (2003). Egy rizs WUSCHEL-típusú homeobox gén izolálása és jellemzése, amely specifikusan expresszálódik a gyökér apikális merisztémában lévő nyugalmi központ központi sejtjeiben. Plant J. 35, 429-441. doi: 10.1046/j.1365-313X.2003.01816.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kawai, M., Samarajeewa, P. K., Barrero, R. A., Nishiguchi, M., and Uchimiya, H. (1998). A rizsgyökerek aerenchimaképződése során bekövetkező kérgi sejthalál degradációs mintázatának sejtszintű boncolása. Planta 204, 277-287. doi: 10.1007/s004250050257
CrossRef Full Text | Google Scholar
Kawata, S., Sasaki, O., and Yamazaki, K. (1977). A koronagyökér és az oldalgyökér szerkezetéről, valamint a köztük lévő érkapcsolatról rizsnövényekben. Jpn. J. Crop. Sci. 46, 569-579. doi: 10.1626/jcs.46.569
CrossRef Full Text | Google Scholar
Kawata, S., and Shibayama, B. (1965). Az oldalgyökér-primordiumok kialakulásáról a rizsnövény koronagyökerében. Proc. Crop Sci. Soc. Jpn. 33, 423-431. doi: 10.1626/jcs.33.423
CrossRef Full Text | Google Scholar
Kono, Y., Igeta, M., and Yamada, N. (1972). Vizsgálatok az oldalgyökerek fejlődési fiziológiájáról a rizs szemináriumgyökerekben. Jpn. J. Crop. Sci. 41, 192-204. doi: 10.1626/jcs.41.192
CrossRef Full Text
Lartaud, M., Perin, C., Courtois, B., Thomas, E., Henry, S., Bettembourg, M., et al. (2014). PHIV-RootCell: felügyelt képelemző eszköz a rizs gyökér anatómiai paramétereinek mennyiségi meghatározására. Front. Plant Sci. 5:790. doi: 10.3389/fpls.2014.00790
PubMed Abstract | CrossRef Full Text | Google Scholar
Lux, A., Luxova, M., Abe, J., and Morita, S. (2004). Gyökérkéreg: szerkezeti és funkcionális variabilitás és a környezeti stresszre adott válaszok. Root Res. 13, 117-131. doi: 10.3117/rootres.13.117
CrossRef Full Text | Google Scholar
Paquette, A. J., and Benfey, P. N. (2005). A gyökér alapszövetének érését a gibberellin és a SCARECROW szabályozza és SHORT-ROOT-ot igényel. Plant Physiol. 138, 636-640. doi: 10.1104/pp.104.058362
PubMed Abstract | CrossRef Full Text | Google Scholar
Pauluzzi, G., Divol, F., Puig, J., Guiderdoni, E., Dievart, A., and Périn, C. (2012). Szörfözés a gyökér talajszöveti génhálózatán. Dev. Biol. 365, 14-22. doi: 10.1016/j.ydbio.2012.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rebouillat, J., Dievart, A., Verdeil, J., Escoute, J., Giese, G., Breitler, J., et al. (2009). A rizs gyökérfejlődésének molekuláris genetikája. Rice 2, 15-34. doi: 10.1007/s12284-008-9016-5
CrossRef Full Text | Google Scholar
Sabatini, S., Heidstra, R., Wildwater, M., and Scheres, B. (2003). A SCARECROW részt vesz az őssejt niche pozícionálásában az Arabidopsis gyökérmerisztémában. Genes Dev. 17, 354-358. doi: 10.1101/gad.252503
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, C. A., Rasband, W. S., and Eliceiri, K. W. (2012). NIH Image to ImageJ: 25 év képelemzés. Nat. Methods 9, 671-675. doi: 10.1038/nmeth.2089
PubMed Abstract | CrossRef Full Text | Google Scholar
Sugimoto, K., Jiao, Y., and Meyerowitz, E. M. (2010). Az Arabidopsis regenerációja több szövetből egy gyökérfejlődési útvonalon keresztül történik. Dev. Cell 18, 463-471. doi: 10.1016/j.devcel.2010.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Ten Hove, C. A., Willemsen, V., de Vries, W. J., Van Dijken, A., Scheres, B., and Heidstra, R. (2010). A SCHIZORIZA az Arabidopsis gyökérben az őssejtosztódások aszimmetriáját szabályozó nukleáris faktort kódolja. Curr. Biol. 20, 452-457. doi: 10.1016/j.cub.2010.01.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., and Gallagher, K. L. (2014). A nem sejt-autonóm transzkripciós faktor, a SHORT-ROOT mozgása az endomembrán rendszerre támaszkodik. Plant J. 80, 396-409. doi: 10.1111/tpj.12640
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Zhang, X., Li, J., Bao, M., Ni, D., and Seago, J. L. (2014). A vadrizs (Zizania latifolia Griseb.) gyökereinek és hajtásainak anatómiája és hisztokémiája. J. Bot. 2014, 9. doi: 10.1155/2014/181727
CrossRef Full Text | Google Scholar