Hidrogénkötés definíció
A hidrogénkötés egy részben pozitív töltésű hidrogén és egy részben negatív töltésű atom (oxigén és nitrogén) közötti vonzóerő. Ez egy nagyon gyenge kötés, és a hidrogénkötés erőssége (kötésenként 5-10 Kcal) sokkal kisebb, mint a kovalens kötés erőssége. A hidrogénkötéseket általában szaggatott vonalként ábrázolják két atom között. Például a két vízmolekula közötti hidrogénkötés az alábbiakban látható:
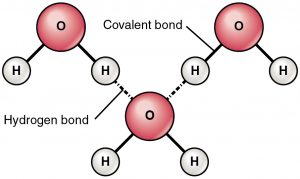
A hidrogénkötés oka
A nagyon elektronegatív atom, például az oxigén vagy a nitrogén jelenléte miatt az oxigén és a hidrogén közötti közös elektronpár az elektronegatívabb atom felé húzódik. Ez az elektronpár egyenlőtlen eloszlása két részleges dipólus kialakulásához vezet. A részben pozitív töltésű hidrogént ezután a másik részben negatív töltésű oxigén vagy nitrogén vonzza, ez az úgynevezett hidrogénkötés.
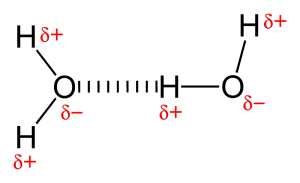
A hidrogénkötés típusai
A hidrogénkötés létrejöhet ugyanazon molekula két atomja között vagy különböző molekula két atomja között. Ettől függően a hidrogénkötésnek két típusa van:
- Intermolekuláris hidrogénkötés
- Intramolekuláris hidrogénkötés
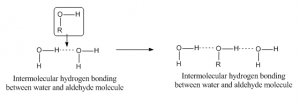
Intermolekuláris hidrogénkötés
Ha a hidrogénkötés különböző molekula két atomja között jön létre, akkor intermolekuláris hidrogénkötésnek nevezzük. Az ilyen kötéshez az egyik molekulának részben pozitív hidrogénnel, mint akceptoratommal, a másiknak pedig részben negatív vagy donoratommal kell rendelkeznie. Például az aldehid és a vízmolekula közötti hidrogénkötés az alábbiakban látható:
2. Intramolekuláris hidrogénkötés
Ha a hidrogénkötés ugyanazon molekula két részben töltött atomja között jön létre, azt intramolekuláris hidrogénkötésnek nevezzük. Ez akkor következik be, amikor két funkciós csoport van jelen ugyanabban a molekulában, és olyan helyzetben vannak, hogy egymást vonzva hidrogénkötést tudnak kialakítani. Például a szalicilsavnak két funkciós csoportja van, az alkohol és a karbonsav. Itt intramolekuláris hidrogénkötés jön létre az alkoholcsoport hidrogénatomja és a karbonsavcsoport oxigénatomja között.
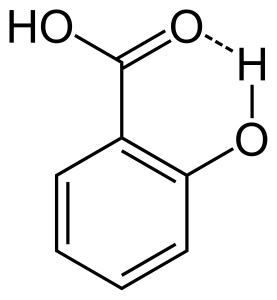
A hidrogénkötés hatása
A forráspontra
Az azonos vagy hasonló molekulatömegű anyagok forráspontja várhatóan azonos vagy hasonló forrásponttal rendelkezik. A hasonló molekulatömegű éter és alkán forráspontja nincs messze egymástól. Az alkoholok forráspontja azonban sokkal magasabb, mint a hasonló molekulatömegű éteré. Ez a hidrogénkötésekkel magyarázható. Az alkoholban a hidrogénkötések miatt a forráspont megemelkedik. A hidrogénkötés felbontásához a forrás előtt extra energiára van szükség. Mivel nincsenek hidrogénkötések, az alkánnak és az éternek alacsony a forráspontja.

Az oldhatóságról
Az alkoholok vízben oldódnak, az alkánok viszont nem. Ennek oka, hogy az intermolekuláris hidrogénkötésű vegyületek intermolekuláris hidrogénkötésű oldószerben oldódhatnak. Egy poláros molekula, mint az alkohol, két vízmolekulába belépve hidrogénkötést tud kialakítani, míg egy nem poláros anyag, mint az alkánok, nem. Az alkoholok szénláncának növekedésével azonban csökken az oldhatóság, mivel a hosszú lánc útjában áll a hidrogénkötés kialakulásának.
Összefoglaló
- A hidrogénkötés egy részben pozitív töltésű hidrogén és egy részben negatív töltésű atom közötti vonzóerő.
- Ha a hidrogénkötés különböző molekulák atomjai között jön létre, akkor azt intermolekuláris hidrogénkötésnek nevezzük.
- Ha a hidrogénkötés ugyanazon molekula két részben töltött atomja között jön létre, azt intramolekuláris hidrogénkötésnek nevezzük.
- Az intermolekuláris hidrogénkötés miatt a poláros vegyületek forráspontja magasabb, mint az azonos a poláros vegyületeké.
- A szerves vegyület és a víz közötti hidrogénkötés miatt az oldódás bizonyos mértékig lehetséges.
Meghatározott mértékben oldódik.