Mi a kobalt
A kobalt (kiejtése: KO-bolt) az átmeneti fémek csoportjába tartozó kemény, csillogó ezüstös-kékes színű elem, melyet a Co kémiai szimbólummal jelölünk. Kémiailag aktív, és számos vegyületet alkothat . Ferromágneses fém, amely mágnesezhető, és nikkel és alumíniummal ötvözve erős mágneseket állítanak elő belőle .

Kobalt Jelkép
Izotópok
Egy stabil, természetesen előforduló izotópja, az 59Co és 28 radioizotópja van, amelyek közül a legstabilabbak a 60Co, 57Co, 56Co és 58Co, felezési ideje 5,2714 év, 271,8 nap, 77,27 nap és 70,86 nap . A többi radioizotóp felezési ideje kevesebb, mint 18 óra .
Hol található a kobalt
A kobalt a természetben más elemekkel együtt fordul elő olyan ásványi ércekben, mint a kobaltit (kobaltot, arzént, vasat és nikkelt tartalmazó szulfid), eritrit (hidratált kobaltarzenát) és skutterudit (kobaltarzenát) . Általában a réz- és nikkelbányászat melléktermékeként nyerik .
Az óceánfenéken található mangángumók az átmeneti fémek hatalmas tartalékai, amelyek több tonna kobaltot tartalmaznak . A 3 legnagyobb kobaltkészlettel rendelkező ország a Kongói Demokratikus Köztársaság (KDK), Ausztrália és Kuba, míg a 3 legnagyobb termelő a KDK, Kína és Zambia .

Kobalt
Története
Nevének eredete:
Ki fedezte fel? Az elemet Georg Brandt svéd kémikus és mineralógus találta meg .
Mikor és hogyan fedezték fel
Tutankhamon, az i.e. 1361-1352 között uralkodó ókori egyiptomi fáraó sírjában volt egy mélykék üvegtárgy, amely kobaltból készült . Kínában a kobaltkéket kerámiamázak készítésére használták .
Az ősi eredetétől eltekintve a közelmúltban történt felfedezése az 1730-as évekre nyúlik vissza, amikor Georg Brandt érdeklődött egy kék érc iránt néhány helyi bányából . Végül sikerült bebizonyítania, hogy a kék érc egy új fémet tartalmaz . Leírta a tulajdonságait, és az eredményeket 1739-ben publikálta .
Felfedezése ellentmondásos volt, mivel más kémikusok hosszú évekig vitatták eredményeit . Svéd vegyésztársa, Torbern Bergman azonban további vizsgálatokat végzett, és 1780-ban megerősítette Georg Brandt felfedezését .
Kobalt azonosítása |
|||
| Atomiaszám | 27 | ||
| CAS szám | 7440-48-4 | ||
| Pozíció a periódusos rendszerben | Group | Period | Block |
| 9 | 4 | d | |
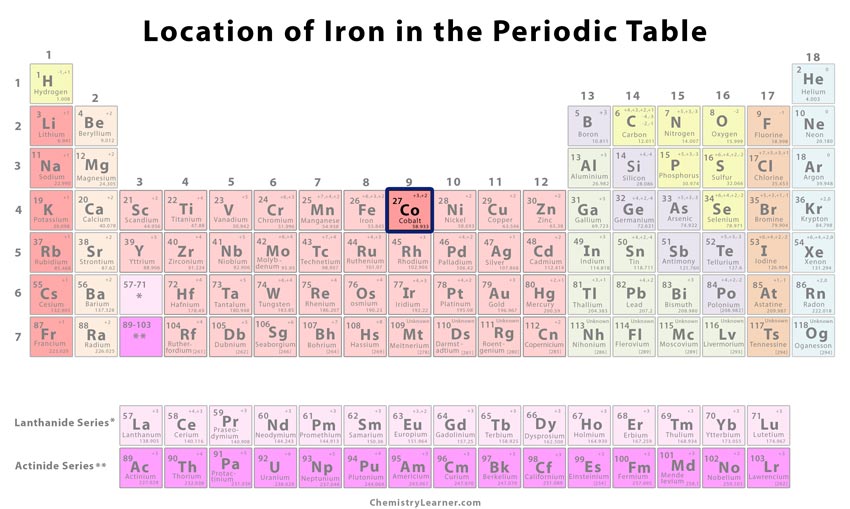
Hol… helyezkedik el a kobalt a periódusos rendszerben
A kobalt tulajdonságai és jellemzői
Általános tulajdonságok |
||||||||||||||||
| Relatív atomtömeg | 58.933 | |||||||||||||||
| Atomi tömeg | 58.933 amu | |||||||||||||||
| Moláris tömeg | 58.9331950 ± 0.0000050 g/mol | |||||||||||||||
| Molekulatömeg | 58.933 g/mol | |||||||||||||||
Fizikai tulajdonságok |
||||||||||||||||
| Szín | ezüstkék, kékesfehér | |||||||||||||||
| olvadáspont/fagyáspont | 1495 °C, 2723 °F | |||||||||||||||
| Fűtőpont | 2927 °C, 5301 °F | |||||||||||||||
| Sűrűség | 8.86 g cm-3 | |||||||||||||||
| Anyagállapot szobahőmérsékleten (szilárd/folyékony/gáz) | Szilárd | |||||||||||||||
| Keménység | ||||||||||||||||
| 700 MPa | ||||||||||||||||
| – Mohs | 5 | |||||||||||||||
| – Vickers | 1043 MPa | |||||||||||||||
| Elektromos vezetőképesség | 1.7 X 107 S/m | |||||||||||||||
| Ionikus töltés | 3+ | |||||||||||||||
| Thermikus (hő)vezetőképesség | 100 W/(m K) | |||||||||||||||
| Specifikus hő | 421 J kg-1 K-1 | |||||||||||||||
| Ömlesztő modulus | Nem ismert | |||||||||||||||
| Száró modulus | Nem ismert | |||||||||||||||
| Young-modulus | Ismeretlen | |||||||||||||||
| Gőznyomás | ||||||||||||||||
| – Hőmérséklet. (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||
| – Nyomás (Pa) | – | – | – | 2.09 X 10-10 | 1.00 X 10-6 | 4.19 X 10-4 | 0.0379 | 1.15 | 16 | – | – | |||||
Kémiai tulajdonságok |
||||||||||||||||
| 3, 2, 0, -1 | ||||||||||||||||
| Izotópok | Izotóp | Tömeg | Bőség (%) | Féléletidő | Bomlási mód | |||||||||||
| 59Co | 58.933 | 100 | – | – | ||||||||||||
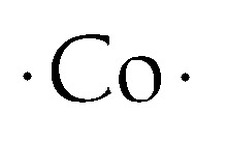
Kobalt Lewis pontszerkezete
A kobalt (27. elem)
| Valenciaelektronok | 9 | |||||||||||||||
| Kvantumszámok | ||||||||||||||||
| – n | 3 | |||||||||||||||
| – ℓ | 2 | |||||||||||||||
| – mℓ | – | -1 | ||||||||||||||
| – ms | -1/2 | |||||||||||||||
| Elektronkonfiguráció (nemesgázkonfiguráció) | 3d74s2 | |||||||||||||||
| Atomszerkezet | ||||||||||||||||
| – Elektronok száma | 27 | |||||||||||||||
| – A neutronok száma | 32 | |||||||||||||||
| – A protonok száma | 27 | |||||||||||||||
| Az atom sugara | ||||||||||||||||
| – Atomsugár | 2.00 Å | |||||||||||||||
| – Kovalens sugár | 1,18 Å | |||||||||||||||
| Elektronegativitás (Pauling-skála) | 1,88 | |||||||||||||||
| Elektronaffinitás | 63.873 kJ mol-1 | |||||||||||||||
| Ionizációs energia (kJ mol-1) | 1. | 2. | 3. | 4. | 5. | 6. | 7. | 8. | ||||||||
| 760.402 | 1648.356 | 3232.3 | 4949.7 | 7670.6 | 9842 | 12437 | 15225.4 | |||||||||
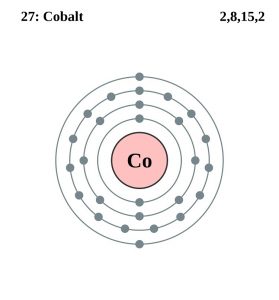
Kobalt elektron konfiguráció (Bohr modell)
Mire használják a kobaltot
- A kobaltot magas hőmérsékleti szilárdsága és korrózióállósága miatt a gázturbina generátorokban és sugárhajtású turbinákban használják .
- A kobaltot keménysége és vonzó megjelenése miatt alkalmanként galvanizáláshoz használják .
- Általában katódanyagként használják a lítiumion akkumulátorokban .
- A kobaltsókkal intenzív kék színt kölcsönöznek üvegnek, porcelánnak, kerámiának, zománcnak és festéknek .
- A radioaktív 60Co-t a rák kezelésére és az élelmiszerek besugárzására használják a kórokozók ellenőrzésére és az eltarthatósági idő meghosszabbítására .
- A krómból, kobaltból és volfrámból álló sztellit szuperötvözeteket magas hőmérsékletű és nagy kopásállóságú vágószerszámok készítésére használják .
Kobalt mérgezés és egészségügyi hatásai
A kobalt mérgezés akkor következhet be, ha véletlenül lenyeljük, belélegzzük, vagy nagy mennyiségben érintkezik a bőrrel . Nagy mennyiségben a kobalt rákkeltő lehet az emberekben és egyes állatokban .
Nyomokban megtalálható az emberben, és a B12-vitamin nélkülözhetetlen összetevője . Néhány állatnak kis dózisú kobaltot is adnak, hogy megelőzzék az ásványi anyaghiányt náluk .

Kobalt ásvány (kobaltit)
Érdekes tények
- A kobaltot grafikusan egy “kobold” vagy kobold (akit a középkori német bányászok kellemetlennek tartottak) ábrázolja, a háttérben kínai porcelánnal, utalva arra, hogy az ókori Kínában kerámiamázként használták .
- A kobalt egészen 1121 °C-os hőmérsékletig (Curie-pont) képes megtartani mágneses tulajdonságait (2049.8 °F), ami az összes ferromágneses elem közül a legmagasabb .
- 2010-ben német tudósok egy kobaltatomot használtak arra, hogy megörökítsék az első képeket a spinváltozásokról .
A kobalt ára
A tiszta kobalt ára körülbelül 0,21 dollár grammonként, ömlesztve pedig körülbelül 0 dollárba kerül.044 Ft/gramm .
- http://www.rsc.org/periodic-table/element/27/cobalt
- https://education.jlab.org/itselemental/ele027.html
- https://www.livescience.com/29275-cobalt.html
- https://www.chemicool.com/elements/cobalt.html
- https://education.jlab.org/itselemental/iso027.html
- https://www.webqc.org/molecular-weight-of-Co%28cobalt%29.html
- https://pubchem.ncbi.nlm.nih.gov/compound/cobalt#section=Top
- http://periodictable.com/Elements/027/data.html
- http://www.gpb.org/files/pdfs/gpbclassroom/chemistry/ionicChargesChart.pdf
- http://dwb4.unl.edu/Chem/CHEM869B/CHEM869BLinks/learn.chem.vt.edu/tutorials/bonding/valence.html
- http://chemistry-reference.com/q_elements.asp?Symbol=Co&language=en
- https://medlineplus.gov/ency/article/002495.htm