Az atomban lévő minden elektron egyértelműen azonosítható négy kvantumszámmal.

Bár felfedezésükhöz fejlett matematikára volt szükség, ezek mind hagyományos számok:három közülük csak egyszerű egész számokat vehet fel; a negyedik egyszerű tört.
Az első három kvantumszám a Schrödinger-egyenlet megoldásával kapott Ψ hullámfüggvényből ered.
A negyedik kvantumszám, az elektron spinje, abból a felfedezésből ered, hogy az elektronoknak két lehetséges orientációja van.
A számok és definícióik a következők:
A kvantumszámok
| kvantumszám | név | lehetséges értékek | információ |
|---|---|---|---|
| n | fő kvantumszám | 1, 2, 3,…, n | meghatározza az elektron által elfoglalt energiahéjat. Az atommaghoz legközelebbi héjak rendelkeznek a legalacsonyabb n értékkel és a legalacsonyabb potenciális energiával.n az első szám, amit az elektronkonfigurációkban írnak, mint például a magnéziuméban: 1s2 2s2 2p6 3s2 |
| l | orbitális nyomaték kvantumszám (más néven azimutális kvantumszám) |
0, 1, 2,…, (n-1) | meghatározza az energia részhéjat – az egynél több elektronnal rendelkező rendszerekben a részhéjak különböző energiájúak. l határozza meg a részhéj betűjelét az elektronkonfigurációkban. Például: 1s2 2s2 2p6 3s2 l = 0 egy s alhéjat ad. l = 1 egy p alhéjat ad. l = 2 egy d alhéjat ad, stb. |
| ml | mágneses kvantumszám | -l, (l+1), …, 0,…. , (l+1), l | meghatározza az alhéj orbitál orientációját. A p alhéj, l = 1, három ml értékkel rendelkezik: -Ezek azt jelzik, hogy három p orbitál létezik, azaz a px, py és pz orbitálok. A d alhéj, l = 2, öt ml értékkel rendelkezik: -Ezek azt jelzik, hogy öt d-orbitális létezik. |
| ms | elektron spin kvantumszáma | -½ vagy +½ | Az elektronoknak kétféle spinorientációja lehetséges. |
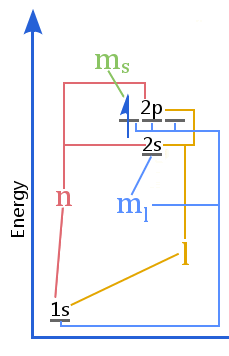
Az energiaszint diagram a kvantumszámok és az atomban lévő héjak, alhéjak, orbitálok és elektron spin közötti kapcsolatot mutatja.
Az atomban egyetlen elektron sem rendelkezik mind a négy kvantumszámmal.Minden elektron egyértelműen azonosítható a kvantumszámával – lásd Pauli kizárási elve.
A pályák alakját nem a kvantumszámok adják meg, hanem valószínűségi sűrűségek – az atommag körüli tér háromdimenziós térképei, ahol az elektron az esetek 99 százalékában megtalálható.Az orbitálisok alakját a hullámfüggvény négyzetéből, Ψ2-ből kapjuk.Egy elektron pontos helyét és impulzusát soha nem ismerhetjük meg – lásd Heisenberg bizonytalansági elve.
