Az Exeleadnál a szerződéses gyártást a liposzómás és PEGilált készítményekre összpontosított szakértelemmel közelítjük meg a ritka betegségek és a kis vagy alulellátott populációk kezelésére. A lipidalapú, parenterális gyógyszerkészítmények fejlesztésére és gyártására szakosodtunk, és csapatunk több mint 20 éves tapasztalattal rendelkezik a preklinikai, klinikai és kereskedelmi szerződéses gyártási ügyfelek széles körével való együttműködésben.
Mi a liposzóma, és hogyan használják a gyógyszeradagolásban?
A liposzómák speciális szállítóeszközök, amelyek többféle szerepet töltenek be a gyógyszerhatóanyagok (API-k) képességeinek fokozásában. Először is, képesek megóvni a hatóanyagot a szervezet immunrendszerének felismerésétől, biológiai membránokat utánozva, és több időt adva a hatóanyagnak, hogy elérje a rendeltetési helyét. Másodszor, elősegítik az erősen lipofil gyógyszermolekulák szolubilizálását, vagy módosítják az API farmakokinetikáját és biodisztribúcióját – ezáltal segítik a mellékhatások minimalizálását és javítják a termék biztonsági profilját.
A liposzómák egyedi hólyagszerkezettel rendelkeznek. Ezek a vezikulák egy lipid kettősrétegből állnak, amely egy vizes fázist körülvevő üreges gömb alakban alakul ki. Mint ilyen, bármilyen érdekes rakományt be lehet zárni a liposzómákba akár a vizes kompartmentben (ha az vízben oldódó/hidrofil), akár a lipid kettősrétegen belül (ha az zsírban oldódó/lipofil).
A liposzómák előállításához használt elsődleges lipidek közül néhány foszfolipid és szfingolipid. A lipidek e két kategóriája egyedülálló a vízkedvelő/hidrofil fejcsoport és a vízgyűlölő/lipofil farokcsoport tekintetében. Amfifil természetüknek köszönhetően ezek a molekulák spontán önszerveződéssel liposzómákat és más egyedi 3D-s struktúrákat alkotnak, amikor vizes oldatokhoz adják őket. A 3D struktúrák alakja vagy morfológiája számos különböző tényezőtől függ – például a lipidek összetételétől, a hőmérséklettől, a pH-tól vagy más pufferek, sók és cukrok jelenlététől a vízben.

Kép forrása: Chem Libre Texts
Hogyan lép kölcsönhatásba egy gyógyszer a testtel és válik felhasználhatóvá, ha liposzómás gyógyszerkészítményként van megfogalmazva?
A liposzómák az elmúlt években jelentős figyelmet kaptak, mint a gyógyszerhordozók megbízható osztálya. Önmagukba zárt szerkezetük egyszerre több hatóanyagot képes kapszulázni, megvédve a zárt rakományt a hidrolízistől és a lebomlástól. Emellett a lipid kettősréteg külső héján célzott fehérjék és felületi funkcionális ligandumok új funkciókat adhatnak hozzá – lehetővé téve a liposzómák célzott bejutását a sejtekbe, akár antitestek vagy receptor-célzott ligandumok révén. Ezek a ligandumok olyan sejtreceptorokhoz kapcsolódnak, amelyek bizonyos beteg sejtekben túlkifejeződnek, lehetővé téve a hatóanyag bejutását a sejtmembránon keresztül.
“A liposzómák védik a betöltött gyógyszermolekulákat a külső lebomlástól, és a biológiai membránokhoz való hasonlóságuk egyedülálló lehetőséget biztosít a gyógyszermolekulák sejtekbe vagy szubcelluláris kompartmentekbe juttatására …. Ezenkívül a liposzómák különböző fizikai-kémiai tulajdonságai – beleértve a méretüket, töltésüket és a felületi funkcionális ligandumokat – megváltoztathatók, ami olyan funkcionalitásokat eredményez, amelyek előnyben részesítik a specifikus hatóanyag-szállítási feladatokat. Ezek az előnyök a liposzómákat a klinikumban széleskörűen alkalmazható, vezető hatóanyag-leadó platformmá tették.”
– Liposzóma-szerű nanostruktúrák hatóanyag-leadásra | Gao W, Hu C-MJ, Fang RH, Zhang L 1
A liposzómákat általában steril injekciós készítményként állítják elő a véráramba juttatás céljából, és a hatóanyag felszabadulása a lipidburkok lebomlásakor történik – ami extracelluláris vagy intracelluláris környezetben történhet.
Változatos stratégiákat alkalmaztak a hagyományos liposzómák triggerelt felszabadítási képességgel történő kialakítására, ami fokozza a terápiás hatékonyságot azáltal, hogy a liposzómák egy ingerre adott válasz alapján felszabadítják a kapszulázott hatóanyagot vagy “rakományt”. Ezt a felszabadulást vagy a liposzómák hagyományos lebomlása, vagy aktív ingerek és környezeti jelek, például hőenergia, pH-gradiens és nyírófeszültség vezérlik.1
A sejten belüli környezetben történő felszabadításra szánt készítmények tartalmazhatnak pH-érzékeny lipideket, amelyek megváltoztatják a liposzóma szerkezetét vagy lebomlanak a savas kompartmentekben, lehetővé téve a kapszulázott hatóanyag felszabadulását. Alternatívaként néha hőérzékeny vagy fényérzékeny komponenseket is tartalmaznak, hogy lehetővé tegyék a lebomlást és a struktúra módosítását a hőmérsékletváltozás vagy bizonyos hullámhosszúságú fényre adott reakció miatt.
A liposzóma-szerű gyógyszerhordozóknak sokféle változata létezik, amelyek biokémiai és biofizikai tulajdonságok széles skáláját mutatják. Bár ez előnyös, és lehetővé teszi, hogy ezek a lipidalapú részecskék több száz különböző környezetben hasznos alkalmazásokat vállaljanak, a lehetséges variációk száma miatt a gyártás szigorú ellenőrzése elengedhetetlen.2
Az Exelead az 1990-es évek eleje óta gyárt lipidalapú gyógyszereket, kezdve az Abelcettel. Az Abelcet hatóanyagát, az amfotericin B-t egy lipidkomplexben tartják, és szelektíven összeolvad a gombamembránokkal, hogy megcélozza a beteg sejteket.
Liposzómák vs. lipid nanorészecskék
A liposzómák és a lipid nanorészecskék (LNP-k) felépítésükben hasonlóak, de összetételükben és működésükben kissé különböznek. Mindkettő lipid nanoformuláció és kiváló gyógyszerhordozó, amely a kívánt rakományt egy védő, külső lipidrétegen belül szállítja. Az alkalmazásban azonban az LNP-k sokféle formát ölthetnek.
Az LNP-k olyan liposzóma-szerű struktúrák, amelyek kifejezetten a nukleinsavak (RNS és DNS) széles skálájának kapszulázására irányulnak; és mint ilyenek, ezek a legnépszerűbb nem-virális génszállító rendszerek. Az Exelead LNP-ket fejleszt és gyárt különböző típusú genetikai hasznos terhelések, köztük siRNS, mRNS és saRNS kapszulázására.
A hagyományos liposzómák egy vagy több gyűrűs lipid kettősréteget tartalmaznak, amely egy vizes zsebet vesz körül, de nem minden LNP rendelkezik összefüggő kettősréteggel, ami lipidhólyagnak vagy liposzómának minősíti őket. Egyes LNP-k micellaszerű szerkezetet vesznek fel, és nem vizes magban kapszulázzák a gyógyszermolekulákat.
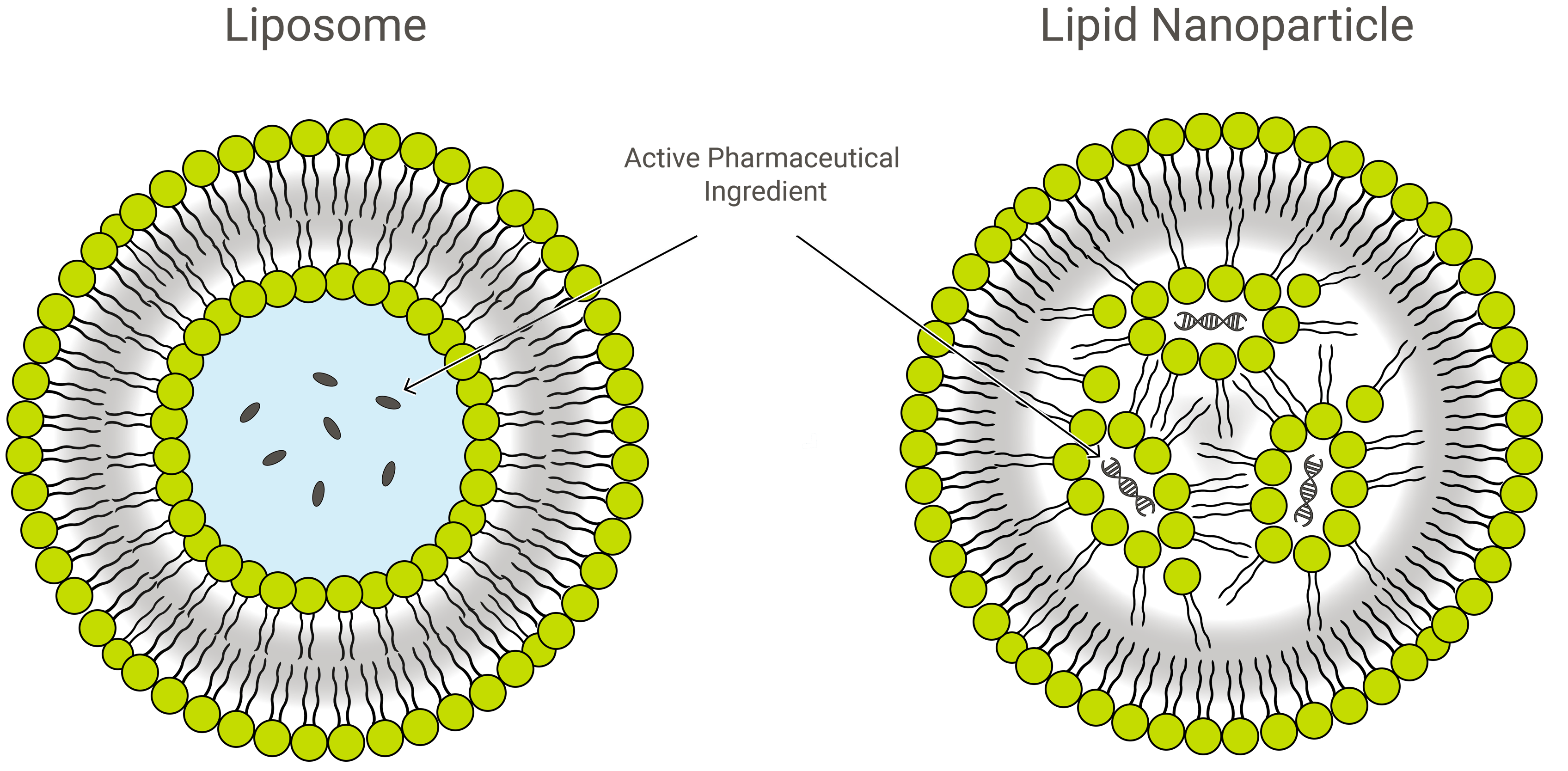
LNP-k és liposzóma-szerű hatóanyag-leadó szerkezetekPEGilálása
A LNP-k elsősorban kationos lipidekből állnak (lásd alább génterápia), más lipid összetevőkkel együtt. Ezek jellemzően a foszfatidil-kolin (PC) osztályba tartozó semleges foszfolipid molekulákat és szterolokat, például koleszterint tartalmaznak. Egy másik gyakori lipid-összetevő az úgynevezett PEGilált foszfolipid – egy polietilénglikol (PEG) polimer, amely kovalensen kapcsolódik egy foszfolipid fejcsoportjához.

APEGilált foszfolipideket számos lipidalapú gyógyszerhordozóban elsősorban azért használják, mert a szervezetben keringő hatóanyagnak úgynevezett lopakodó hatást biztosítanak. Az emberi immunrendszer arra törekszik, hogy megvédje a szervezetet minden idegen tárgytól, és ez alól a gyógyászati nanorészecskék sem kivételek. A szállítás hatékonyságának elősegítése és annak érdekében, hogy a szállítmány molekuláknak több keringési idő álljon rendelkezésre, hogy elérjék a tervezett betegségek helyét, PEG-et adnak hozzá, hogy megvédjék ezeket a nanorészecskéket azáltal, hogy megakadályozzák a vérplazma fehérjéinek felszívódását a liposzóma felületén, növelve ezzel a véráramban keringő élettartamot.1
A PEGilálás második előnye a liposzóma-szerű nanoszerkezetek stabilitásának növelése. A hagyományos liposzómák, különösen a 200 nm-nél kisebb méretűek, önmagukban instabilak lehetnek, és hajlamosak összeolvadni egymással a felületi feszültség csökkentése érdekében. Ez a kapszulázott hatóanyag elvesztéséhez vagy a különböző vezikulák rakományának kedvezőtlen keveredéséhez vezethet. A gyógyszergyártók ezt a problémát többek között úgy tanulták meg leküzdeni, hogy a liposzómák külsejét polimerekkel, például PEG-gel borítják be.
Ezek a lopakodó nanorészecskék a liposzómás készítmények új generációját és több klinikailag jóváhagyott terméket eredményeztek. A PEGilált liposzómák és LNP-k jelenleg a legtöbb rákterápia új paradigmáját jelentik.
LNP-k a génterápiában
Hosszú ideig a génalapú terápiák emberi sejtekbe juttatásának leghatékonyabb módja az volt, hogy olyan vírust használtak, amelyet úgy módosítottak, hogy a káros, önszaporodó gének helyett gyógyászati rakományt hordozzon. Ezt a módszert alkalmanként még ma is alkalmazzák, és vírusos génszállításnak nevezik. A nem vírusos génszállítás azonban az elmúlt 20 évben népszerűvé vált a jobb biztonsági profil, a nemkívánatos immunogén reakciók alacsonyabb aránya és az egyszerű gyárthatóság miatt. Ennek a mozgalomnak az egyik fő mozgatórugója a lipid- és polimeralapú hordozók kifejlesztése volt, amelyek közül az LNP-k a legnépszerűbbek.
A génszállításra használt LNP-ket elsősorban kationos, azaz pozitív töltésű lipidek felhasználásával szintetizálják, amelyek anionos, azaz negatív töltésű nukleinsavakkal társulnak. Más lipid alapú komponensek is hozzáadhatók a szállítás hatékonyságának és a genetikai rakomány felszabadulási helyének modulálása érdekében. Az LNP-k mechanikai stabilitást, ellenőrzött morfológiát és szűk méreteloszlást is biztosítanak.1
Szervetlen anyagokat, szerves anyagokat és hidrogéleket vizsgáltak liposzómás nanorészecskék magjaként, amelyeket különböző számú, a héjat alkotó lipidrétegekbe kapszuláznak. E hibrid nanorészecskék egyik legsikeresebb változata PLA vagy PGLA polimereket tartalmaz egy lipid monorétegen belül. Ez a két alapvető biopolimer különösen hasznos a hatóanyag-leadásban, mivel megkönnyítik a szabályozott hatóanyag-felszabadulást.1

A fenti nanorészecske-formuláció egy lipid-polimer hibrid, hidrofób PGLA maggal és hidrofil lipid-PEG héjjal.
Egy bővülő terület
“A liposzómák hosszú utat tettek meg, hogy a validált gyógyszerhordozók osztályává váljanak … Egyre többféle liposzóma-szerű nanoszerkezet van fejlesztés alatt, amelyek mindegyike egyedi erősséggel rendelkezik, és alkalmas a speciális hatóanyag-leadási feladatokra. Eközben gyorsan fejlődik e nanoszerkezetek és a biológiai rendszerek közötti kölcsönhatások megértése. A keringési idejükről, szöveti felhalmozódásukról és potenciális toxicitásukról már jelentős mennyiségű információ áll rendelkezésre. Biztos, hogy a liposzóma-szerű nanohordozók belátható időn belül nagyobb szerepet fognak játszani a gyógyszerszállításban.”
– Liposzóma-szerű nanostruktúrák a gyógyszerszállításban | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Míg a szabályozott felszabadulású, nanokompartmentált gyógyszerhatóanyagok fejlesztése terén jelentős munka folyik, a liposzómák és az LNP-k különösen ígéretes lehetőségek. Ezek a struktúrák egyedülálló, természetesen stabil, sejt-szerű morfológiát biztosítanak a nanomedicinák számára, és készen állnak a fejlettebb terápiás stratégiák felé való továbblépésre. Az Exelead ilyen kihívásoknak tesz eleget, többek között olyan nanogélek kifejlesztésével, amelyek egy sor biológiai hatóanyagot és kismolekulát tartalmaznak.
Mióta a liposzómákat először javasolták gyógyszerhordozó rendszerként az 1960-as évek végén, a szerkezet és a funkcionalitás változatai jelentek meg, értékes előrelépéseket biztosítva a betegségcélzás szempontjából. Az LNP gyógyszerek az egész gyógyszeriparban megjelentek a rákellenes szerek, antibiotikumok, géngyógyszerek, érzéstelenítők és gyulladásgátló gyógyszerek szállítására tervezett terápiákként3.
“A klinikai alkalmazásokban a liposzómás gyógyszerek bizonyultak a leghasznosabbnak, mivel képesek “passzívan” felhalmozódni a fokozott éráteresztő képességű helyeken, amikor az átlagos átmérőjük az ultraszűrhető tartományban van (<200 nm átmérőjű), és mivel képesek csökkenteni a kapszulázott gyógyszerek mellékhatásait a szabad gyógyszerekhez képest. Ez a terápiás index általános növekedését eredményezte, amely a toxicitással szemben a hatékonyságot méri.”
– Liposzómális gyógyszerhordozó rendszerek: a koncepciótól a klinikai alkalmazásokig | Allen TM, Cullis PR 3
Alkalmazások a személyre szabott orvoslásban – a terápiás stratégiák új korszaka
A betegségek kezelésének hagyományos, nagy gyógyszergyárak által alkalmazott megközelítéseivel szemben a személyre szabott orvoslás figyelembe veszi az életmód, a környezet és a biológia – beleértve a beteg genetikáját is – egyéni különbségeit.
Ez rendkívül jól alkalmazható az olyan betegségek esetében, mint a rák. Még egyetlen ráktípuson belül is a daganattípusok betegenként eltérőek, és a betegnél kialakult konkrét genetikai mutáció megértése lehetővé teszi az orvosok számára, hogy specifikusabb és pontosabb kezeléseket alkalmazzanak.4
A személyre szabott genetikai terápiák megjelenésével az orvosok és a tudósok hatékonyan szabhatnak egy aktív gyógyszerösszetevőt – gyakran RNS-t vagy DNS-t – egy adott beteg vagy a betegek kis csoportjának konkrét betegségprofiljához. A hiper-specifikus betegségcélzásnak ez a megközelítése növeli a hatékonyságot és csökkenti a nem kívánt mellékhatásokat a hasonló betegek csoportjai esetében.
LNP-k mint az oligonukleotidok hordozóeszközei
Miatt a személyre szabott orvoslás növekvő területének nagy része a genetikai terápiákra összpontosít, az LNP-k különösen hasznos gyógyszerhordozó platformként váltak hasznossá. Elméletileg bármilyen oligonukleotidot be lehetne zárni egy liposzómába vagy LNP-be, de az siRNS jelenleg a leggyakoribb rakomány az ilyen típusú gyógyszerkészítményekben.
Az siRNS szegmensek elméletileg úgy tervezhetők, hogy bármely gént elhallgattassanak, ami izgalmas elképzelés mind az orvosok, mind a kutatók számára. Sajnos a szabad, nem kapszulázott RNS-ek emberi sejtekbe juttatása nehézkes, mivel nagy méretűek, szérumban instabilak és hajlamosak a nukleáz lebontásra.5
Míg a kutatók tettek kísérleteket az siRNS-ek szérumban való stabilizálására foszforotioát kötések hozzáadásával, nagy dózisok szükségesek ahhoz, hogy az emberben hatékonyan elnémítsák a géneket. Az LNP-k megoldást jelentettek erre a problémára, mivel rugalmas és egyszerű kapszulázási módot biztosítanak, védik az siRNS szegmenseket, amíg azok el nem érik rendeltetési helyüket, és megkönnyítik a célsejtekbe való bejuttatásukat.5
“Az ionizálható kationos lipideket tartalmazó LNP-k számos olyan tulajdonsággal rendelkeznek, amelyek a polinukleinsavak szisztémás szállításához szükségesek, beleértve a kis méretet, a szérumstabilitást, az alacsony felületi zéta-potenciált fiziológiás pH-n és a kationos töltést savas pH-értékeken (pl. endoszómákban). Továbbá, kihasználva az ApoE-vel való társulás miatti “endogén” célzási folyamatokat a beadást követően, az i.v. beadást követően rendkívül hatékony felvételt lehet elérni a hepatocitákba, ami kiváló géncsendesítő képességeket eredményez.”
– Lipid nanorészecskés szállítórendszerek siRNS-alapú terápiákhoz | Wan C, Allen TM, Cullis PR 5
Kisebb gyártási tételek
A személyre szabott gyógyszereket gyakran kis tételekben gyártják egyetlen beteg vagy kis populáció számára, és gyakran kevesebb mint egy liternyi terméket eredményeznek. Ezzel szemben a hagyományos gyógyszergyártás hagyományos gyártási tételei gyakran több ezer liternyi gyógyszerterméket állítanak elő méretarányosan. A személyre szabott gyógyászat egyedi megközelítést igényel, és minden egyes tételt szigorú cGMP-körülmények között kell gyártani.
Mivel a személyre szabott gyógyászat a gyógyszerfejlesztés kiemelkedő fókuszába került, a gyógyszergyártó ipar számos vállalata úgy alakította ki a csővezetékeit, hogy a hagyományos, nagyüzemi gyógyszergyártás mellett a kis betegcsoportok számára tervezett kisebb tételeket is befogadja.
Az Exeleadnál kiterjedt erőfeszítéseket tettek e kis tételes terápiák befogadására, amelyek gyakran drága API-t és gyors átfutási időt igényelnek. A beteg- vagy antigénspecifikus gyógyszerek nem hagynak sok időt az oligonukleotid szekvenálásától addig a pillanatig, amíg a terméket nálunk kell elkészíteni. Ezek a rövid távú, néha csak hathetes előrejelzések olyan kihívásokat jelentenek, amelyeket meglévő rendszereink finomításával és innovatív formulázási technikák beépítésével sikerült leküzdenünk.”
Széles körű alkalmazások
Míg a személyre szabott orvoslás szinte bármilyen betegség kezelésére alkalmas, a jelenlegi kutatások elsősorban 1) az immunterápiákra, 2) a farmakogenomikával kiegészített hagyományos terápiákra és 3) a biomarkerekkel kapcsolatos rákkezelésekre összpontosítottak. A liposzómák és az LNP-k e gyógyszerkategóriák mindegyikéhez alkalmazhatók hordozóeszközként, ami nélkülözhetetlenné teszi őket a gyógyszerfejlesztés ezen új területén.

Hivatkozott cikkek
- Gao W, Hu C-MJ, Fang RH, Zhang L. Liposome-like Nanostructures for Drug Delivery. Journal of materials chemistry B, Materials for biology and medicine. 2013;1(48):10.1039/C3TB21238F. doi:10.1039/C3TB21238F.
- Kraft JC, Freeling JP, Wang Z, Ho RJY. A liposzóma és a lipid nanorészecske hatóanyag-leadó rendszerek új kutatási és klinikai fejlesztési trendjei. Journal of pharmaceutical sciences. 2014;103(1):29-52. doi:10.1002/jps.23773.
- Theresa M. Allen, Pieter R. Cullis. Liposzómális hatóanyag-leadó rendszerek: A koncepciótól a klinikai alkalmazásokig. Advanced Drug Delivery Reviews. 2013 Jan;65(1):36-48
- Esposito L. Mit jelent valójában a személyre szabott orvoslás? US News: Health Care. 2018 Jan;
- Wan C, Allen TM, Cullis PR. Lipid nanorészecskés hordozórendszerek siRNS-alapú terápiákhoz. Drug Deliv Transl Res. 2014 Feb;4(1):74-83. doi: 10.1007/s13346-013-0161-z.
- Vogenberg FR, Isaacson Barash C, Pursel M. Personalized Medicine: Part 1: Evolution and Development into Theranostics. Gyógyszerészet és terápia. 2010;35(10):560-576.